蜂蜜中酵母菌的分離鑒定及蜂蜜酒的研制
杜 剛,詹夢濤,馬堅司毅,普瓊梅,王 萌,楊海英*
(1.云南民族大學民族藥資源化學國家民族事務委員會-教育部重點實驗室,云南昆明 650500;2.云南民族大學化學與環境學院,云南昆明 650500)
蜂蜜是昆蟲蜜蜂從開花植物的花中采得的花蜜在蜂巢中釀制的蜜,其主要成分為單糖(葡萄糖、果糖)(占總糖的85%~95%),還含有豐富的酶、礦質元素、維生素、氨基酸等[1-2],稀釋的蜂蜜經酵母菌發酵可制成具有保健作用的蜂蜜酒[3-5]。蜂蜜酒需要較長時間發酵,可能在最終產品中引入令人不快的氣味[6-7]。蜂蜜酒的發酵過程若蜜汁的濃度過低,酵母菌會因碳源不足衰老自溶[8],而高濃度的蜜汁有較高的滲透壓,要求用于發酵的酵母需適應蜂蜜的抑菌和高滲環境。目前國內售的蜂蜜酒多為蜂蜜與酒勾兌而成,缺乏適用于蜂蜜酒發酵的菌株,篩選合適的菌株成為蜂蜜酒研制的關鍵問題。通常從高糖環境中篩選耐高糖酵母[9],研究表明原生的蜂蜜中含有耐高滲酵母菌及其他微生物[10-13],但鮮見從蜂蜜中分離菌株發酵蜂蜜酒的報道。云南野生蜂蜜資源豐富,本研究從云南文山的蜂蜜樣品中分離酵母菌,通過形態學鑒定和基因間隔序列(internal transcript space,ITS)分析進行菌種鑒定,經過感官評價篩選性能較優的酵母,并將其應用于蜂蜜酒研制,采用同時蒸餾萃取(simultaneous distillation extraction,SDE)-氣質聯用(gas chromatography-mass spectrometry,GC-MS)方法對發酵液進行揮發性成分分析[14-15],旨在為蜂蜜酒的開發提供菌種資源。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品采集
采自云南文山的12份蜂蜜樣品(編號1~12號)。
1.1.2 試劑
真菌基因組脫氧核糖核酸(deoxyribonucleic acid,DNA)提取試劑盒、瓊脂糖凝膠DNA回收試劑盒:天根生化科技(北京)有限公司;FTC-3000P型聚合酶鏈反應(polymerase chain reaction,PCR)儀:加拿大Funglyn Biotech公司;二氯甲烷、NaCl、葡萄糖、蛋白胨、酵母膏、瓊脂粉(均為分析純或生化試劑):國藥集團化學試劑有限公司。
1.1.3 培養基
酵母浸出粉胨葡萄糖(yeastextractpeptonedextrose,YPD)固體培養基:葡萄糖20 g/L,蛋白胨20 g/L,瓊脂20 g/L,酵母膏10 g/L,pH 自然,121 ℃滅菌25min。
蜂蜜稀釋液:蜂蜜與水按3∶7的體積比進行混合,75 ℃滅菌30 min。
1.2 儀器與設備
ZHWT-2012 恒溫搖床:上海智城分析儀器制造有限公司;LRH-250-G恒溫干燥培養箱:廣東省醫療器械廠;SW-CJ-2PD超凈工作臺:蘇凈安泰空氣技術有限公司;YXQLS-100SII立式壓力蒸汽滅菌器鍋:上海博迅實業有限公司;THERMOFISHER(ISQ)氣相色譜/質譜聯用儀、TR-5MS(30 m×0.25 mm×0.25 μm)毛細管色譜柱:美國賽默飛世爾科技(中國)有限公司;Scout SE電子天平:奧豪斯儀器(常州)有限公司;共同蒸餾萃取裝置(定制);HH-S2電熱恒溫水浴鍋:江蘇大地自動化儀器廠;GelDoc EZ型凝膠成像系統:美國Bio-Rad公司。
1.3 方法
1.3.1 酵母菌的分離純化
取1 g 蜂蜜樣品,加入9 mL無菌生理鹽水中,混勻后進行10倍梯度稀釋,選取適宜的濃度梯度,用涂布法接種于YPD 固體培養基,32 ℃恒溫培養箱倒置培養48 h,挑取具有典型酵母菌形態特征的菌落,平板劃線純化,直至獲得純培養菌株。挑取單菌落轉接到YPD 斜面,于32 ℃恒溫培養48 h,裝入密封袋置于4 ℃冰箱保藏。
1.3.2 酵母菌的鑒定
(1)菌株的形態特征
采用劃線法接種少量已純化好的菌種于YPD平板上,28 ℃培養48 h,觀察菌落干濕、隆起、顏色、菌落邊緣、表面光澤、質地等形態特征,選取單個菌落制成裝片光學顯微鏡高倍下觀察記錄細胞形態。
(2)聚合酶鏈式反應擴增和DNA 測序
以平板劃線法對保存斜面菌種活化驗純,挑取單菌落接種于YPD試管斜面作為種子,將每只試管種子接種于裝液量為150 mL/250 mL YPD液體培養基中,30 ℃培養5 d,再次驗純,培養物13 000 r/min 離心10 min,收集菌體。參照說明書,使用真菌基因組DNA提取試劑盒提取高質量的菌體基因組DNA。采用酵母菌通用引物ITS1F:5'-CTTGGTCATTTAGAGGAAGTAA-3'和ITS4B:5'-CAGGAGACTTGTACACGGTCCAG-3'對5.8S rDNA-ITS序列進行擴增[16]。25μLPCR反應體系為:2×PowerTaqPCRMasterMix12.5μL,引物各2 μL,模板2 μL,加無酶水補足25 μL。PCR反應條件為:95 ℃預熱3 min,95 ℃變性10 s,55 ℃退火30 s,72 ℃延伸45 s,72 ℃終延伸5 min,30 個循環后72 ℃末端延伸10 min,4 ℃保存[17]。切下500~750 bp左右的目標片段,使用瓊脂糖凝膠DNA回收試劑盒進行回收。PCR回收產物的測序工作由昆明碩擎測序公司完成。
1.3.3 ITS序列比對及系統發育樹分析
從GeneBank中獲取Z.siamensis、Z.mellis、Z.pseudorouxii、Z.rouxii和Z.sapae等菌株的ITS序列。在MEGA-X[18]中使用MUSCLE[19]進行多序列比對,并采用鄰接(neighbour-joining,NJ)法[20]以1 000次bootstrap[21]推測系統發育樹。
1.3.4 蜂蜜酒發酵酵母菌的篩選
將分離得到的菌株制備種子液,分別以5%的接種量接種到200 mL蜂蜜稀釋液中,每個菌株接種3瓶。28 ℃靜置培養30 d,制備蜂蜜酒。通過感官評價篩選出口感好、香味濃郁的發酵菌株。
1.3.5 蜂蜜酒揮發性成分分析
利用同時蒸餾萃取(SDE)-氣質聯用(GC-MS)法對蜂蜜酒樣品中揮發性成分進行分析,量取300 mL蜂蜜酒樣品置于500 mL樣品瓶,加入2.0 g NaCl,電熱套加熱樣品保持微沸,量取40 mL二氯甲烷置于溶劑瓶中,用60 ℃恒溫水浴加熱,蒸餾萃取2 h停止加熱。萃取溶劑中加入適量無水硫酸鈉靜置密封,置于冰箱中冰凍過夜,0.45 μm濾頭過濾后供GC-MS分析。
氣相色譜條件為TR-5MS毛細管柱(30 m×0.25 mm×0.25 μm);進樣口溫度250 ℃;載氣為氦氣(He);柱流量為0.5 mL/min;進樣模式:分流模式(分流比為20∶1)。
程序升溫:起始溫度為40 ℃,保持3 min,以4 ℃/min的速率升至100 ℃保持3 min,以10 ℃/min的速率升溫至230 ℃保持8 min。
質譜條件:電子電離(electronic ionization,EI)源,電子能量70 eV,倍增器電壓1 600 V。質譜掃描范圍為10~500 amu,掃描方式:全掃描,掃描速度:0.2 scan/s。離子源溫度為230 ℃,傳輸線溫度:250 ℃。
定性定量分析:各組分通過美國國家標準技術研究所(national institute of standards and technology,NIST)11譜庫檢索進行定性分析,采用面積歸一法進行定量分析。
2 結果與分析
2.1 菌株的分離及形態特征
從第3、5、7、9和10號蜂蜜樣品中分別分離到Y3、Y5、Y7、Y9和Y10等5株菌,其形態觀察結果見表1。由表1可知,5株菌的細胞形態相似,均呈橢圓,菌株Y3、Y5、Y9和Y10菌落特征相似,菌株Y7菌落較為扁平,其菌落及細胞形態如圖1所示,5株菌均呈現典型的酵母菌落特征,初步判定這5株菌為酵母菌。

表1 分離菌株菌落及細胞形態觀察結果Table 1 Colony and cell morphology of isolated strains

圖1 菌株Y3的菌落(a)及細胞(b)形態特征Fig.1 Colony (a) and cell (b) morphological characteristics of strain Y3
2.2 分離菌株分子鑒定結果
2.2.1 分離菌株的PCR 結果
5株分離菌株的PCR 擴增結果見圖2。由圖2可知,5株菌的PCR產物片段大小在500~750 bp 之間,判斷為5株酵母菌的ITS序列擴增產物。
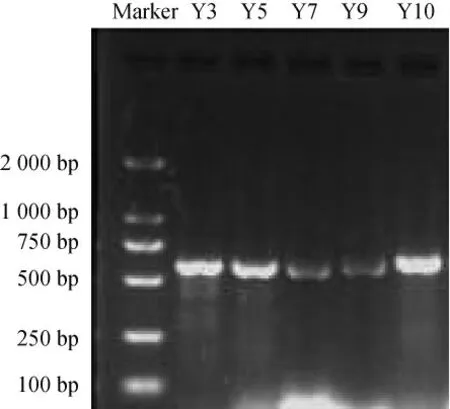
圖2 分離菌株PCR擴增的結果Fig.2 PCR amplification results of isolated strains
2.2.2 分離菌株的分子生物學鑒定結果
分離菌株5.8S rDNA-ITS序列相似性基本局部比對搜索工具(basic local alignment search tool,BLAST)查詢結果如表2所示,菌株Y3、Y5、Y9和Y10與菌株Zygosaccharomyces siamensisAB565769.1相似性在99%以上,菌株Y7與菌株Zygosaccharomyces siamensisAB565768.1相似性在99%以上。

表2 酵母5.8S rDNA-ITS序列相似性Blast查詢結果Table 2 Blast search results of 5.8S rDNA-ITS sequence similarity of isolated strains
分離菌株的ITS序列比對后,在MEGA-X中以鄰接法構建系統發育樹,結果見圖3。由圖3可知,菌株Y3、Y5、Y9和Y10與Zygosaccharomyces siamensisAB565769.1聚為一簇,Y7與Zygosaccharomyces siamensisAB565768.1聚為一簇。初步鑒定5株酵母菌均為暹羅接合酵母(Zygosaccharomyces siamensis)。

圖3 分離菌株基于ITS基因序列的系統進化樹Fig.3 Phylogenetic tree of isolated strains based on ITS gene sequences
2.3 蜂蜜酒發酵酵母菌的篩選
以5株酵母菌發酵蜂蜜酒,其感官評價結果見表3。

表3 酵母菌發酵蜂蜜酒的感官評價Table 3 Sensory evaluation of mead fermented with yeasts
由表3可知,發酵得到的蜂蜜酒都呈淡黃色,其中菌株Y7發酵的蜂蜜酒雜味較多,菌株Y3、Y5、Y9和Y10發酵蜂蜜酒的香型比較接近,都有獨特果香,其中以菌株Y3發酵的蜂蜜酒酒香和果香最為濃郁,發酵過程產生二氧化碳氣泡,入口微辣,口感清爽,菌株Y5、Y9和Y10的酒香和果香較淡,選擇菌株Y3進行蜂蜜酒發酵進一步研究。
2.4 蜂蜜酒發酵樣品揮發性成分分析
采用GC-MS對Y3發酵蜂蜜酒樣品的揮發性成分進行分析,其總離子流色譜圖見圖4。
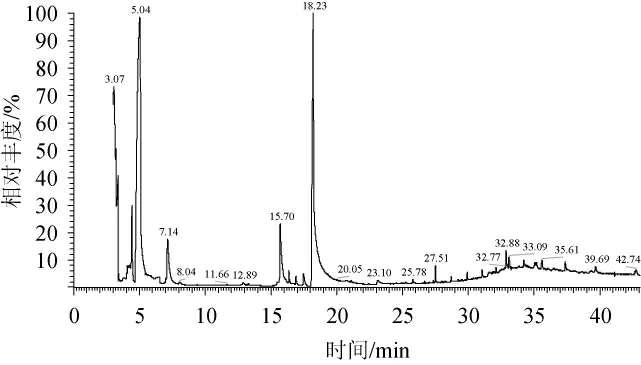
圖4 蜂蜜酒樣品揮發性成分GC-MS分析總離子流圖Fig.4 Total ion chromatogram of volatile components in the mead sample analysis by GC-MS
經過NIST11譜庫檢索得到揮發性化合物的種類,計算相對含量結果見表4。由表4可知,樣品共檢出41種揮發性成分,其中酯類14種,醇類7種,酸類2種、醛酮4種、烷烴12種。醇類物質和酯類物質是發酵樣品香氣的主要成分,醇類組分有2-甲基丙醇、苯乙醇、異戊醇等。其中,2-苯乙醇和異戊醇的相對含量分別為58.11%和25.43%;異戊醇具香蕉香味,刺舌頭,微澀。2-苯乙醇與玫瑰花香相似,微帶苦澀感。酯類物質有4-羥基丁酸乙酰酯,3-甲基戊酸乙酯,乙酸戊酯,辛酸乙酯,這些酯類產生的香氣相互綜合,賦予發酵樣品濃郁的酯香。此外,在發酵樣品中檢測到酸類、醛類,含量低,可能對發酵樣品香氣的直接貢獻不大,但使發酵樣品的香氣更加飽滿。

表4 蜂蜜酒樣品揮發性成分GC-MS分析結果Table 4 Results of volatile components in the mead sample analysis by GC-MS

續表
3 結論
本研究從12份云南文山蜂蜜樣品中分離得到5株酵母菌,結合菌株形態學特征和分子生物學分析,鑒定5株酵母菌均為暹羅接合酵母(Zygosaccharomyces siamensis)。5株酵母菌都可發酵蜂蜜稀釋液,其中菌株Y3發酵的蜂蜜酒酒香和果香最為濃郁。以SDE-GC/MS方法分析菌株Y3發酵蜂蜜酒,蜂蜜酒樣品中含41種揮發性成分,2-苯乙醇和異戊醇相對含量達到58.11%和25.43%,是發酵液中主要的揮發性成分。實驗結果為蜂蜜酒開發提供了菌株資源。

