北沙參乙醇分級多糖的理化性質及抗氧化活性研究
景永帥 金 姍 張丹參 張瑞娟王非凡 鄭玉光 吳蘭芳
(1. 河北科技大學化學與制藥工程學院,河北 石家莊 050018;2. 河北中醫學院藥學院,河北 石家莊 050200)
北沙參(GlehniaRadix)為傘形科植物珊瑚菜(GlehnialittoralisFr. Schmidt ex Miq.)的干燥根,是常用的補陰補氣食材,具有養陰潤肺功能[1]。它是衛生部公布的藥食兩用資源,主要分布在河北、山東和內蒙古等地。北沙參中含有揮發油類、香豆素類、多糖類和聚炔類等化學成分,其中多糖類含量最高,也是其主要活性成分之一,具有免疫調節、抗氧化和抗腫瘤等作用[2-3]。
乙醇分級沉淀法是制備多糖常用的提取純化方法,它是將原料熱水浸提后逐步提高乙醇的體積濃度來純化多糖,多糖的得率和組成隨著乙醇在醇沉時濃度的不同而變化[4]。此法優勢在于成本低、耗時短,同時又能維持較高得率,且不同乙醇濃度沉淀得到的多糖具有不同的生物活性及應用價值[5]。實驗室[2,6-7]前期優化了北沙參粗多糖的提取工藝,并發現北沙參多糖具有較好的清除自由基活性。
目前,關于北沙參乙醇分級純化多糖的研究尚未見報道,為了尋找一種簡單高效純化北沙參多糖組分的方法,更好地探究成分與活性之間的關系。在前期研究[2,7]的基礎上,試驗擬以北沙參為研究對象,提取北沙參中多糖成分,并用終濃度為30%,50%,70%的乙醇對多糖進行分級純化,制備得到4種不同組分的北沙參多糖,并測定4種組分多糖的可溶性總糖含量、蛋白含量、黏度、保水性、保油性、單糖組成、抗氧化活性等,以期為北沙參多糖的進一步開發和利用提供參考。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
北沙參:河北安國產,經河北中醫學院藥學院生藥教研室鄭玉光教授鑒定為傘形科珊瑚菜(GlehnialittoralisFr. Schmidt ex Miq.)的根;
3,5-二硝基水楊酸:分析純,天津市光復精細化工研究所;
考馬斯亮藍:分析純,合肥博美生物科技有限責任公司;
金龍魚油:益海嘉里食品營銷有限公司;
DPPH:分析純,上海阿拉丁生化科技股份有限公司;
硫酸亞鐵:分析純,恒誠化工有限公司;
過氧化氫:分析純,天津政成化學制品有限公司;
苯酚:分析純,天津市永大化學試劑有限公司;
其他試劑均為分析純。
1.1.2 主要儀器設備
紫外—可見分光光度計:UV-752型,上海光譜儀器有限公司;
傅里葉變換紅外光譜儀:S-100型,珀金埃爾默儀器有限公司;
液相色譜儀:LC1220型,安捷倫科技(中國)有限公司;
液相色譜儀:e2695型,美國Alliance公司;
場發射掃描電鏡:S-4800-1型,株式會社日立制作所;
差熱—熱重聯用熱分析儀:STD-2960型,美國TA儀器公司;
旋轉黏度計:NDJ-1型,上海昌吉地質儀器有限公司。
1.2 方法
1.2.1 北沙參各分級醇沉多糖制備 取粉碎后的北沙參于80 ℃水浴鍋中,用3倍體積80%乙醇除脂2次,干燥備用。稱取一定量除脂后的北沙參,用30倍體積蒸餾水回流加熱提取2次,合并提取液,冷卻抽濾,旋蒸至黏稠態,加無水乙醇使乙醇終濃度為30%,冷藏過夜,離心,將沉淀干燥得30%組分多糖GLP-30。離心后的液體旋蒸,回收乙醇至液體黏稠,再加入無水乙醇使乙醇終濃度為50%進行醇沉,冰箱過夜,離心后將沉淀干燥得50%組分多糖GLP-50。同樣的操作步驟得GLP-70,對70%濾液進行旋蒸回收乙醇,裝入透析袋(截留分子量為3 000 Da),流水、蒸餾水依次透析24 h,蒸干得剩余組分多糖命名為GLP-剩余。
1.2.2 多糖可溶性總糖含量、蛋白質含量的測定
(1) 可溶性總糖含量:采用苯酚—硫酸法[8]。
(2) 蛋白含量:采用考馬斯亮藍法[9]。
1.2.3 黏度的測定 分別配制濃度為0.5,1.0 mg/mL的多糖粗品溶液各300 mL,室溫條件下,旋轉黏度計的剪切速率為60 s-1條件下,測定其表觀黏度[10]。
1.2.4 保水性和保油性的測定 參照文獻[11]。
1.2.5 紫外—可見光譜分析 取2.5 mg各多糖組分加適量蒸餾水溶解定容于25 mL容量瓶,在200~800 nm范圍內用紫外—可見分光光度計掃描。
1.2.6 紅外光譜掃描 取多糖樣品與干燥的KBr粉末研磨均勻,壓成薄片,在400~4 000 cm-1范圍內進行紅外光譜掃描。
1.2.7 微觀形態測定 分別取4種多糖通過導電帶吸附至樣品臺上,經噴金處理后,場發射掃描電鏡進行分析,加速電壓3.0 kV,分辨率7.2 mm,分別放大幾個倍數,拍攝并記錄各多糖的固體形貌。
1.2.8 差示掃描量熱分析和熱解重量分析 分別稱取各多糖組分2.0 mg,升溫速率10 ℃/min,升溫至800 ℃,進行差示掃描量熱分析(DSC)和熱解重量分析(TGA)。以溫度、失重率(某一溫度下失重后樣品的實測質量與樣品總質量的比值)分別為X、Y軸,繪制熱重變化曲線[10]。
1.2.9 單糖組成分析 選取8種單糖(甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖)作為標準品。根據文獻[12]略作修改,Eclipse XDB-C18色譜柱(4.6 mm250 mm,5 μm);檢測波長245 nm;柱溫30 ℃;上樣量20 μL;流速1 mL/min;流動相為磷酸鹽緩沖液(0.1 mol/L,pH為6.85)—乙腈(83∶17,體積比);洗脫方式為等度洗脫。
1.2.10 分子量的測定 采用凝膠滲透色譜(GPC)測定北沙參各多糖的分子量。分別稱取5 mg標準葡聚糖T5 000、T50 000、T150 000、T270 000,加5.0 mL蒸餾水溶解,分別上G-100凝膠色譜柱。待樣品滲下后,加入3倍體積蒸餾水滲下,關閉色譜柱下方管口,加滿蒸餾水,裝好柱頭。打開恒流泵開始洗脫。設置自動部分收集器使每管收集10 mL。以有效分配系數Kav為縱坐標,lgM為橫坐標作標準曲線,Kav根據式(1)計算:
(1)
式中:
Kav——有效分配系數;
Ve——待測樣品的洗脫體積,mL;
V0——用藍色葡聚糖確定凝膠柱的空體積,mL;
Vt——葡萄糖確定凝膠柱的總柱體積,mL。
配制5 mL濃度為1.0 mg/mL的多糖溶液,按上述方法加樣,裝柱頭之前收集的體積記作前體積。收集完畢后測量各管體積,苯酚—硫酸法測定各管吸光度,檢測樣品出峰液分布情況,求出相應峰體積,計算出Kav。根據標準曲線方程計算出各多糖分子量及分布[13]。
1.2.11 DPPH自由基和羥基自由基清除能力的測定
參照文獻[14]。
2 結果與分析
2.1 北沙參分級多糖的提取率、可溶性總糖含量、蛋白質含量和黏度
經乙醇分級得到4個北沙參多糖GLP-30、GLP-50、GLP-70和GLP-剩余,分別測定各組分多糖的得率、可溶性總糖含量、蛋白含量、黏度、保水保油性等,結果如表1所示。
由表1可知:

表1 北沙參各分級醇沉多糖的得率及理化性質
(1) 隨著乙醇體積分數的逐漸增加,北沙參多糖的可溶性總糖含量降低,乙醇分級后的水提取中多糖為主要成分,含有少量蛋白質。GLP-30中可溶性總糖含量最高,蛋白質含量最少。
(2) 在多糖濃度相同時,分級多糖黏度大小為GLP-70>GLP-剩余>GLP-50>GLP-30。分級多糖的黏度具有濃度依賴性,隨多糖濃度的增大,4種多糖的黏度均變大。多糖黏度受分子間的聚集、相對分子質量大小和成分組成相互作用影響[15]。
(3) 保水量大小為:GLP-30>GLP-70>GLP-50>GLP-剩余。保油量反映水膠體的功能特性,代表吸油能力。保油量大小為:GLP-50>GLP-70>GLP-30>GLP-剩余。多糖或蛋白質分子結構中含有許多親水基團,如羥基、羧基、羧酸根等,這些基團水化后會形成黏稠膠體溶液,從而提高保水性和保油性。同時蛋白質分子間具有三維網狀結構,通過大分子鏈上大量的親油基團的作用,油分子被包裹在網絡結構中,從而達到吸油保油的目的[16]。GLP-30具有較好的保水性,說明其結構中含有較多的親水基團;GLP-50表現出較好的保油性,可能是由于其蛋白含量相對較高。
2.2 紫外—可見光譜分析
如圖1所示,4個組分的紫外掃描圖譜相似,均在280 nm 處有蛋白質的特征吸收峰[5],且吸收峰的強弱順序為GLP-剩余>GLP-50>GLP-70>GLP-30,表明這4種多糖均含有一定量的蛋白質,與考馬斯亮藍法測定蛋白含量結果基本一致。各樣品在510 nm波長處均沒有吸收,說明多糖中不存在黃酮類物質。

圖1 北沙參各分級醇沉多糖的紫外—可見光譜圖
2.3 紅外光譜分析
由圖2可知,各組分多糖紅外光譜波峰趨勢相似,在3 400 cm-1附近具有較寬的吸收峰,為O—H的伸縮振動。2 930 cm-1處較弱的吸收峰是由C—H的伸縮振動引起的,1 637 cm-1附近出現的可能是O—H的彎曲振動吸收峰、C—O吸收峰或糖醛酸的COO—非對稱伸縮振動吸收峰,1 021 cm-1處為醚鍵的吸收峰,849 cm-1處為α-糖苷鍵的吸收峰[17],均具有多糖的特征吸收峰。
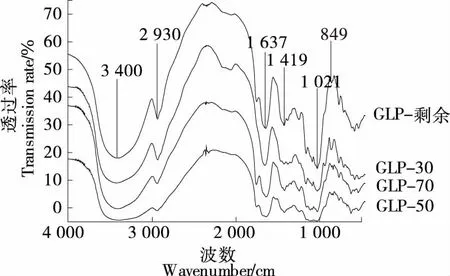
圖2 北沙參各分級醇沉多糖的紅外光譜圖
1 419 cm-1附近較小的吸收峰是N—H彎曲振動和C—N 伸縮振動的酰胺Ⅱ特征峰,表明分級多糖中有少量蛋白與糖結合[18]。GLP-30與其他3個組分在950~1 450 cm-1范圍內的吸收峰有一定差別,提示GLP-30蛋白含量較低,與考馬斯亮藍法測定結果一致。
2.4 掃描電子顯微鏡分析
從圖3可以觀察到4個組分的固體形貌有一定差異性,GLP-30孔洞較大,表面高低不平有凸起堆疊。GLP-50孔洞較少,表面輕微凸起,較為光滑。GLP-70表面有大部分凸起,呈碎屑狀堆積,顆粒較大,有較多孔洞,表面最為粗糙,可能與其黏度較大有一定關系。GLP-剩余表面光滑,質地緊致。
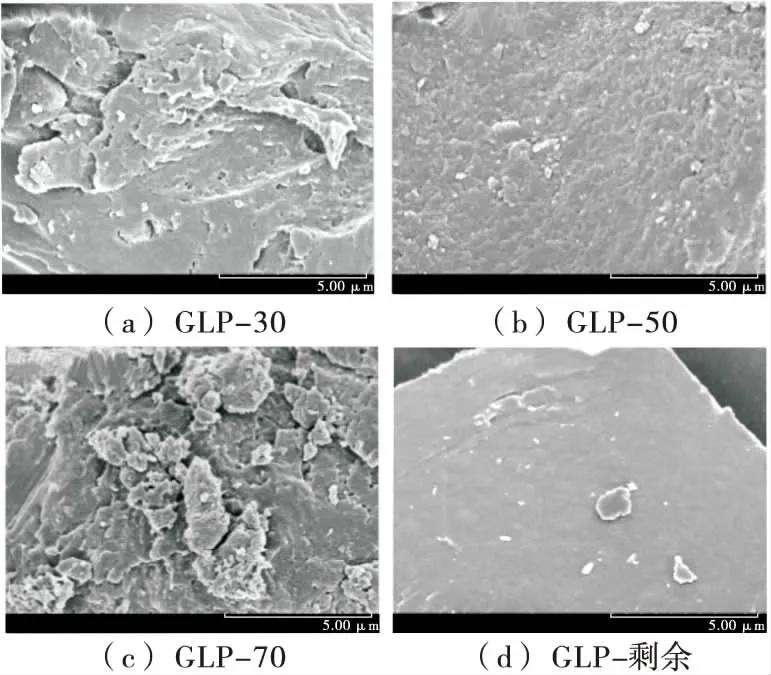
圖3 北沙參各分級醇沉多糖的掃描電鏡圖
2.5 差示掃描量熱—熱重分析
根據差示掃描量熱曲線(DSC)可以看出吸熱峰和放熱峰數量。根據熱重曲線(TGA)可以了解北沙參多糖熱裂解溫度以及發生失重次數,在該區域溫度,多糖發生了分解,化學鍵受到了破壞[19]。GLP-30、GLP-50、GLP-70、GLP-剩余的差示掃描量熱—熱重圖譜如圖4所示。由圖4可知,當加熱溫度從40 ℃升溫至400 ℃時,4個組分均首先出現一個吸熱峰隨后出現一個放熱峰[20]。分析吸熱峰的出現可能是由于多糖的吸水、熔化或者分解。隨著溫度的升高,多糖先發生失水過程,GLP-30、GLP-50、GLP-70、GLP-剩余分別于307.06,289.27,282.93,304.06 ℃ 發生分解,最后剩余的重量是灰分。4種組分的差示掃描量熱結果相差較大,說明各組分多糖的糖鏈空間結構差別較大。
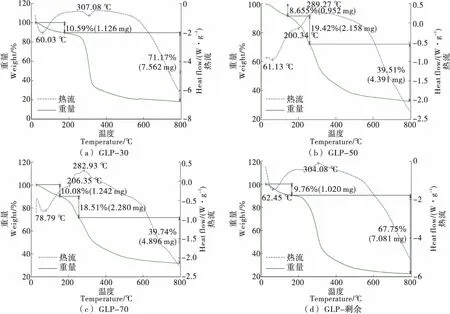
圖4 北沙參各分級醇沉多糖的差示掃描量熱—熱重圖
2.6 單糖組成
由圖5和表2可知,4種組分多糖中GLP-30、GLP-50主要含有半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖。GLP-70、GLP-剩余主要含有甘露糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖。試驗結果與杜寶香等[21]和任浩娜[22]所得的結果類似,但未檢測到葡萄糖醛酸和鼠李糖,可能是由北沙參的產地差異性和其含量較低導致。
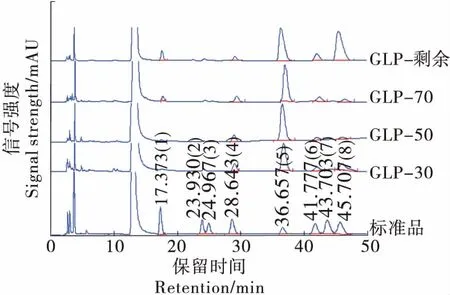
1. Man甘露糖 2. Rha鼠李糖 3. GlcUA葡萄糖醛酸 4. GalUA半乳糖醛酸 5. Glc葡萄糖 6. Gal半乳糖 7. Xyl木糖 8. Ara阿拉伯糖
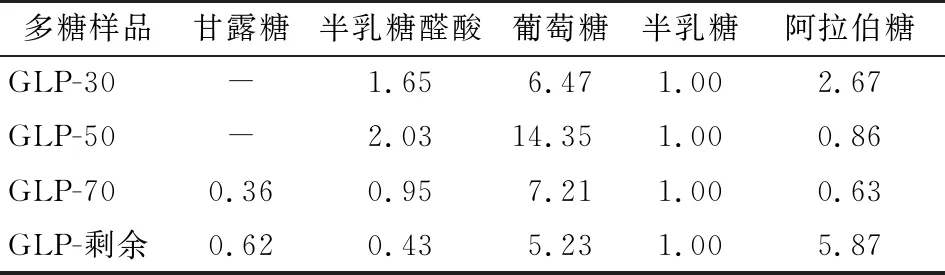
表2 北沙參各分級醇沉多糖的單糖組成和含量比
2.7 分子量
測得標準葡聚糖在試驗濃度范圍內,有效分配系數(Kav)與lgM呈良好的線性關系,回歸方程為:y=0.409 4x+2.321 2,R2=0.998 77。
以峰值數據管數的總體積V為橫坐標,吸光度為縱坐標,繪制特征圖譜,如圖6所示。根據標準曲線方程,求得多糖樣品分子量大小,如表3所示。分子量大小為:GLP-30>GLP-50>GLP-70>GLP-剩余,不同濃度的乙醇分級得到的北沙參多糖的分子量不同,隨著乙醇濃度的增大分子量逐漸降低。李紅法等[23]研究發現黃芪多糖分子量的變化,與試驗結果一致,可能是由于乙醇體積分數的變化會影響沉淀中多糖的結構。
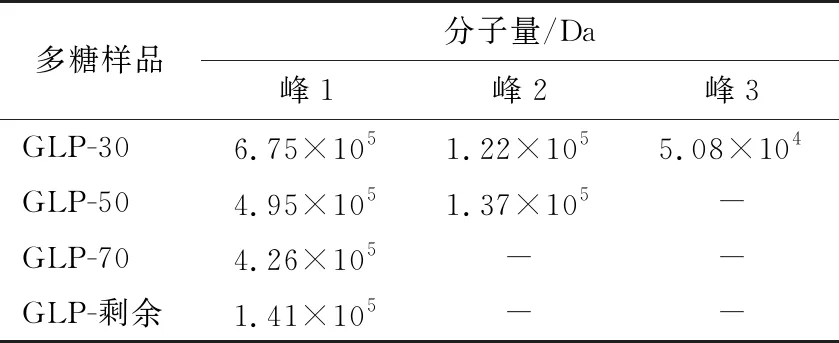
表3 北沙參各分級醇沉多糖分子量分布及其大小
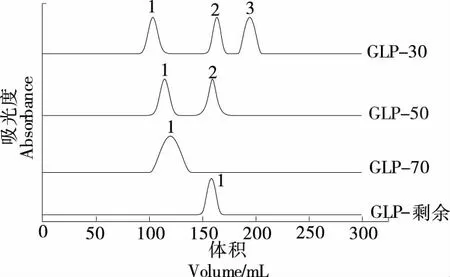
圖6 北沙參各分級醇沉多糖組分的凝膠滲透色譜圖
2.8 抗氧化活性
2.8.1 清除DPPH自由基 由圖7可知,隨著糖濃度的增加,GLP-30、GLP-50、GLP-70和GLP-剩余對DPPH自由基的清除能力逐漸增強,呈濃度依賴性。半數清除率(IC50)值最小,說明其清除自由基能力最強。4種多糖及VC清除DPPH自由基能力的大小為:VC(0.005 mg/mL)>GLP-50 (0.123 mg/mL)>GLP-剩余 (0.299 mg/mL)>GLP-70 (0.364 mg/mL)>GLP-30 (1.822 mg/mL),上述結果表明北沙參多糖具有較好的清除DPPH自由基的能力。
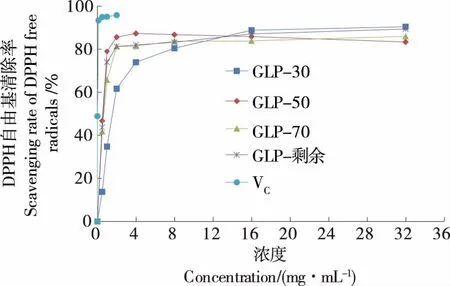
圖7 北沙參各分級醇沉多糖對DPPH自由基清除作用
2.8.2 清除羥基自由基 如圖8所示,4種多糖對羥基自由基清除能力均隨濃度的增加而增大,并有良好線性關系。清除羥基自由基能力大小為VC(0.072 mg/mL)>GLP-50 (3.809 mg/mL)>GLP-30 (5.105 mg/mL)>GLP-70 (6.151 mg/mL)>GLP-剩余 (10.529 mg/mL)。4種多糖均低于陽性對照VC的IC50值。上述結果表明,北沙參多糖具有一定的羥基自由基清除能力,與周紅英等[1]的研究一致。
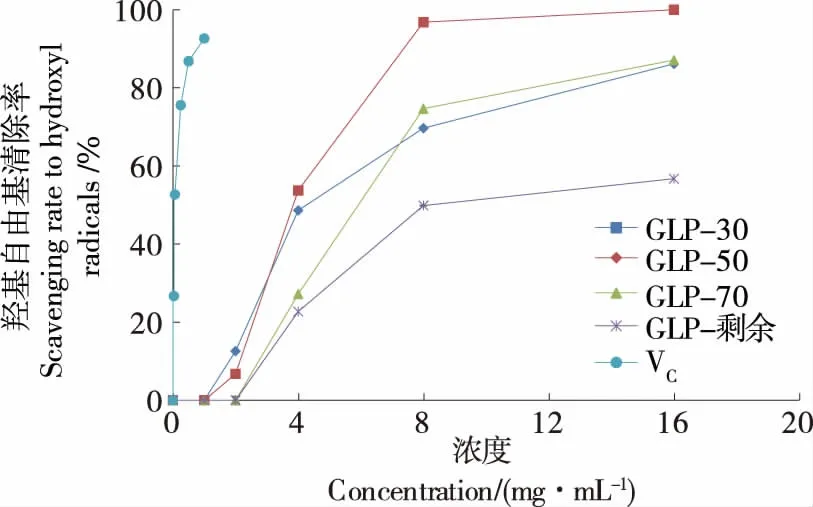
圖8 北沙參各分級醇沉多糖對羥基自由基清除作用
多糖抗氧化的構效關系會受到分子量、蛋白含量、糖醛酸含量、活性羥基數量、分子構象等方面的影響。王佳等[5]報道虎杖、麻黃和甘草多糖的抗氧化活性與糖醛酸含量呈正相關。許海棠等[24]報道山豆根多糖的抗氧化活性與其純度,以及多酚和蛋白含量等有關。試驗中GLP-50也表現出類似結果,因此分析半乳糖醛酸的含量較高是其抗氧化活性高的主要原因,同時也受蛋白含量影響。另外,GLP-50清除DPPH自由基的IC50值為0.123 mg/mL,對比實驗室前期制備的北沙參粗多糖的清除DPPH自由基的IC50值(1.99 mg/mL)[7],經乙醇分級沉淀后的多糖清除DPPH自由基效果明顯提高。說明乙醇分級沉淀后的北沙參多糖在清除DPPH自由基功效方面具有良好利用價值。
3 結論
試驗采用一種簡單、高效的方法——乙醇分級沉淀法純化北沙參多糖,得到GLP-30、GLP-50、GLP-70和GLP-剩余4個組分,經研究顯示,不同濃度乙醇沉淀會影響北沙參多糖的得率、單糖組成、蛋白含量、分子量、黏度等理化性質,從而改變多糖的生物活性,各多糖組分分子量隨乙醇濃度的增加而逐漸降低;GLP-50表現出最高得率和最好的抗氧化活性,其半乳糖醛酸含量最高并且含有較多的蛋白質。因此,推測半乳糖醛酸的含量較高是北沙參抗氧化活性高的主要原因,同時也受蛋白含量影響。綜上,50%乙醇更適宜沉淀制備北沙參多糖,且所得多糖的抗氧化性比北沙參粗多糖的活性較強。后續研究可進一步深入解析北沙參多糖結構并探索其體內抗氧化活性功能,為北沙參多糖的構效關系研究和產品開發提供參考依據。

