射頻消融術和腹腔鏡肝切除術治療復發性肝癌的臨床療效及遠期生存情況分析
張波濤,崔智飛,段希斌,閆媛媛
鄭州大學附屬鄭州中心醫院超聲醫學科,鄭州 450000
目前治療復發性肝癌的主要手段包括腹腔鏡肝切除術(laparoscopic hepatectomy,LH)、射頻消融術(radio frequency ablation,RFA)、肝移植等,對于不同的醫療機構,其治療的選擇標準存在差異[1-2]。LH是治療單個復發病灶且肝功能分級為A級的患者最為有效的方法,對于存在多個復發病灶的患者,可選擇RFA或LH治療[3-4]。肝癌術后復發是目前的普遍現象,但國內外仍無推薦治療復發性肝癌的明確方案[5-6]。本研究將58例復發性肝癌患者分為兩組,分別進行LH和RFA治療,觀察兩組患者治療后的血清肝功能指標、腫瘤標志物水平及并發癥發生情況和遠期生存情況,現報道如下。
1 對象與方法
1.1 研究對象
選取2015年1月至2016年6月于鄭州大學附屬鄭州中心醫院進行治療的58例復發性肝癌患者。納入標準:①首次診斷時符合《原發性肝癌診療規范(2017年版)》[7]中肝癌的診斷標準,復發時經病理檢查確診;②首次肝切除手術在本院實施;③經檢查未出現肝細胞癌合并血管侵犯;④復發性肝癌符合米蘭標準;⑤肝功能分級為A級或B級;⑥臨床資料齊全且堅持隨訪。排除標準:①合并重要器官功能障礙,無法接受手術者;②合并嚴重心腦血管疾病者;③合并凝血功能障礙者。依據隨機數字表法將患者分為LH組(接受LH治療)和RFA組(接受RFA治療)。兩組患者的性別、年齡、肝功能分級及腫瘤直徑比較,差異均無統計學意義(P>0.05)(表1),具有可比性。本研究經醫院倫理委員會審批通過,所有患者及家屬均對本研究知情并簽署知情同意書。
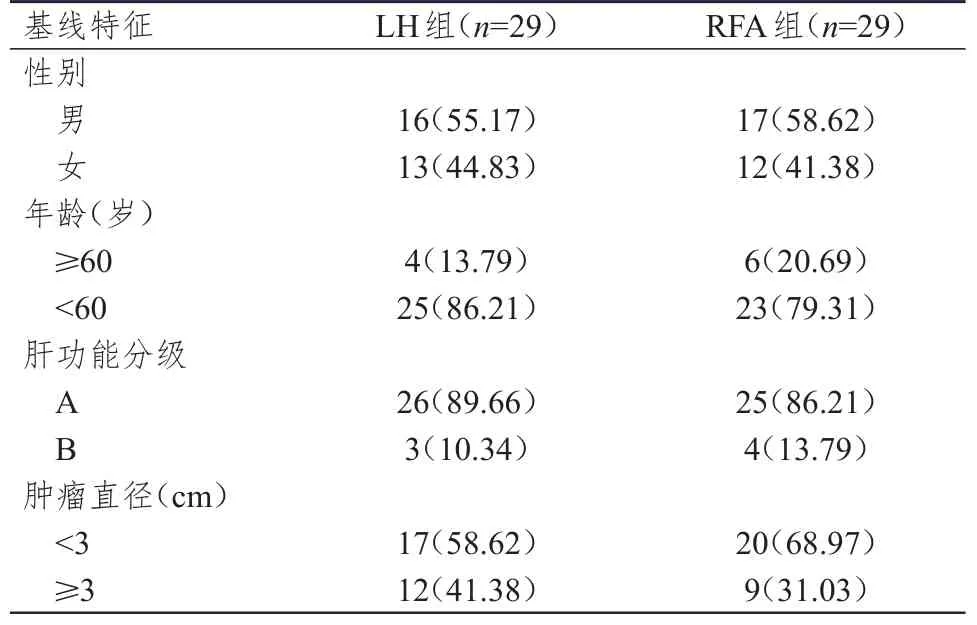
表1 兩組患者的基線特征[n(%)]
1.2 治療方法
LH組患者接受LH治療。術前采用GE LOGIQ E9超聲診斷儀詳細檢查并精準定位病灶位置,使用STORZ腹腔鏡系統。麻醉后,在臍下開1 cm左右的切口,將氣腹針插入并建立氣腹。通過該切口放入探頭,觀察腫瘤的具體位置及相應情況,探查后將腹腔鏡器械放入腹腔內。應用超聲刀撥開肝臟周圍韌帶,將肝臟充分游離,再進行膽道、血管結扎和肝門阻斷,對腫瘤組織進行局部切除。術后將標本常規送檢,確認切緣無殘留腫瘤細胞。
RFA組患者接受RFA治療。使用LDRF-120S多極射頻消融儀,順利進行基礎麻醉后,在彩色多普勒超聲儀的引導下標記穿刺部位。消融靶區范圍大于腫瘤邊緣1 cm,間隔15 min左右,對<3 cm的腫瘤采取一點一針的消融方法,>3 cm的腫瘤采取多點多針的消融方法。消融結束15 min后采用超聲造影記錄動態造影的全過程錄像,實時監測RFA區域造影劑灌注情況,若存在殘余灶,及時采取補充消融,直至最大限度地消融病灶。RFA完成后將消融針尖加熱到80℃,再拔針止血并對針道進行消融,術后穿刺點再次消毒,創可貼覆蓋。
1.3 觀察指標
比較治療前、治療后4周兩組患者的血清肝功能指標和腫瘤標志物水平,肝功能指標包括總膽紅素(total bilirubin,TBIL)、天冬氨酸轉氨酶(aspartate aminotransferase,AST)、丙氨酸轉氨酶(alanine aminotransferase,ALT),腫瘤標志物包括癌胚抗原(carcinoembryonic antigen,CEA)、磷脂酰肌醇蛋白聚糖3(glypican 3,GPC3)、甲胎蛋白(alpha-fetal protein,AFP)。觀察并記錄兩組患者術后并發癥發生情況,包括肺部感染、肝區疼痛、發熱、出血、胸腔積液。
1.4 隨訪
通過電話或門診的方式對患者進行隨訪,每12周隨訪1次(若發現復發立即入院治療,出院后從第4周開始返院復查,隨后每隔12周進行1次復查),記錄并觀察兩組患者的3年無進展生存情況和總生存情況,隨訪截止時間為2019年10月。
1.5 統計學方法
采用SPSS 23.0軟件對數據進行統計分析。計數資料以例數和率(%)表示,組間比較采用χ2檢驗;計量資料以均數±標準差(±s)表示,組間比較采用獨立樣本t檢驗,組內比較采用配對樣本t檢驗;采用Kaplan-Meier法繪制生存曲線,組間比較采用Log-rank檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 血清肝功能指標及腫瘤標志物水平的比較
治療前,兩組患者的血清 TBIL、AST、ALT、CEA、GPC3、AFP水平比較,差異均無統計學意義(P>0.05)。治療后4周,RFA組患者的血清AST、ALT水平均高于LH組,差異均有統計學意義(P<0.05);治療后4周,兩組患者的血清TBIL、CEA、GPC3、AFP水平比較,差異均無統計學意義(P>0.05)。(表2)
表2 治療前后兩組患者血清肝功能指標及腫瘤標志物水平的比較(±s)
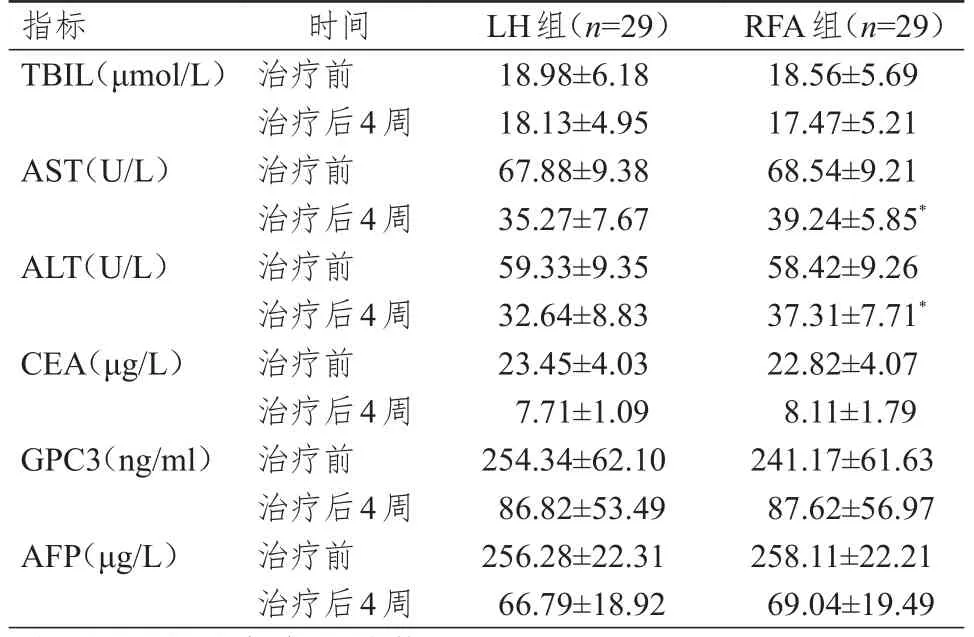
表2 治療前后兩組患者血清肝功能指標及腫瘤標志物水平的比較(±s)
注:*與LH組治療后4周比較,P<0.05
指標TBIL(μmol/L)AST(U/L)ALT(U/L)CEA(μg/L)GPC3(ng/ml)AFP(μg/L)時間治療前治療后4周治療前治療后4周治療前治療后4周治療前治療后4周治療前治療后4周治療前治療后4周LH組(n=29)18.98±6.18 18.13±4.95 67.88±9.38 35.27±7.67 59.33±9.35 32.64±8.83 23.45±4.03 7.71±1.09 254.34±62.10 86.82±53.49 256.28±22.31 66.79±18.92 RFA組(n=29)18.56±5.69 17.47±5.21 68.54±9.21 39.24±5.85*58.42±9.26 37.31±7.71*22.82±4.07 8.11±1.79 241.17±61.63 87.62±56.97 258.11±22.21 69.04±19.49
2.2 術后并發癥發生率的比較
LH組患者的并發癥總發生率為20.69%(6/29),高于RFA組的3.45%(1/29),差異有統計學意義(χ2=4.062,P=0.044)。(表3)
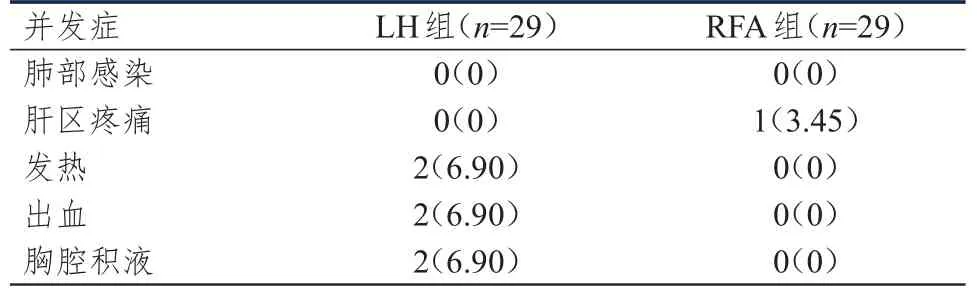
表3 兩組患者的術后并發癥發生情況[n(%)]
2.3 生存情況的比較
兩組患者的3年無進展生存情況和3年總生存情況比較,差異均無統計學意義(P>0.05)。(圖1、圖2)
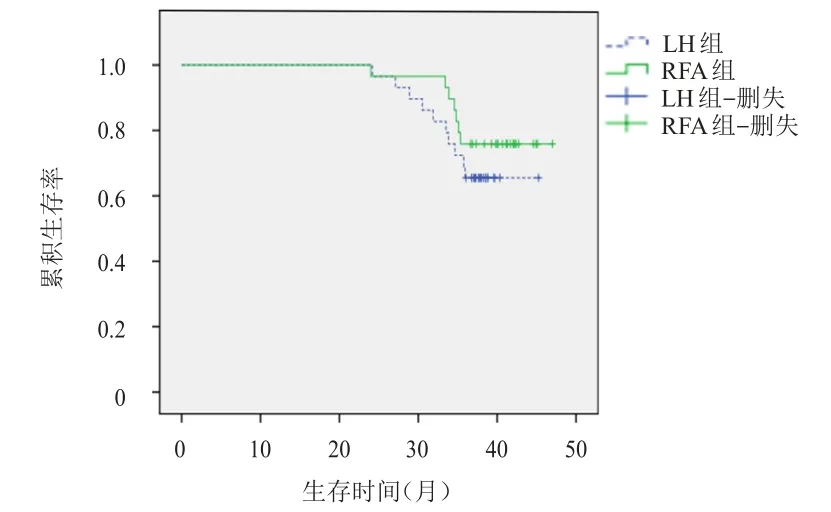
圖1 LH組(n=29)和RFA組(n=29)患者的無進展生存曲線

圖2 LH組(n=29)和RFA組(n=29)患者的總生存曲線
3 討論
本研究中,LH組和RFA組患者的3年無進展生存情況和3年總生存情況比較,差異均無統計學意義(P>0.05)。說明對復發性肝癌患者遠期生存情況的主要影響因素為患者的疾病狀況,并不是干預治療方法(LH或RFA)。在超聲、磁共振成像(MRI)或計算機斷層掃描(CT)引導下均可完成RFA治療,本研究中的患者由超聲引導完成RFA治療,可最大程度地保存殘肝并降低對殘肝的損傷,可為患有嚴重肝硬化或不能耐受LH治療的患者提供根治的機會;RFA還具有微創、可進行局部麻醉等優勢,可提高患者依從性,以上均是本研究中曾接受RFA治療的患者在腫瘤復發時依然選擇RFA治療的原因。
肝功能指標在機體內可反映肝臟情況,肝臟受損則肝功能指標會高于正常值。本研究結果顯示,治療后4周,RFA組患者的ALT、AST均高于LH組(P<0.05)。分析原因:RFA不僅對腫瘤細胞進行消融,同時也會使周邊少數的正常肝組織出現凝固壞死,造成肝功能受到短暫性損傷。治療后4周,兩組患者的AST、ALT水平均較治療前下降,至正常范圍內,顯示腫瘤組織已有效地被清除,肝功能又恢復正常。LH組術中可對指定腫瘤組織進行局部切除,不會對周圍正常組織及術后肝功能造成影響。因此,從本研究中的數據分析,應全面評估RFA患者術前的肝功能,術后給予相應的保肝治療。
目前普遍獲得認可的檢測肝癌的指標是AFP,GPC3在肝癌患者血液或肝臟組織中表達,通常在非正常情況下才會表達,CEA對肝癌具有輔助診斷意義[8-10]。研究顯示,AFP聯合CEA、GPC3可提高原發性肝癌的診斷準確度[11-13]。本研究結果顯示,治療后4周兩組患者的AFP、CEA、GPC3水平均降低且趨向正常,組間比較,差異均無統計學意義(P>0.05),說明這兩種治療方法均對原發性肝癌具有療效。國內外相關研究指出,對于肝臟表面或靠近大血管存在腫瘤的患者,偏向于采用LH治療,這是由于RFA在操作過程中可能損傷大血管造成大出血;若腫瘤附著于肝臟表面,RFA在超聲引導穿刺的過程中會使周圍臟器受損,且易產生針道偏離,導致不能完全消融[14-15]。反之則推薦采用RFA治療,因為這種情況采用LH治療則需要切開更多的肝臟組織,會對肝臟造成副損傷。但只要精準控制針道位置和消融面積,RFA不會誤傷鄰近血管,是相對安全的。
本研究結果還顯示,LH組患者的并發癥總發生率為20.69%,高于RFA組的3.45%,差異有統計學意義(P<0.05),表明RFA治療原發性肝癌的并發癥相對較少,體現出RFA微創技術的特點及優勢。LH術后復發率普遍偏高,故術后應按時復查。相關臨床實踐指南指出LH術后第1年應每隔3~4個月進行1次復查。
綜上所述,對于復發性肝癌,LH與RFA治療具有相似的長期療效,但RFA治療的安全性較好,對于符合RFA治療要求且耐受RFA治療的患者,可采用RFA治療以提高治療安全性,減少并發癥的發生。

