白酒糟纖維素降解菌的優選及酒糟降解工藝
陽 剛,楊第芹,曹文濤,2,王曉丹
白酒糟纖維素降解菌的優選及酒糟降解工藝
陽 剛1,楊第芹1,曹文濤1,2※,王曉丹1
(1. 貴州大學釀酒與食品工程學院,貴陽 550025;2. 貴州省發酵工程與生物制藥重點實驗室,貴陽 550025)
白酒釀造行業產生的酒糟含有大量纖維素,不僅原料利用率低,而且丟棄的酒糟會對環境產生污染。為了獲得酒糟纖維素降解能力強的微生物并進行應用,從醬香型酒醅、清香型酒醅、濃香型大曲、竹林里的土壤腐殖質中分離篩選酒糟纖維素降解菌,并對菌種分類、理化特征和降解酒糟的特性進行研究。pH值、溫度和酒精脅迫性試驗進一步確定了最佳酒糟纖維素降解菌為B2菌株,該菌株在pH值3.0、溫度44 ℃、酒精含量為體積分數4%環境中生長良好。基于形態學、生理生化和分子生物學分析,鑒定B2菌株為枯草芽孢桿菌()。在單因素試驗結果的基礎上,采用Box-Benhnken響應面法進行優化,確定了B2菌株降解酒糟的最佳工藝條件為酒糟添加量71 g/L、溫度37 ℃、pH值6.4、接種量8%,此時酒糟降解率為15.23%。該研究豐富了酒糟纖維素降解菌的微生物資源庫,同時為酒糟的資源化利用提供技術參考。
纖維素;降解;廢棄物;白酒糟;纖維素酶;枯草芽孢桿菌;篩選;酒糟處理
0 引 言
白酒糟是糧谷物和糠殼等混合物經固態發酵、蒸餾制得白酒后的副產物,并富含纖維素、蛋白質等有機物[1]。中國每年能產生3 000萬t左右的白酒糟[2-4],由于缺乏有效的處理方法,不僅造成了酒糟浪費,而且丟棄的酒糟會對環境產生污染[5-6]。目前,對白酒糟進行資源化利用的主要方式是動物飼料原料,但是對酒糟進行脫毒等處理會使成本增加,也沒有直接證據表明酒糟飼料具有良好品質。此外中國白酒釀造基地分布廣,也有很多是小作坊,對酒糟實現集中收集和處理尚存在難度。因此,開發酒糟處理方式,實現酒糟就地處理,提高經濟和環境效益,顯得十分重要。
白酒糟的纖維素含量占白酒糟干質量的20%左右[1,7],酒糟中纖維素的降解成為了酒糟資源化利用的關鍵一步。纖維素是多個葡萄糖分子通過-1,4-糖苷鍵連接而成的一種多糖,廣泛存在植物中[8-9]。而纖維素酶是一種包括內切葡聚糖酶(Endoglucanase)、外切葡聚糖酶(Exoglucanase)、-葡萄糖苷酶(-glucosidase)的復合酶,它可以將纖維素水解成葡萄糖供酵母菌等微生物利用。實際上微生物纖維素酶在造紙、紡織、生物燃料、食品與飼料工業、農業等行業都有潛在的應用前景[10]。然而,長期以來,缺乏纖維素酶高產菌株是纖維素酶大規模工業化生產和應用的瓶頸[11]。
目前,各國研究者已經從溫泉[12]、牛糞[13]、土壤[14]、腐爛木材[15]等篩選產纖維素酶菌,結果表明產纖維素酶菌有細菌中的芽孢桿菌、熱桿菌、熱酸菌、纖維弧菌等,真菌中的木霉、黑曲霉、青霉等,放線菌中的小單孢菌、鏈霉菌等,古菌中的嗜熱菌等[10,16]。有學者從酒醅[17-18]、大曲[19]、白酒糟[20]中篩選產纖維素酶菌,但纖維素酶活不高。考慮到酒醅和大曲中的微生物,尤其是醬香型白酒中的,是經過了高溫、高酸、高濃度酒精等因素脅迫,從中篩選到優良菌株具有潛力,然而醬香型白酒作為重要的產纖維素酶菌生物資源庫,卻沒有相關研究報道。關于微生物降解白酒糟的研究,其中蘭小艷等[21]利用白腐菌使酒糟中的纖維素降解率達到了9.5%,從而提高酒糟的利用價值;何頌捷等[22]從酒醅和泥窖中篩選到一株羧甲基纖維素鈉酶活為49.31 U/mL的貝萊斯芽孢桿菌,經固態發酵酒糟的降解率為22.1%,雖然指出該菌株存在潛在應用價值,但是并沒有報道該菌株對環境的耐受性以及溫度、pH值等因素對降解酒糟的影響,尚不足指導菌株的實際應用。總體來看,目前研究集中在產纖維素酶菌篩選、鑒定與特性研究,對所篩選菌進行白酒糟降解應用研究較少,尚未有白酒糟降解工藝研究報道。
本研究結合剛果紅染色與酶活力復篩試驗,從酒醅、大曲和土壤中分離篩選產纖維素酶菌,結合菌株鑒定結果和脅迫性試驗,最終確定酒糟降解微生物。在單因素試驗基礎上,采用響應面法評價了酒糟降解處理條件,旨在獲得優良菌株,為酒糟的無害化處理和資源化利用提供技術參考。
1 材料與方法
1.1 樣品來源
醬香型酒醅、清香型酒醅、濃香型大曲分別于2019年3月從貴州省某酒廠、重慶某酒廠、四川某酒廠采集,土壤采集于貴陽市十里河灘風景區的小竹林。
1.2 培養基
1)富集培養基:CMC-Na 10.0 g,蛋白胨1.0 g,NaCl 5.0 g,CaCl20.1 g,KH2PO41.0 g,(NH4)2SO42.0 g,MgSO4?7H2O 0.5 g,蒸餾水1 000 mL,pH值 6.8。
2)分離培養基:CMC-Na 10.0 g,NaCl 5.0 g,CaCl20.1 g,KH2PO41.0 g,(NH4)2SO42.0 g,MgSO4?7H2O 0.5 g,瓊脂20.0 g,蒸餾水1 000 mL,pH值6.8。
3)純化培養基:CMC-Na 10.0 g,NaCl 5.0 g,CaCl20.1 g,KH2PO41.0 g,(NH4)2SO42.0 g,MgSO4?7H2O 0.5 g,蛋白胨3.0 g,酵母浸粉3.0 g,瓊脂20.0 g,蒸餾水1 000 mL,pH值6.8。
4)液體生長培養基:純化培養基不添加瓊脂。
5)濾紙條液體培養基:(NH4)2SO41.0 g,MgSO4?7H2O 0.5 g,KH2PO41.0 g,酵母膏0.1 g,蒸餾水1 000 mL,另外在培養基中加入濾紙條(1 cm × 6 cm),每個三角瓶放3條。
6)產酶培養基:CMC-Na10.0 g,蛋白胨3.0 g,酵母膏0.2 g,(NH4)2SO44.0 g,KH2PO44.0 g,MgSO4?7H2O 0.3 g,蒸餾水1 000 mL,pH值 6.8。
7)酒糟降解培養基:將產酶培養基的CMC-Na換為酒糟。
以上培養基均采用濕熱滅菌方式,121 ℃,20 min。
1.3 主要試劑與儀器
羧甲基纖維素鈉(CMC-Na)、微晶纖維素、水楊苷、剛果紅均來自上海源葉生物公司;DNA提取試劑盒、瓊脂糖及引物,北京擎科生物技術公司;UV754N分光光度計,上海儀電公司;離心機,上海菲恰爾公司;恒溫水浴鍋,鞏義予華儀器公司;PCR儀,美國ABI公司;電泳儀,北京六一儀器廠;凝膠成像儀,上海培清科技公司。
1.4 方法
1.4.1 分離與純化
1)樣品預處理
分別稱取10.0 g樣品于裝有玻璃珠的100.0 mL無菌水中,搖床振蕩(150 r/min)30 min以獲得菌懸液。
2)富集培養
取5.0 mL菌懸液的上清液于盛有95.0 mL富集培養基的三角瓶中,搖床(28 ℃、150 r/min)培養48 h以獲得富集培養液。
3)稀釋涂布
用無菌水進行10倍梯度稀釋富集液,分別取100L的10-3~10-7稀釋度的菌液涂布于分離培養基上,每個濃度重復3次,28 ℃培養5 d。
4)純化與保藏
從涂布平板上挑取單個菌落在純化培養基上進行平板劃線,并把純化好的菌株置于4 ℃冰箱進行斜面保藏。
1.4.2 定性初篩
1)水解圈試驗(剛果紅染色試驗)
將純化過的菌株點種在CMC-Na分離培養基上,28 ℃培養5 d。菌株培養結束后,將8~10 mL的1 g/L的剛果紅溶液從培養皿邊緣緩慢倒入,輕輕搖動以使剛果紅溶液覆蓋整個平板,靜置30 min后,倒掉培養皿中液體,用4~5 mL的1 mol/L的NaCl溶液潤洗平板一次,然后向培養皿加入8~10 mL的1 mol/L的NaCl溶液,靜置“脫色”30 min后倒掉培養皿中的液體,觀察并測量菌落和水解圈的直徑。
2)濾紙條崩解試驗
將菌株接種到盛有10 mL液體生長培養基的試管中,28 ℃培養1 d以獲得種子液,再分別將5 mL種子液接種于裝有95 mL濾紙條液體培養基中,搖床(28 ℃、150 r/min)培養2 d,第3 天將培養基轉移至28 ℃培養箱培養,然后每天定期觀察并記錄濾紙條降解情況。
1.4.3 酶活力復篩
1)粗酶制備
將菌株接種到液體產酶培養基中,在28 ℃、150 r/min的搖床中培養3 d后,取發酵液進行離心處理(8 000 r/min、10 min),所得上清液為粗酶液。
2)酶活力單位定義
1個酶活力單位(1U)是在50 ℃、pH值 4.8的條件下,底物每分鐘被分解產生1mol葡萄糖所對應的酶量[23]。
3)酶活測定與計算
分別以羧甲基纖維素鈉、微晶纖維素、水楊苷作為內切葡聚糖酶、外切葡聚糖酶、-葡萄糖苷酶的分解底物,還原糖作為檢測指標,并采用DNS法[24]測定。酶活計算如式(1)所示:
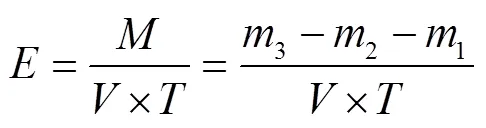
式中為酶活力,U/mL;為粗酶體積,mL;為酶解時間,min;為酶實際水解生成的還原糖量,mol;123分別為初始底物溶液中還原糖量、初始粗酶液中還原糖量、酶解后總體系還原糖量,mol。
1.4.4 酒糟降解及降解率測定
同1.4.2節中制備種子液,將種子液以5%接種量接種到酒糟降解培養基中作為試驗組,對照組不接種,均設置3個平行,先于28 ℃、150 r/min的搖床中培養2 d,后于28 ℃靜置培養8 d。參照文獻[25-26]將發酵瓶中的樣品用蒸餾水全部洗滌出來,再做抽濾處理,最后將酒糟置于烘箱烘干至恒質量。酒糟降解率的計算如式(2)所示:

1.4.5 形態學與生理生化鑒定
參考《常見細菌系統鑒定手冊》[27]和《伯杰細菌鑒定手冊》[28]對菌株進行形態學和生理生化鑒定。
1.4.6 分子生物學鑒定
根據細菌基因提取試劑盒方法提取菌株的DNA;細菌擴增引物(27F:5'-AGTTTGATCMTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3');PCR擴增條件:98 ℃預變性5 min,98 ℃變性10 s,55 ℃退火15 s,72 ℃延伸20 s,30個循環,72 ℃再延伸5 min。PCR擴增產物于4 ℃保存,并當天送至成都擎科梓熙生物技術有限公司測序。測定的基因序列在GenBank中進行BLAST相似性比對,采用MEGA5.05中的鄰接法構建系統發育樹,確定菌株的系統發育學地位,并將序列提交至GenBank,獲得GenBank accession number(基因庫登入號)。
1.4.7 pH、溫度及酒精脅迫性試驗
pH脅迫性試驗:將菌濃度為1×102~2×102CFU/mL的菌懸液涂布于pH值不同的純化培養基平板上,28 ℃培養3 d,然后觀察菌的生長情況,以pH值6.8的平板為對照,給出生長良好、生長一般、生長弱或不生長3個評價等級,每個梯度設置3個平行,下同。溫度脅迫性試驗:將菌懸液涂布于純化培養基(pH值6.8)平板上,于不同溫度下培養3 d,以28 ℃的平板為對照。酒精脅迫性試驗:將菌懸液涂布于乙醇終濃度不同的純化培養基(pH值6.8)平板上,28 ℃培養3 d,以不添加乙醇的平板為對照;其中乙醇添加到平板中的方式是待培養基冷卻至50 ℃左右,后用過濾除菌方式把乙醇添加到培養基中。
1.4.8 酒糟降解單因素試驗
根據酒糟添加量、培養溫度、pH值、接種量先后順序進行試驗,靜置培養10 d,酒糟降解率為檢測指標。經過預試驗,初始條件設為:28 ℃,pH值 6,接種量為1%;進行酒糟添加量單因素試驗時,在初始條件基礎上,酒糟添加量設為因變量(20、40、60、80、100、120 g/L);進行溫度單因素試驗時,在酒糟添加量單因素試驗基礎上(取最佳酒糟添加量),溫度設為因變量(23、28、31、34、37、40、43 ℃),以此類推,再分別考查pH值(4、4.5、5、6、7、8)和接種量(1%、2%、4%、6%、10%、15%)對酒糟降解率的影響。
1.4.9 酒糟降解響應面優化
利用Design -Expert 11軟件進行響應面法(RSM)中的Box-Benhnken試驗設計,以酒糟降解率為響應值,并利用該軟件對數據進行擬合和方差分析,并得到多元回歸方程模型;最后利用該軟件對方程模型進行求解,以確定最佳條件,預測最佳響應值,根據實際試驗結果對模型進行驗證,以檢查模型準確性。
1.5 試驗設計與數據處理
用R語言的ggplot2包(3.2.1版本)繪圖;基于R語言的agricolae包(1.3-2版本)中的LSD.test函數進行統計分析(方差分析、多重比較),采用Bonferroni校正的LSD法進行顯著性檢驗;Design-Expert 11軟件(Statease, Inc., Minneapolis, MS,USA)用于響應面試驗設計(Box–Behnken Design);Adobe illustrator CC 2014軟件用于矢量圖形處理。
2 結果與分析
2.1 菌株分離與篩選
2.1.1 分離與定性初篩
從醬香型酒醅、清香型酒醅、濃香型高溫大曲、竹林里的土壤腐殖質樣品中,共分離出39株疑似產纖維素酶的菌株,經過剛果紅染色法檢測,有19株菌能夠產生水解圈,其中A5、A9、B1、B2、C2、D12水解圈相對大且清晰(圖1a、1b)。剛果紅染色法檢測產纖維素酶菌原理是通過在培養基中添加纖維素或纖維素衍生物,若微生物能夠產生纖維素酶并能夠分解一定量底物,那么經過剛果紅染色檢測就能在菌落周圍形成透明圈(水解圈或清除區),通常可以根據透明圈直徑大小或透明圈與菌落的直徑比來揭示微生物產纖維素酶能力相對強弱。然而,也有研究發現透明圈直徑大小可能與其所產生的CMC-Na酶活力無明顯的相關性[26],僅通過剛果紅染色法選擇以上6株菌作為最佳產纖維素酶備選菌存在一定風險。由于濾紙條崩解試驗可以反映菌株所分泌各種纖維酶的綜合酶活力水平[29],因此結合濾紙崩解試驗進一步定性判斷19株菌產纖維素酶能力。濾紙崩解試驗結果如表1所示,結果表明A5、A9、B1、B2、C2、D12菌株崩解濾紙形成段數較多,與剛果紅染色結果基本一致。C2菌株來自C系列樣品(濃香型高溫大曲),其在C系列中表現最好,所以暫時保留C2菌株進行下一步研究。
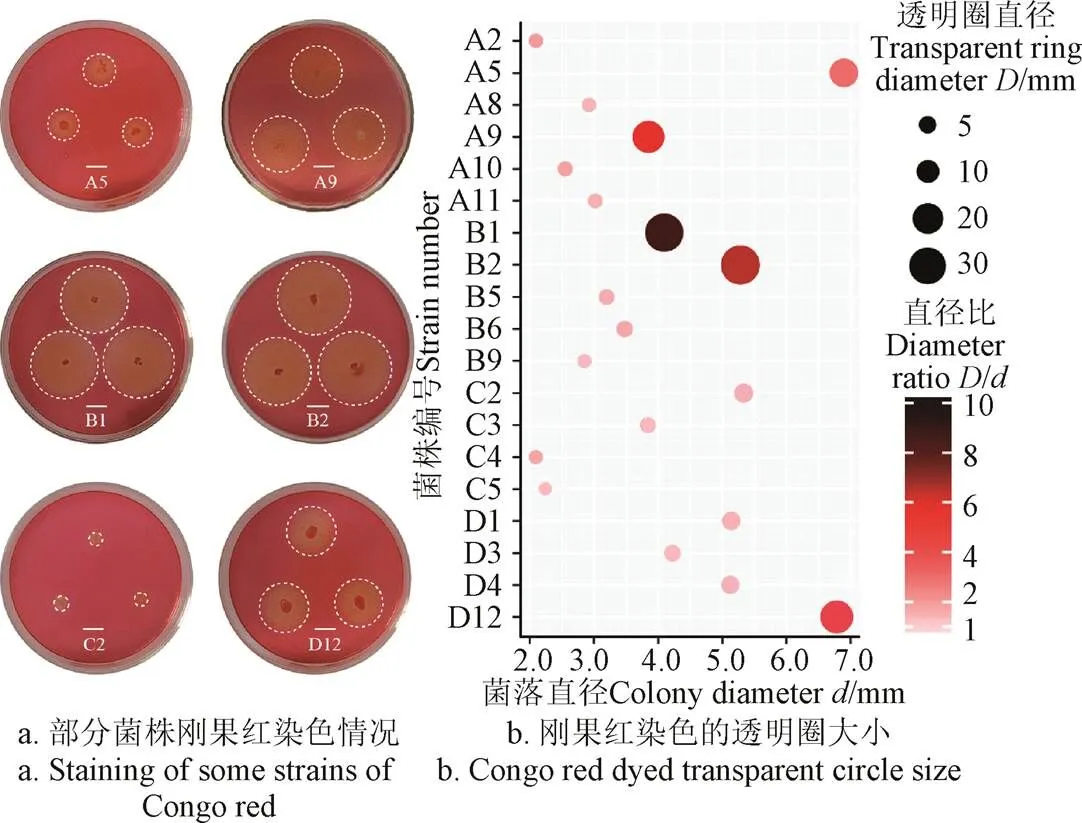
圖1 剛果紅染色定性篩選結果
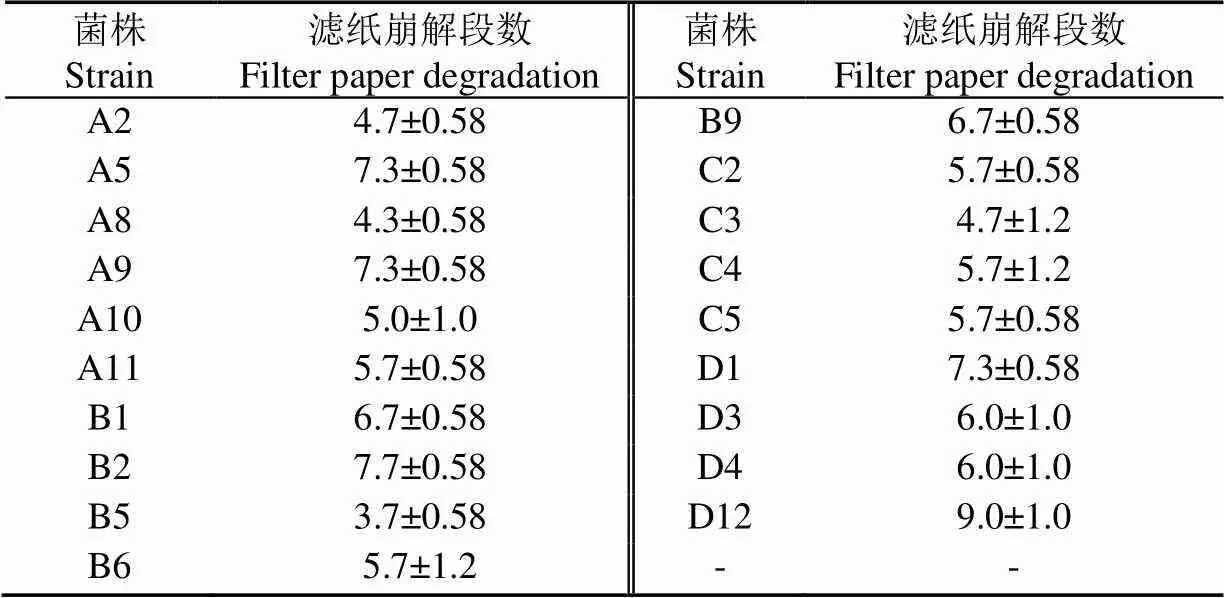
表1 菌株分解濾紙條情況
綜上因素,選擇A5、A9、B1、B2、C2、D12菌株進一步進行酶活力復篩。
2.1.2 酶活力復篩
酶活力復篩結果如表2所示,B1、B2菌株的3種纖維素酶活均顯著高于其他菌株(<0.05),而C2菌株酶活顯著低于其他菌株,這與剛果紅染色定性結果基本一致。
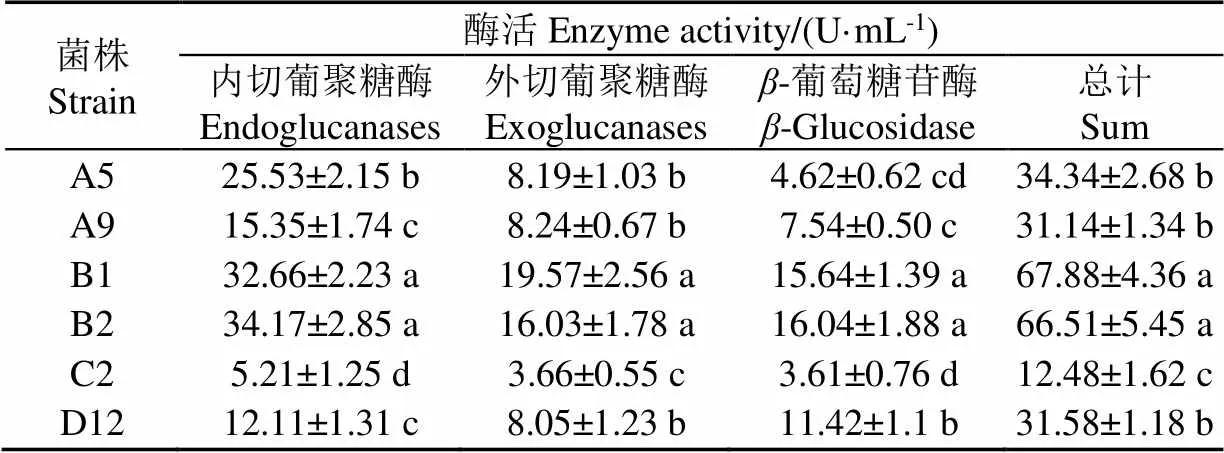
表2 復篩時6株菌纖維素酶活力值
注:同列不同小寫字母表示差異顯著(<0.05),下同。
Note: Different lowercase letters in the same column indicate significantdifferences (<0.05), and the following is the same.
2.2 菌株鑒定
2.2.1 形態學與生理生化鑒定
形態學鑒定,如圖2所示。菌株A5、C2的菌落呈圓形,質地光滑,C2菌落呈黃色;A9菌株的菌落呈放射狀,菌落表面濕潤; B1、B2菌株的菌落表面干燥帶有褶皺;D12菌株的菌落周圍形成“黑色素”,培養3 d后,明顯能聞到強烈的泥腥味。在1 000倍油鏡觀察下,A5、A9、B1、B2、C2菌株的細胞形態為桿狀,細胞長約為1~6m,細胞寬約為0.5~2m,D12菌株與一般桿狀細菌相比,細胞長度明顯偏長,細胞長約為5~15m,D12菌株與霉菌相比細胞寬度偏短。革蘭氏染色結果顯示,A5、A9、B1、B2菌株為陽性,C2、D12菌株為陰性。生理生化鑒定,如圖3所示。參考《常見細菌系統鑒定手冊》和《伯杰細菌鑒定手冊》,初步鑒定A5、A9、B1、B2為芽孢桿菌屬,C2為鞘氨醇單胞菌屬,D12為放線菌中的鏈霉菌屬。
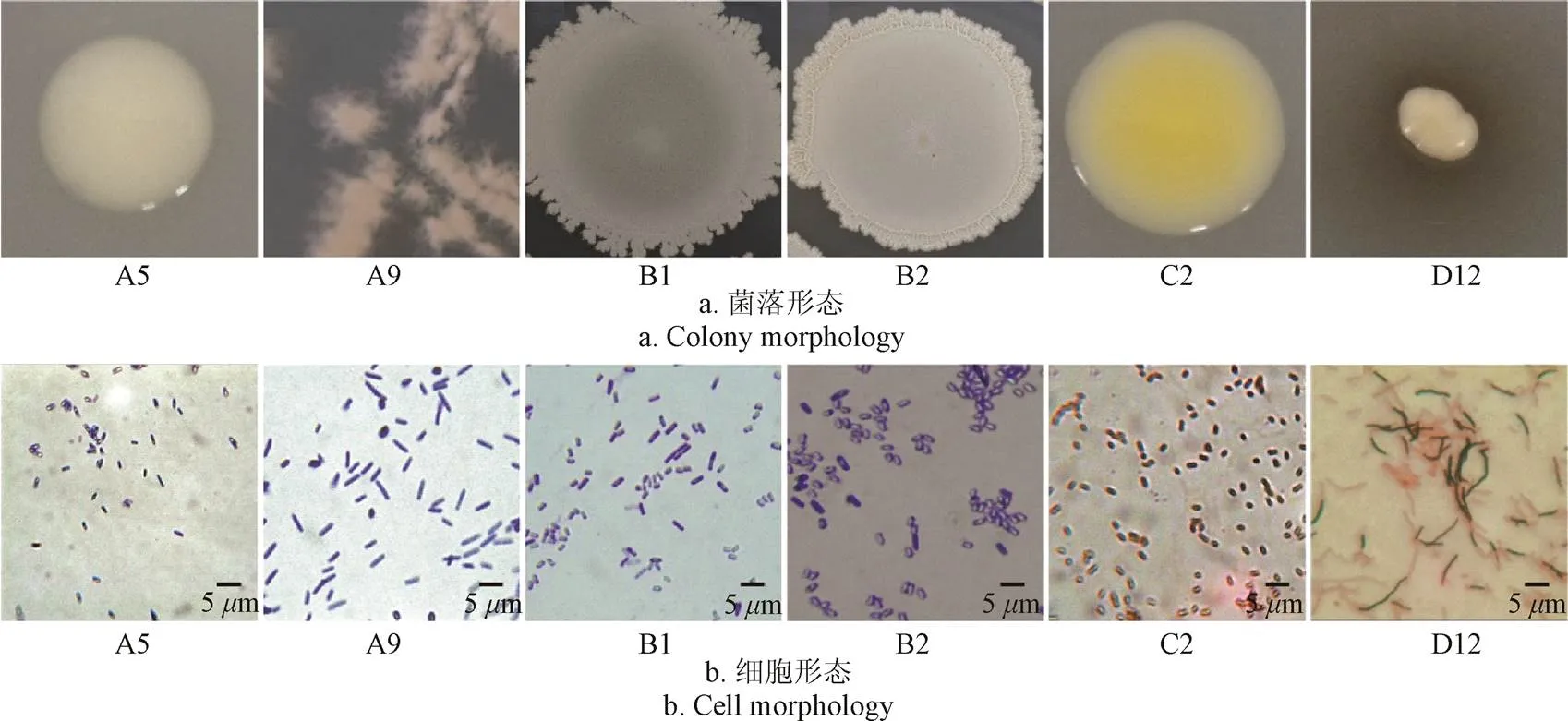
圖2 6株菌的菌落和細胞形態
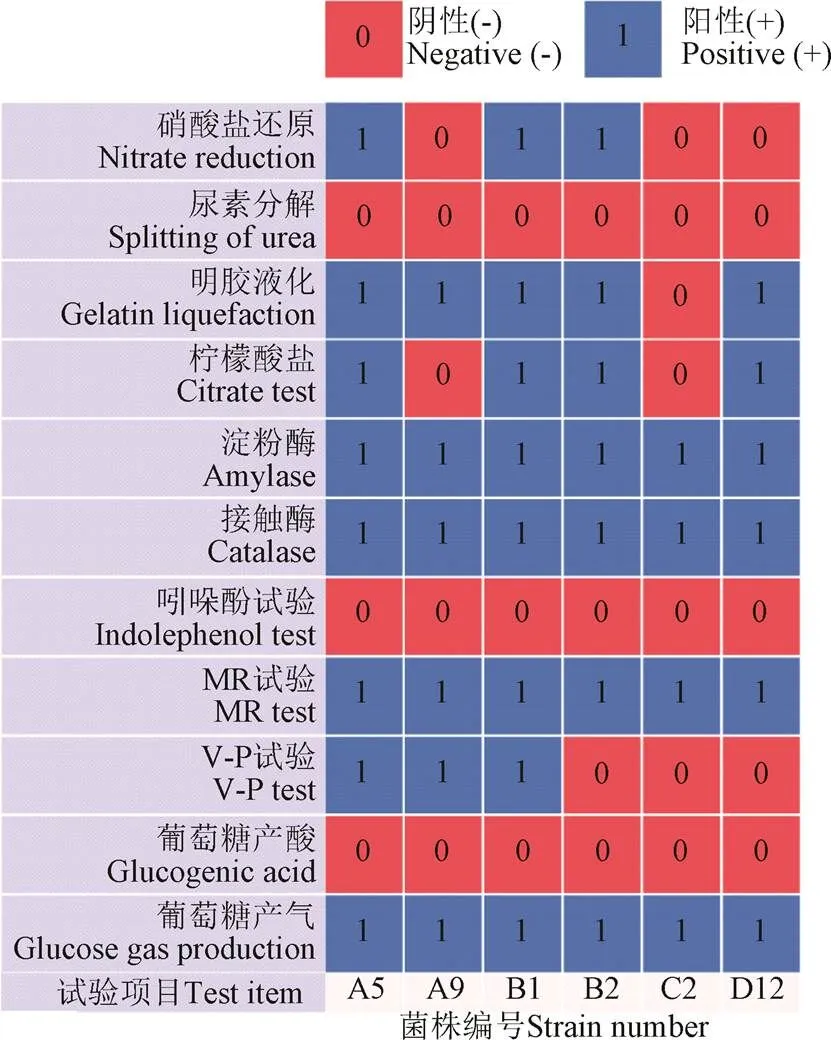
圖3 6株菌的生理生化特征
2.2.2 分子生物學鑒定
將菌株的16S rDNA序列測定結果提交至GenBank做BLAST比對(表3)。利用MEGA 5.05的鄰接法(Neighbor-Joining)構建系統發育樹,如圖4所示。
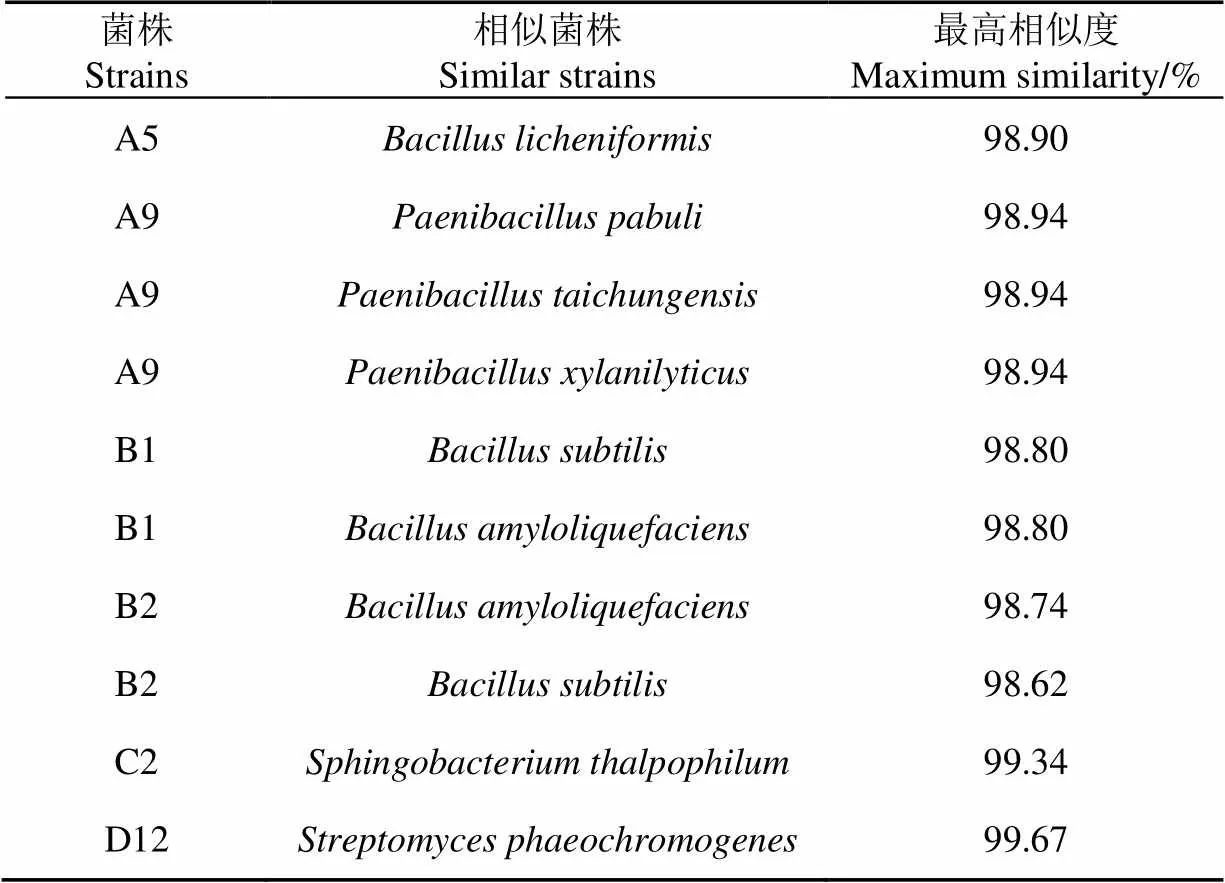
表3 菌株相似性比對結果
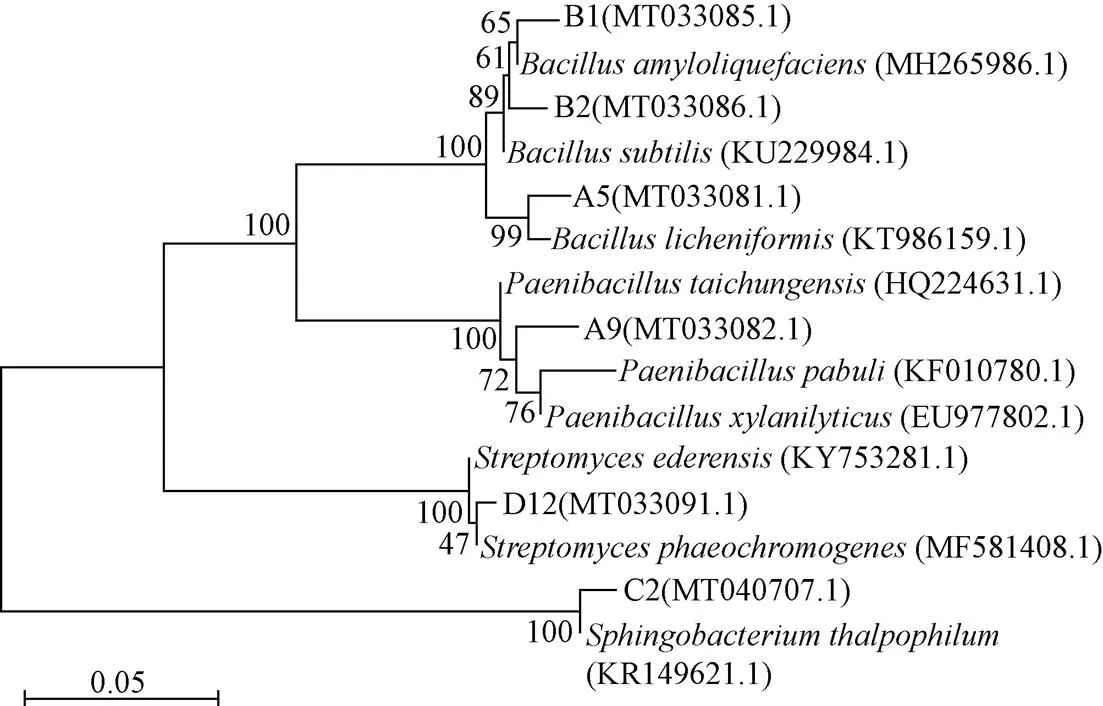
圖4 基于菌株16S rDNA序列的系統發育樹
結合形態學和生理生化鑒定,A5菌株鑒定為(地衣芽孢桿菌),A9菌株初步鑒定為(臺中類芽孢桿菌),B1菌株初步鑒定為(解淀粉類芽孢桿菌),B2菌株初步鑒定為(枯草芽孢桿菌)、C2菌株鑒定為(嗜溫鞘氨醇桿菌),D12菌株鑒定為(暗產色鏈霉菌)。根據鑒定結果,將基因序列及相關信息提交至GenBank,獲得基因庫登入號,見圖4括號中的編號。
2.3 pH、溫度及酒精脅迫性分析
為了篩選產纖維素酶能力強,且具有良好耐受性的菌株,結合篩選試驗和菌株鑒定結果,選取A9、B2、D12菌株進行脅迫性分析,結果如圖5所示。因A5、C2菌株產纖維素酶能力較差,而B1與B2菌株來自同一個樣品,故本試驗不考慮A5、B1、C2菌株。在pH脅迫性試驗中,可以發現B2菌株在pH值4.0環境中生長良好,考慮到白酒糟酸度高問題,雖然酸度與pH值并不能等同,但是對pH值具有良好耐受的菌株在酒糟中更容易生存和繁殖,這將利于微生物進行分解代謝等活動。在溫度脅迫性試驗組中,3株菌在40 ℃下生長良好,而B2菌株仍能在44 ℃下良好生長。在乙醇耐受性試驗中,3株菌在乙醇體積分數為4%的培養基中,生長已經受到限制,體積分數為2%的乙醇對B2和D12菌株的生長沒有明顯限制。綜上分析,選擇B2菌株作為酒糟降解試驗菌。
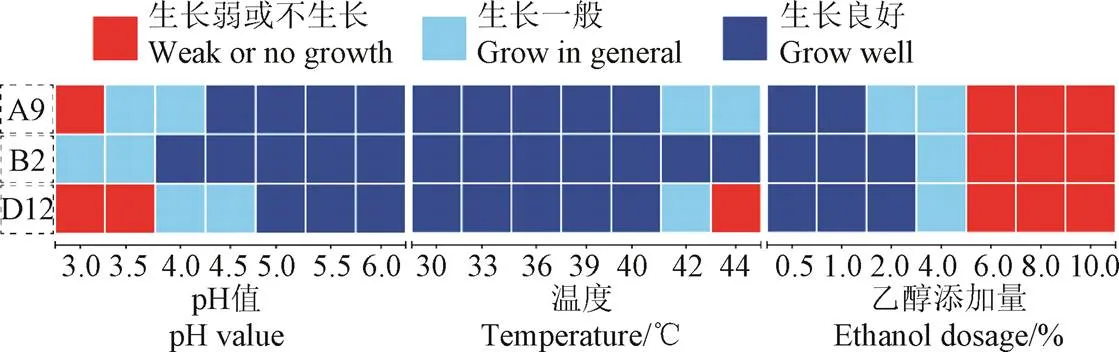
圖5 菌株對pH值、溫度、乙醇的脅迫性
2.4 單因素試驗
如圖6a所示,酒糟添加量對酒糟降解率影響顯著,酒糟添加量較少時或較高時,酒糟降解率均偏低,這可能是培養液中營養物質失衡造成的,在酒糟添加量為60 g/L時,酒糟降解率達到最大值。如圖6b所示,在28~37 ℃內,溫度對酒糟降解率的影響差異不顯著,在溫度為34 ℃時,酒糟降解率達到最大值。與Chang研究相似,Chang等在30 ℃培養條件下從土壤中篩選產纖維素酶的芽孢桿菌,結果表明在30~37 ℃內,芽孢桿菌對木質纖維素降解率差異不明顯,在37 ℃時降解率最大[30]。如圖6c所示,較低pH值或較高pH值都不利于酒糟降解,pH值為6時,酒糟降解達到最大值。如圖6d所示,接種量對酒糟降解率的影響隨接種量增加而呈現先增加后減少趨勢,但是增加和減少的幅度均較小,在接種量為6%時,酒糟降解率達到最大值。
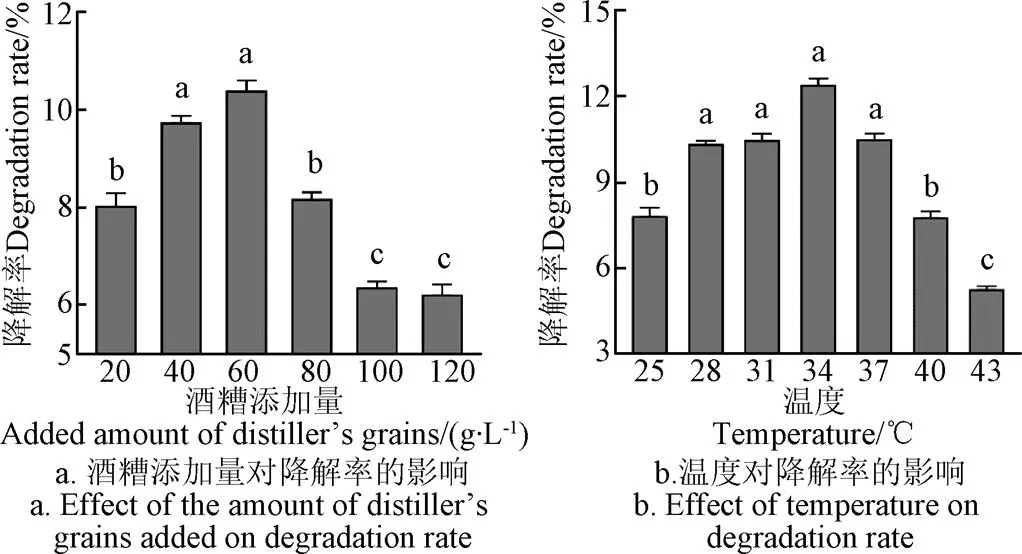
注:圖6a中,溫度28 ℃,pH值6,接種量1%;圖6b中,酒糟添加量60 g·L-1,pH值6,接種量1%;圖6c中,酒糟添加量60 g·L-1,溫度34 ℃,接種量1%;圖6d中,酒糟添加量60 g·L-1,溫度34 ℃,pH值6。
Note: In fig.6a, temperature is 28 ℃, pH value is 6, inoculation size is 1%; In fig.6b, added amount of distiller's grains is 60 g·L-1, pH value is 6, inoculation size is 1%; In fig.6c,added amount of distiller's grains is 60 g·L-1, temperature 34 ℃, inoculation size 1%; In fig.6d, added amount of distiller's grains is 60 g·L-1, temperature 34 ℃, pH value is 6.
圖6 B2菌株降解酒糟的單因素條件優化
Fig.6 Optimization of single factor conditions for lees degradation by strain B2
2.5 響應面優化
2.5.1 響應面試驗設計
根據單因素試驗結果,選擇最大響應值及鄰近的水平,或拐點及鄰近水平作為響應面分析的各因素的3個水平[31]。采用Box-Behnken設計,響應面試驗的因素與水平設計見表4。
2.5.2 響應面試驗結果
采用四因素三水平的響應面試驗設計,酒糟的的降解率作為響應值,試驗結果如表5所示。
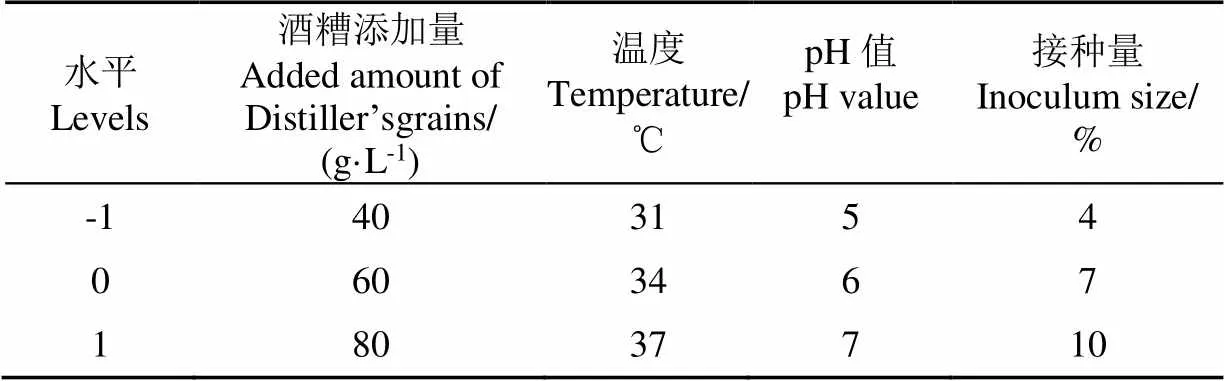
表4 響應面試驗因素與水平
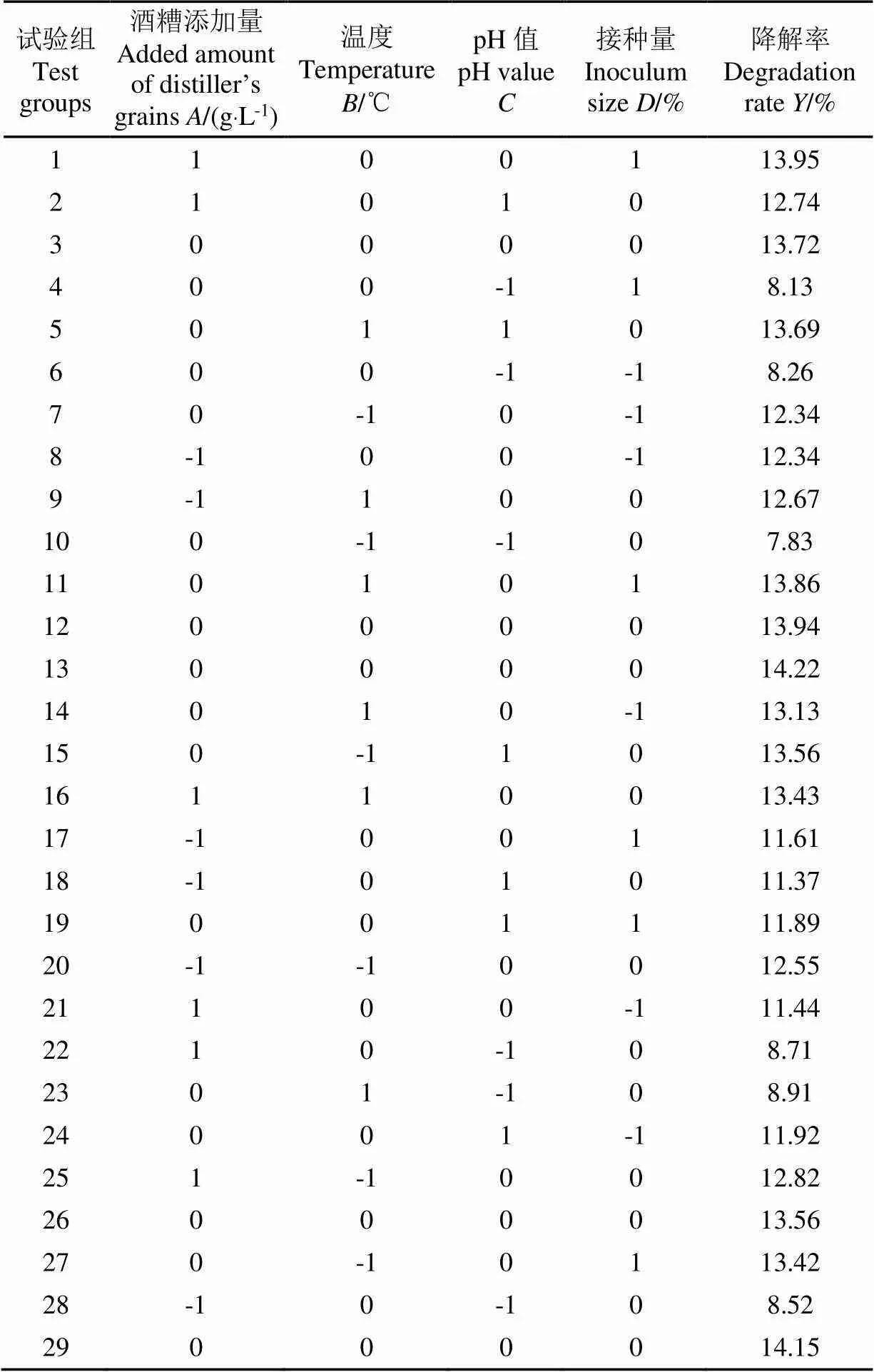
表5 Box-Behnken試驗設計及響應值
2.5.3 模型構建及分析
利用Design-Expert 11軟件對試驗結果進行二次多項式回歸方程模型構建,以編碼因子表示的方程(Coded Equation)為
=13.920 0+0.335 8+0.264 2+2.070 0+
0.285 8+0.122 5+0.295 0+0.810 0?
0.237 5?0.087 5+0.025 0?0.819 02?
0.061 52?2.900 02?0.801 52(3)
式中各項系數的絕對值表示單因素對酒糟降解率的影響程度,正負反映影響方向。模型的方差分析結果,如表6所示。
模型的值<0.001,說明該擬合模型極顯著。失擬項值為0.102 6(>0.05),表明失擬檢驗不顯著,說明該模型可用于酒糟降解的優化[32-33]。回歸模型的決定系數2=0.971 9,說明此方程對試驗擬合度結果比較好,誤差小;回歸模型的調整決定系數2Adj=0.943 8,說明該模型能解釋94.38%響應值的變化[34]。變異系數CV=4.06%,表明試驗的重復性好,試驗結果可靠[35]。綜上所述,可以采用該模型的試驗結果進行分析和預測,以及確定酒糟降解的最優參數條件。另一方面,由模型中的回歸系數顯著性檢驗可知,一次項對酒糟降解率影響顯著(<0.05),一次項對酒糟降解率影響極顯著(<0.001);交互項對酒糟降解率影響高度顯著(<0.01);二次項2、2和2對酒糟降解率影響極顯著(<0.001)。值可以反映各試驗因素對試驗指標的重要性,值越大,表明對試驗指標的影響越大[31]。比較4個因素的值大小可知,>>>,進而可知各因素對酒糟降解率的影響主次順序為: pH值、酒糟添加量、接種量、溫度,這與上文對模型方程各項系數分析結果一致。
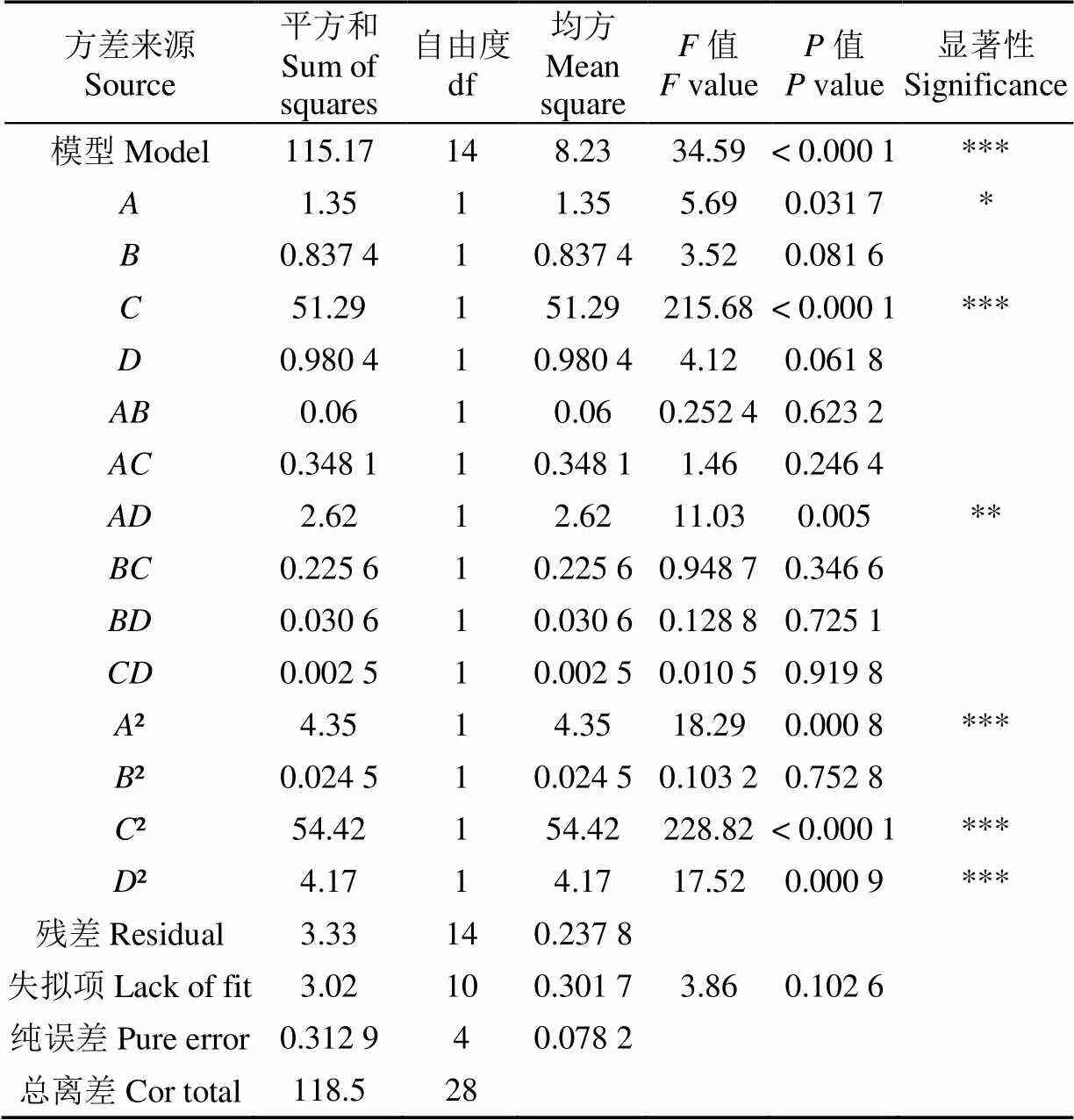
表6 響應面模型方差分析
注:* 差異顯著(<0.05);** 差異高度顯著(<0.01);*** 差異極顯著(<0.001)。2=0.971 9,2Adj=0.943 8,CV=4.06%。
Note: * significant difference,<0.05; ** highly significant difference,<0.01;*** extremely significant difference,<0.001.2=0.971 9,2Adj=0.943 8, CV=4.06%.
響應面分析3D圖(圖7),可直觀地看出各因素之間的相互作用。各3D響應曲面圖均表現出某2個因素對酒糟降解率的相對影響,其余因素均保持在0水平[32]。結合表6中交互項的顯著性分析,可知酒糟添加量與接種量的交互作用高度顯著。等高線是響應面在水平方向的投影,在圖7a或7b或7c中做酒糟添加量所在軸的平行線,以方便分析,可以發現酒糟添加量對降解率的影響是:降解率先隨酒糟添加量增加而增加,后當酒糟添加量繼續增加時,降解率反而減少,但是變化的幅度不是很大,這與單因素試驗結果大致相同。同理,分析溫度、pH值、接種量對降解率影響,結果均與單因素試驗結果基本一致。
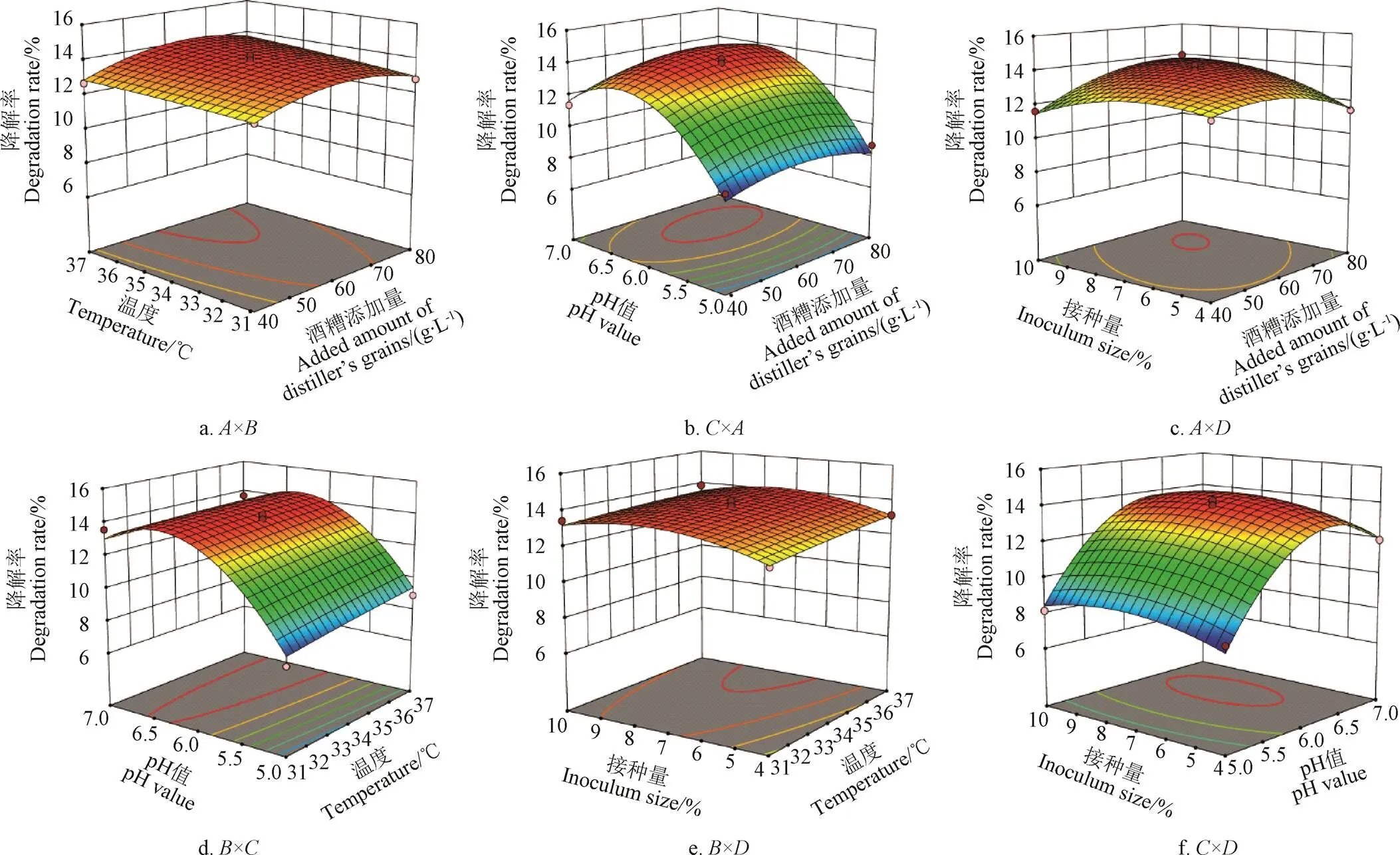
圖7 各因素交互作用對降解率影響的響應面圖
2.5.4 最佳條件確定及RSM模型驗證
利用Design-Expert 11軟件且基于單因素編碼水平為[-1,1]定義域對回歸方程求最大值,結果表明酒糟添加量為70.817 9 g/L,溫度為37.000 0 ℃,pH值為6.345 0,接種量為8.203 1%,此時酒糟降解率為14.600 4%。為驗證RSM模型可靠性,采用上述條件作為酒糟降解最佳工藝條件,考慮到實際操作的便利,將工藝條件修正為酒糟添加量71 g/L、溫度37 ℃、pH值6.4、接種量8%。以修正過的工藝條件進行驗證試驗,重復6次,實際測得的酒糟降解率平均值為15.23%,相對誤差為4.31%,表明該模型可以指導實踐。
3 討 論
目前關于白酒糟降解與利用的研究較少,很多酒糟被丟棄或是被填埋在地下,這對環境產生了一定污染[5]。雖然目前對酒糟進行處理存在成本高問題,但是在綠色發展大背景下,實現白酒糟合理處理、保護環境與節約資源卻十分必要。
由微生物生產的纖維素酶在工業中有著廣泛的應用,盡管前人已經篩選出了較多的纖維素降解菌,但能真正用于酒糟處理的菌株卻很少。明紅梅等[20]從白酒糟中篩選出一株CMC-Na酶活為13.71 U/g的地衣芽孢桿菌和一株酶活為9.25 U/g的枯草芽孢桿菌;李永博等[18]從濃香型酒醅中篩選出一株枯草芽孢桿菌,產酶條件優化后CMC-Na酶活為38.84 U/mL;何頌捷等[22]從酒醅和窖泥中篩選出1株CMC-Na酶活為49.31 U/mL的貝萊斯芽孢桿菌和一株CMC-Na酶活為31.81 U/mL解淀粉芽孢桿菌;宋麗麗等[11]從白酒糟中篩選出一株CMC-Na酶活為36.73U/mL的巨大芽孢桿菌。由于產酶條件不同,尤其是一些文獻的酶活測定方法不太合理,因此通過對比CMC-Na酶活來評價篩選出來的B2菌株產酶能力,并不太合理。纖維素水解是基于內切葡聚糖酶、外切葡聚糖酶、-葡萄糖苷酶協同作用,一些研究者僅以CMC-Na為底物來測定內切葡聚糖酶活,進而來評價菌株的產纖維素酶能力,這種做法應該值得商榷。基于單因素試驗和響應面優化結果,發現控制體系中的pH值對酒糟降解十分重要,對指導酒糟降解或處理具有較大參考意義。
真菌具有水解酶體系完善、纖維素酶分泌量大等優點[25]。木霉菌屬與曲霉菌屬作為產纖維素酶真菌的主要代表,研究得比較多。關于酒糟降解或者是從釀酒環節中的樣品篩選產纖維素酶真菌的研究相對較少。蘭小艷等[21]采用白腐菌使酒糟纖維素含量降低了9.5%,提高酒糟的利用價值。洋河酒廠將從大曲中篩選的產纖維素酶霉菌進行甲基磺酸乙酯(EMS)誘變處理,然后與糖化酶、活性干酵母混合使用,出酒率提高了3.89%[36]。細菌由于具有較高的生長速度、對基因工程具有較高的相容性和可行性等優點[8],產纖維素酶細菌也受到了重視。然而,細菌水解纖維素效率低的問題也很突出,基于纖維素降解需要眾多酶協同作用的機制,構建復合菌系降解纖維素成為了研究熱點。李靜等[26]構建由3種菌組成的復合菌系,結果較單菌株秸稈降解率提高了50.71%。王海濱等[29]構建由5種菌組成的復合菌系,結果顯著提高了濾紙酶活力和對苦參殘渣及稻稈的降解效果。日本學者Chang[30]用芽孢桿菌和乳酸菌聯合處理水稻秸稈,結果發現纖維素酶活性顯著提高,木質素和半纖維素含量相應降低。目前纖維素降解機制并不清楚,其中協同作用模型被更多學者接受。根據協同作用理論[37],纖維素的降解過程大致分為4個步驟,首先是纖維素酶分子吸附到纖維素表面,接著是內切葡聚糖酶在葡聚糖鏈的隨機位點水解底物產生寡聚糖;然后是外切葡聚糖酶從葡聚糖鏈的非還原端進行水解,形成纖維二糖主要水解產物;最后是-葡萄糖苷酶將纖維素二糖水解為葡萄糖。此外,真菌分泌的多為胞外纖維素酶,不用依附于纖維素表面后才降解纖維素[38]。一些研究表明植物中含有的木質素會對纖維素酶產生不可逆吸附,使一部分酶失活[39]。綜上所述,本文后期可以通過構建復合菌系來模擬真菌完善的酶體系和減少纖維素酶產生的不可逆吸附,為協同作用提供有利條件,進而提高酒糟的降解效果。
4 結 論
1)采用剛果紅平板篩選法,從醬香型酒醅、清香型酒醅、濃香型大曲、竹林里的土壤腐殖質中共分離出39株菌。結合菌株產生的內切葡聚糖酶、外切葡聚糖酶、-葡萄糖苷酶的酶活,復篩出6株菌。基于形態學、生理生化和分子生物學分析,6株產纖維素酶菌分別被鑒定為地衣芽孢桿菌、臺中類芽孢桿菌、解淀粉類芽孢桿菌、枯草芽孢桿菌、嗜溫鞘氨醇桿菌、暗產色鏈霉菌。pH、溫度和酒精脅迫性試驗表明枯草芽孢桿菌(B2)具有良好的耐受性,在pH值3.0、溫度44 ℃、酒精體積分數為4%環境中生長良好。
2)將枯草芽孢桿菌B2菌株應用于酒糟降解工藝研究,在單因素試驗結果的基礎上,采用Box-Benhnken響應面法進行工藝優化,確定了酒糟降解最佳工藝條件為:酒糟添加量71 g/L、溫度37 ℃、pH值 6.4、接種量8%;在此條件下,酒糟降解率為15.23%。
[1] 劉志云,鐘曉霞,姚焰礎,等. 白酒糟生物飼料及其在豬生產上的應用現狀[J]. 動物營養學報,2020,32(1):15-20.
Liu Zhiyun, Zhong Xiaoxia, Yao Yanchu, et al. Biological feed of white distiller's grains and its application status in swine production[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 15-20. (in Chinese with English abstract)
[2] 裴久文,方勇,高學志,等.. X1固態發酵改善酒糟品質[J]. 生物學雜志,2019,36(6):64-68.
Pei Jiuwen, Fang Yong, Gao Xuezhi, et al. Improvement of distiller's grains quality by. X1 under solid-state fermentation[J]. Journal of Biology, 2019, 36(6): 64-68.(in Chinese with English abstract)
[3] 高銘坤,溫廣宇,錢芳. 微生物對白酒酒糟的轉化利用研究進展[J]. 食品與機械,2018,34(2):191-194.
Gao Mingkun, Wen Guangyu, Qian Fang. Advances in microbial conversion and utilization of distiller grains[J]. Food & Machinery, 2018, 34(2): 191-194. (in Chinese with English abstract)
[4] 馬霞,董炎炎,于海燕. 酒糟浸出液發酵產細菌纖維素工藝優化[J]. 農業工程學報,2015,31(8):302-307.
Ma Xia, Dong Yanyan, Yu Haiyan. Optimization of bacterial cellulose fermentation technology with distiller's grains[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(8): 302-307. (in Chinese with English abstract)
[5] Ao T, Li R, Chen Y, et al. Anaerobic thermophilic digestion of Maotai-Flavored distiller's grains: Process performance and microbial community dynamics[J]. Energy & Fuels, 2019, 33(9): 8804-8811.
[6] 張黎驊,張文,呂珍珍,等. 響應面法優化酒糟微波間歇干燥工藝[J]. 農業工程學報,2011,27(3):369-374.
Zhang Lihua, Zhang Wen, Lu Zhenzhen, et al. Optimization of intermittent microwave drying technology for lees by response surface methodology[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(3): 369-374. (in Chinese with English abstract)
[7] 李倩,裴朝曦,王之盛,等. 不同類型酒糟營養成分組成差異的比較研究[J]. 動物營養學報,2018,30(6):2369-2376.
Li Qian, Pei Chaoxi, Wang Zhisheng, et al. Comparative study on nutrients compositions of different types of distiller's grains[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2369-2376. (in Chinese with English abstract)
[8] Akhtar N, Aanchal, Goyal D, et al. Biodiversity of cellulase producing bacteria and their applications[J]. Cellulose Chemistry and Technology, 2016, 50(9/10): 983-995.
[9] Ben Hmad I, Gargouri A. Neutral and alkaline cellulases: Production, engineering, and applications[J]. Journal of Basic Microbiology, 2017, 57(8): 653-658.
[10] Kuhad R C, Gupta R, Singh A. Microbial cellulases and their industrial applications[J]. Enzyme Research, 2011, 2011: 280696.
[11] 宋麗麗,聞格,霍姍浩,等. 白酒酒糟中產纖維素酶細菌的分離篩選和酶學性質研究[J]. 食品與發酵工業,2020,46(7):43-49.
Song Lili, Wen Ge, Huo Shanhao, et al. Screening, identification and enzymatic property of a cellulase- producing bacterium in distiller's grains[J]. Food and Fermentation Industries, 2020, 46(7): 43-49. (in Chinese with English abstract)
[12] Irfan M, Tayyab A, Hasan F, et al. Production and characterization of organic solvent-tolerant cellulase fromAK9 isolated from hot spring[J]. Applied Biochemistry and Biotechnology, 2017, 182(4): 1390-1402.
[13] Croos A M B, Rajendran S, Ranganathan K. Isolation of a cellulase producingfrom cow dung and determination of the kinetic properties of the crude enzyme[J]. Journal of the National Science Foundation of Sri Lanka, 2019, 47(2): 261-267.
[14] Reddy K V, Vijayalashmi T, Ranjit P, et al. Characterization of some efficient cellulase producing bacteria isolated from pulp and paper mill effluent contaminated soil[J]. Brazilian Archives of Biology and Technology, 2017, 60: e17160226
[15] Paudel Y P, Qin W. Characterization of novel cellulase-producing bacteria isolated from rotting wood samples[J]. Applied Biochemistry and Biotechnology, 2015, 177(5): 1186-1198.
[16] Acharya S, Chaudhary A. Bioprospecting thermophiles for cellulase production: A review[J]. Brazilian Journal of Microbiology, 2012, 43(3): 844-856.
[17] 劉茂柯,唐玉明,熊洪,等. 白酒酒醅纖維素降解菌的多樣性分析及其分離篩選[J]. 食品與發酵工業,2018,44(4):35-41.
Liu Maoke, Tang Yuming, Xiong Hong, et al. Characterization of the diversity and activity of cellulose-degrading bacteria in Zaopei used for Chinese Baijiu production [J]. Food and Fermentation Industries, 2018, 44(4): 35-41.(in Chinese with English abstract)
[18] 李永博,暴金磊,萬敏,等. 酒醅中高產纖維素酶菌株的篩選及其酶學性質[J]. 食品工業科技,2017,38(24):109-113.
Li Yongbo, Bao Jinlei, Wan Min, et al. Study on screening of high-yield cellulase strains in the fermented grains and its enzymatic properties[J]. Science and Technology of Food Industry, 2017, 38(24): 109-113. (in Chinese with English abstract)
[19] 龔麗瓊,鄧朝霞,黃祖新,等. 高溫大曲中篩選產纖維素酶的耐高溫芽孢桿菌[J]. 福建師范大學學報:自然科學版,2012,28(3):106-112.
Gong Liqiong, Deng Chaoxia, Huang Zuxin, et al. Screening of a thermostable cellulase-secreting bacillus from high temperature Daqu[J]. Journal of Fujian Normal University (Natural Science Edition), 2012, 28(3): 106-112. (in Chinese with English abstract)
[20] 明紅梅,鄒偉,陳曉旭,等. 白酒糟高溫纖維素分解菌的篩選、產酶分析與鑒定[J]. 飼料研究,2015(11):24-27.
[21] 蘭小艷,陳雪玲,張敬慧,等. 酒糟中纖維素的降解及再利用研究[J]. 畜牧與飼料科學,2018,39(4):21-22.
Lan Xiaoyan, Chen Xueling, Zhang Jinghui, et al. Investigation on degradation and reuse of cellulose in distiller's grains [J]. Animal Husbandry and Feed Science, 2018, 39(4): 21-22.(in Chinese with English abstract)
[22] 何頌捷,左勇,張鑫,等. 降解白酒酒糟中纖維素的細菌的分離鑒定[J]. 食品與發酵工業,2019,45(24):64-70.
He Songjie, Zuo Yong, Zhang Xin, et al. Isolation and identification of bacteria degrading cellulose in distillers' grains[J]. Food and Fermentation Industries, 2019, 45(24): 64-70.(in Chinese with English abstract)
[23] 鄒宗勝,王婧雅,趙運英,等. 高產纖維素酶突變株的篩選及其產酶條件優化[J]. 食品科學,2019,40(6):48-54.
Zou Zongsheng, Wang Jingya, Zhao Yunying, et al. Screening ofand optimization of fermentation conditions for higher cellulase production[J]. Food Science, 2019, 40(6): 48-54. (in Chinese with English abstract)
[24] Miller G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428.
[25] 付麗,朱紅雨,杜明楠,等. 秸稈降解菌株的篩選、鑒定及生物學特性研究[J]. 中國農業大學學報,2018,23(12):39-49.
Fu Li, Zhu Hongyu, Du Mingnan, et al. Screening, identification and biological characteristics of straw-degrading bacteria strains[J]. Journal of China Agricultural University, 2018, 23(12): 39-49.(in Chinese with English abstract)
[26] 李靜,張瀚能,趙翀,等. 高效纖維素降解菌分離篩選、復合菌系構建及秸稈降解效果分析[J]. 應用與環境生物學報, 2016,22(4):689-696.
Li Jing, Zhang Hanneng, Zhao Chong, et al. Isolation and screening of cellulose decomposing microbe and the straw decomposing effect of complex microbial system[J]. Chinese Journal of Applied and Environmental Biology, 2016, 22(4): 689-696. (in Chinese with English abstract)
[27] 蔡妙英,東秀珠. 常見細菌系統鑒定手冊[M]. 北京:科學出版社.
[28] 布坎南,吉本斯. 伯杰細菌鑒定手冊[M]. 北京:科學出版社,1984.
[29] 王海濱,韓立榮,馮俊濤,等. 高效纖維素降解菌的篩選及復合菌系的構建[J]. 農業生物技術學報,2015,23(4):421-431.
Wang Haibin, Han Lirong, Feng Juntao, et al. Screening of highly efficient cellulose degradation microbes and construction of composite strains[J]. Journal of Agricultural Biotechnology, 2015, 23(4): 421-431. (in Chinese with English abstract)
[30] Chang Y, Choi D, Takamizawa K, et al. Isolation ofstrains capable of decomposing alkali lignin and their application in combination with lactic acid bacteria for enhancing cellulase performance[J]. Bioresource Technology, 2014, 152: 429-436.
[31] 陶陶,賀凡,姬小明,等. 響應面法優化閃式提取葫蘆巴多糖及其保潤性能研究[J]. 精細化工,2016,33(6):666-673.
Tao Tao, He Fan, Ji Xiaoming, et al. Response surface methodology for optimization of flash extraction for fenugreek (.) polysaccharides and research of its humectant properties [J]. Fine Chemicals, 2016, 33(6): 666-673. (in Chinese with English abstract)
[32] Wang P, Chang J, Yin Q, et al. Effects of thermo-chemical pretreatment plus microbial fermentation and enzymatic hydrolysis on saccharification and lignocellulose degradation of corn straw[J]. Bioresource Technology, 2015, 194: 165-171.
[33] 任天寶,馬孝琴,徐桂轉,等. 響應面法優化玉米秸稈蒸汽爆破預處理條件[J]. 農業工程學報,2011,27(9):282-286.
Ren Tianbao, Ma Xiaoqin, Xu Guizhuan, et al. Optimizing steam explosion pretreatment conditions of corn stalk by response surface methodology[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(9): 282-286. (in Chinese with English abstract)
[34] 王旭輝,徐鑫,山其米克,等. 玉米秸稈厭氧消化預處理方法及工藝優化[J]. 農業工程學報,2018,34(23):246-253.
Wang Xuhui, Xu Xin, Shan Qimike, et al. Optimization of pretreatment process for corn straw anaerobic digest[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE), 2018, 34(23): 246-253. (in Chinese with English abstract)
[35] 黃皓,王珍妮,李莉,等. 甘油水溶液提取米糠多酚綠色工藝優化及多酚種類鑒定[J]. 農業工程學報,2019,35(4):305-312.
Huang Hao, Wang Zhenni, Li Li, et al. Optimization of green extraction process and identification of polyphenols variety from rice bran using glycerol/water ystem[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(4): 305-312. (in Chinese with English abstract)
[36] 楊建梅,王曉慧,王永偉,等. 大曲中高產纖維素酶菌株的選育及其在綿柔型白酒丟糟中的應用[J]. 釀酒科技,2016(8):71-75.
Yang Jianmei, Wang Xiaohui, Wang Yongwei, et al. Breeding of a strain with high yield of cellulase from Daqu and its application in waste distiller's grains of Soft-Flavor Baijiu[J]. Liquor-Making Science & Technology, 2016(8): 71-75. (in Chinese with English abstract)
[37] Jeoh T, Cardona M J, Karuna N, et al. Mechanistic kinetic models of enzymatic cellulose hydrolysis a review[J]. Biotechnology and Bioengineering, 2017, 114(7): 1369-1385.
[38] Coughlan M P. The properties of fungal and bacterial cellulases with comment on their production and application[J]. Biotechnology and Genetic Engineering Reviews, 1985, 3(1): 39-110.
[39] 曲音波. 木質纖維素降解酶與生物煉制[M]. 北京:化學工業出版社,2011.
Screening of cellulose degrading bacteria in distiller’s grains and degradation technology of distiller's grains
Yang Gang1, Yang Diqin1, Cao Wentao1,2※, Wang Xiaodan1
(1.,550025,; 2.,550025,)
Distiller’s grains serve as the important by-products in ethanol production, particularly on white spirits in China. Normally, the key grain can be processed in a solid-state fermentation, thereby to distill a mixture of grains and bran husks. After the processing, the distiller's grains can be remained readily available rich in organic matter, such as cellulose and protein. China can produce about 30 million tons of distiller's grains every year, as the consumption of white spirits increases. The discarded distiller's grains have become the waste of raw materials, further to pollute the environment, due to the lack of effective treatment methods. It is necessary to explore much more efficient disposal of distiller's grains. This study aims to explore the decomposition of distiller's grains, in order to obtain microorganisms with strong capacity of cellulose degradation in distillates. 39 strains of bacteria were isolated from in Chinese maotai-flavor fermented grains, Chinese mild-flavor fermented grains, Chinese strong-flavor Daqu starter and the soil of bamboo forest, using sodium carboxymethyl cellulose as the only carbon source. Six strains were quantitatively screened using Congo red staining and filter paper strip disintegration experiments for qualitative preliminary screening, combined with the endoglucanase, exoglucanase, and-glucosidase enzyme activities produced by the strains. Based on morphological, physiological, biochemical, and molecular biological characterization, six cellulase-producing bacteria were identified as,,, and,,. The optimum lees cellulose-degrading strain was further determined the B2 strain () inthe tests of pH, temperature, and alcohol stress. Specifically,B2 strain has demonstrated a good tolerance, while grew well in an environment of pH value 3.0, at the temperature of 44 ℃, and the alcohol content of 4% by volume. According to the single-factor test, a Box-Benhnken response surface method was used to optimize the processing parameters in the treatments. The optimal process conditions were determined to be 71 g/L distiller's grains, the temperature of 37 ℃, pH value 6.4, and the inoculation size of 8%, for the degradation of distiller's grains. In addition, the degradation rate of distiller's grains can reach 15.23% in this case. The findings demonstrated that the selectedcan effectively decompose distiller's grains, and thereby be expected to provide a promising application potential in the disposal of distiller's grains.
cellulose; degradation; wastes; distiller's grains; cellulase;; screening; vinasse processing
陽剛,楊第芹,曹文濤,等. 白酒糟纖維素降解菌的優選及酒糟降解工藝[J]. 農業工程學報,2020,36(13):212-221.doi:10.11975/j.issn.1002-6819.2020.13.025 http://www.tcsae.org
Yang Gang, Yang Diqin, Cao Wentao, et al. Screening of cellulose degrading bacteria in distiller's grains and degradation technology of distiller's grains[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(13): 212-221. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.13.025 http://www.tcsae.org
2020-03-22
2020-05-20
貴州省科技支撐計劃項目(黔科合支撐[2018]2314)
陽剛,主要從事釀酒微生物及生物建模研究。Email:GZ_university_YG@163.com
曹文濤,教授,主要從事白酒糟資源化利用及釀酒微生物應用研究。Email:452794932@qq.com
10.11975/j.issn.1002-6819.2020.13.025
Q939.96; TS261.1
A
1002-6819(2020)-13-0212-10

