氯酸鈉氧化鹽酸酸洗廢液制備聚氯化鐵
彭 健,朱 印,姚 雯,張登峰
(昆明理工大學 化學工程學院,云南 昆明 650500)
酸洗廢液是指采用強酸使鋼鐵表面性質得到改善后排出的酸性廢液[1]。鋼材在深加工過程中通常使用鹽酸對其表面進行酸洗除銹,產生的廢液稱為鹽酸酸洗廢液。鹽酸酸洗廢液對人類健康和環境均會造成危害,如何對其進行處理處置已成為一個受到廣泛關注的問題[2-5]。
酸洗廢液的處理方法早期主要為中和沉淀法,將酸洗廢液中的重金屬通過沉淀與水分離,使得廢液可以達標排放[6-8]。但此方法的缺點是將大量寶貴的金屬離子和酸液處理后又排放到環境中,即浪費了資源也未達到保護環境的目的。因此,自20世紀90年代以來,很多學者開展了對酸洗廢液的綜合利用研究,并取得了一系列的成果,主要包括生產鐵鹽循環再生[9]、制取顏料[10-11]、制備絮凝劑[12-14]等。
本工作以氯酸鈉作為氧化劑,由鹽酸酸洗廢液制備可以作為混凝劑的聚氯化鐵。考察了氧化劑加入量、濃鹽酸加入量、反應時間、反應溫度等因素對Fe2+轉化率的影響,找出最佳反應條件,并對所得聚氯化鐵產品進行了質量評價,以期為酸洗廢液的資源化利用提供有效途徑。
1 材料與方法
1.1 廢液成分
將取自云南玉溪某鋼廠的鹽酸酸洗廢液濃縮,以濃縮后的廢液(以下簡稱廢液)為實驗對象,其成分如表1所示。

表1 廢液成分 w,%
1.2 實驗原理
利用氯酸鈉的氧化性,直接將廢液中的Fe2+氧化成Fe3+,該過程的主要化學方程式見式(1)。

該反應為本實驗的主反應,FeCl2在強氧化劑NaClO3的作用下被氧化成FeCl3,該過程需要在一定的酸性環境下進行。在氧化反應開始之后,就是Fe3+的水解反應。Fe3+作為高價離子,與OH-有極強的親和力,能夠自發水解(見式(2))。

隨著溶液酸度的升高,水合Fe3+離子發生配位水分子離解,與H2O中的OH-水解形成各種可溶解的單核羥基絡合鐵離子并釋放出大量H+,而使溶液呈現極強的酸性(見式(3)和式(4))。
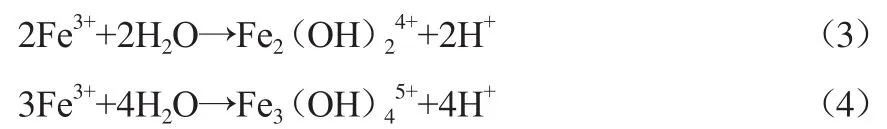
通常條件下,水解生成的鐵單體絡合形態強烈地趨向于聚合,其中最簡單的是生成二聚體,即Fe2(OH)24+。水解過程和聚合過程同時發生,水解出來的單核羥基絡合物開始聚合成多羥基絡合物,最終產物是Fe(OH)3沉淀。上面兩個副反應在中性或堿性環境(即OH-充足的溶液中)下進行時會非常迅速,如果不投加酸,其生成的Fe3+會迅速水解為Fe(OH)3沉淀,失去制備氯化鐵的條件。因此,本實驗設計者考慮加入濃鹽酸,以提供充足的H+去抑制水解和聚合的發生[15]。此外,為了滿足市場要求,使高濃度聚氯化鐵保持穩定,還需加入穩定劑,本實驗選取了含磷酸根的穩定劑磷酸二氫鉀。
1.3 實驗方法
取100 mL廢液于三頸燒瓶中,用試管夾夾住燒瓶中間頸,將其固定于恒溫水浴鍋中(溫度恒定,并保證燒瓶里的液體能夠完全被水浴浸泡);將增力電動攪拌器從中間頸伸入,調節攪拌轉速為5 r/s。加入一定量的濃鹽酸(12 mol/L),然后加入一定量的氧化劑,最后加入穩定劑磷酸二氫鉀(KH2PO4)0.3 g,塞上兩邊瓶塞后,開始反應。在反應過程中,溶液顏色由灰綠逐漸變成棕黃直至深棕紅色,當溶液變成褐色甚至開始出現沉淀或者部分溶液出現分層現象時,證明反應已趨于結束。反應結束后,測定溶液中Fe2+的質量分數,并計算其轉化率。繼續熟化24 h,得到聚合氯化鐵。
1.4 分析方法
按照文獻[9]中的分析方法測定廢液成分:Fe2+質量分數采用高錳酸鉀氧化法,總鐵質量分數采用重鉻酸鉀氧化法,Fe3+質量分數為二者之差;HCl質量分數采用酸堿滴定法,以NaF為鐵鋅等的掩蔽劑;在100 ℃恒溫干燥箱干燥后稱重,得到固體殘渣質量分數;以二甲基酚橙為指示劑,采用EDTA標準溶液滴定,得到鋅質量分數。
按照《水處理劑 聚氯化鐵》(HG/T 4672—2014)[16]中的分析方法測定所制備的聚氯化鐵的各項指標:Fe3+質量分數是以淀粉為指示劑,在酸性條件下用硫代硫酸鈉標準滴定溶液滴定;Fe2+質量分數是以二苯胺磺酸鈉為指示劑,在硫酸和磷酸介質中用重鉻酸鉀標準滴定溶液滴定;鹽基度是在試樣中加入過量鹽酸,以氟化鉀為掩蔽劑,以氫氧化鈉標準滴定溶液滴定;水不溶物質量分數是試樣用水溶解后,經過濾、洗滌、烘干至恒重后計算;密度是在20 ℃恒溫水浴中采用密度計(MH-300G型,力辰科技公司)測量。
2 結果與討論
2.1 氯酸鈉加入量對Fe2+轉化效果的影響
在濃鹽酸加入量為12 mL、反應時間為30 min、反應溫度為30 ℃的條件下,氯酸鈉加入量對Fe2+轉化效果的影響如圖1所示。由圖1可知,氯酸鈉加入量對于Fe2+的氧化效率的影響至關重要。隨著氧化劑氯酸鈉加入量的逐漸增大,Fe2+轉化率逐漸增高;其關鍵變化節點在氯酸鈉加入量為6.5 g時,Fe2+轉化率迅速增高到95.24%;氯酸鈉加入量增至7.0 g時,轉化率達98.51%,且變化趨勢已經趨于平緩,不再有明顯升高,說明反應已基本達到平衡階段;當氯酸鈉加入量為8.5 g時甚至出現了轉化率降低的趨勢,且過量的氧化劑會使生產成本增加。因此,將氯酸鈉最佳加入量設定為7.0 g,以進行后續實驗。曾小君等[17]研究發現,加入氧化劑理論化學計量的106%是合適的。本實驗的最佳氧化劑加入量略高于理論化學計量的106%,這可能是由于廢液中含有其他可被氧化的雜質。

圖1 氯酸鈉加入量對Fe2+轉化效果的影響
2.2 濃鹽酸加入量對Fe2+轉化效果的影響
在氯酸鈉加入量為7.0 g、反應時間為30 min、反應溫度為30 ℃的條件下,濃鹽酸加入量對Fe2+轉化效果的影響如圖2所示。分析圖2發現:隨著濃鹽酸加入量的增大,Fe2+的轉化率持續升高;當濃鹽酸的加入量增至8 mL時,轉化率的變化趨于穩定;當濃鹽酸加入量為8~12 mL時,Fe2+轉化率較高,在98%以上;而當濃鹽酸的加入量增至14 mL時,Fe2+轉化率出現下降趨勢。pH的降低會使聚氯化鐵黏度變大,有利于貯存和提高絮凝性能[17]。綜合考慮,選擇濃鹽酸加入量為12 mL。

圖2 濃鹽酸加入量對Fe2+轉化效果的影響
上述結果表明,濃鹽酸的加入量會對氯酸鈉的氧化性能產生重要影響。酸的加入,一方面可以促進氧化反應的正向進行,另一方面還可抑制Fe3+的水解,阻止其沉淀產生Fe(OH)3,因此轉化率迅速升高;隨著反應的進行,鹽酸加入量的增大反而導致轉化率下降,這是由于溶液中的H+過多會抑制后續的水解反應和聚合反應,使溶液中難以生成單核羥基絡合物,更無法形成聚氯化鐵。邱慧琴等[18]在利用鹽酸酸洗廢液制備聚氯化鐵時,得出料液中HCl與總Fe的質量比控制在0.45~0.55時,產品可達質量要求。本實驗的最佳鹽酸加入量與之吻合。
2.3 反應時間對Fe2+轉化效果的影響
在氯酸鈉加入量為7.0 g、濃鹽酸加入量為12 mL、反應溫度為30 ℃的條件下,反應時間對Fe2+轉化效果的影響如圖3所示。由圖3可知,Fe2+的轉化率是隨著時間變化的。反應初期,Fe2+轉化率隨著反應時間的延長而迅速升高,原因是此時溶液中的Fe2+濃度高,反應很快,因此氧化效率高;20 min后反應開始變慢,這是由于溶液中的Fe2+大部分已經轉化為Fe3+;30 min后Fe2+轉化率基本不再變化,反應趨于平衡狀態。綜上,選擇反應時間為30 min。
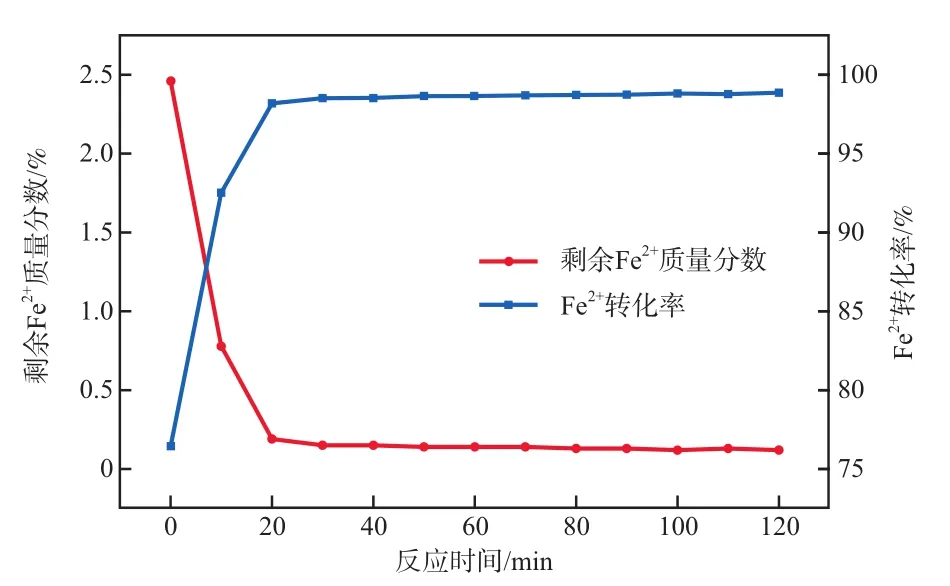
圖3 反應時間對Fe2+轉化效果的影響
2.4 反應溫度對Fe2+轉化效果的影響
在氯酸鈉加入量為7.0 g、濃鹽酸加入量為12 mL、反應時間為30 min的條件下,反應溫度對Fe2+轉化效果的影響如圖4所示。

圖4 反應溫度對Fe2+轉化效果的影響
由圖4可知,反應溫度對Fe2+的轉化率影響較小,轉化率并未呈現出與溫度相同的變化趨勢,而是在30~90 ℃間保持在一定范圍內波動。這是因為:該反應為放熱反應,開始階段升高溫度能使其達到合適的反應條件,加快反應速率;隨著溫度的升高,反應趨于平衡,產生的熱量不易釋放,且過高的溫度會使溶液中的酸揮發,導致鹽酸不足而使反應停滯;此外,溫度過高還會引起氧化劑部分分解,氧化劑有效濃度降低,不利于氧化、水解和聚合反應的進行。綜上,本實驗的最佳反應溫度控制在30 ℃即可。
2.5 產品指標
將本實驗制備的聚氯化鐵的各項指標與《水處理劑 聚氯化鐵》(HG/T 4672—2014)對比,結果如表2所示。由表2可見,制備的聚氯化鐵產品的各項指標均達到了行業標準。

表2 產品指標與行業標準指標的對比
3 結論
a)實驗結果表明,氯酸鈉對Fe2+氧化效果顯著,在酸性環境下可以快速將鹽酸酸洗廢液中的二價鐵氧化為三價鐵,Fe2+轉化率可達98.51%,得到的聚氯化鐵產品符合《水處理劑 聚氯化鐵》(HG/T 4672—2014)標準。
b)采用氯酸鈉氧化鹽酸酸洗廢液制備聚氯化鐵的最佳工藝條件為:每處理100 mL廢液需加入7.0 g氯酸鈉、12 mL濃鹽酸(12 mol/L)、0.3 g磷酸二氫鉀,反應溫度30 ℃,反應時間30 min,攪拌轉速5 r/s。
c)利用鹽酸酸洗廢液制備聚氯化鐵,為酸洗廢液的綜合利用提供了可行途徑,同時為混凝劑的應用提供了廉價原料,具備較好的經濟效益和環境效益。

