典型農田根際土壤伯克霍爾德氏菌群落結構及其多樣性*
黃瑞林,張 娜,孫 波,梁玉婷?
典型農田根際土壤伯克霍爾德氏菌群落結構及其多樣性*
黃瑞林1,張 娜2,孫 波2,梁玉婷2?
(1. 常州大學環境與安全工程學院,江蘇常州 213164;2. 土壤與農業可持續發展國家重點實驗室(中國科學院南京土壤研究所),南京 210008)
在根際環境中伯克霍爾德氏菌(Burkholderiales)是一類重要的植物促生菌,其群落結構變化可能會影響植物的生長和發育。本研究針對伯克霍爾德氏菌目,采用特異性引物16S rRNA基因高通量測序技術,研究了田間條件下黑土、潮土和紅壤中玉米根際伯克霍爾德氏菌群落結構及其對地上部作物生物量和產量的可能影響。結果表明:在三種土壤類型中,與未施肥相比,施肥對伯克霍爾德氏菌目的豐富度和多樣性均沒有顯著影響。在伯克霍爾德氏菌的科水平主要檢測到三類細菌,分別為草酸桿菌科(Oxalobacteraceae)、叢毛單胞菌科(Comamonadaceae)和伯克氏菌科(Burkholderiaceae),且草酸桿菌科是其中的優勢菌。此外,施肥顯著增加了有機質含量較低的潮土中馬賽菌(spp.和sp.WG5)和伯克氏菌(spp.)的相對豐度(0.05);增加了酸性紅壤中草螺旋菌(sp. ZM319)的相對豐度,但降低了spp.的相對豐度(0.05);而在有機質含量最高的黑土中,所有檢測到的伯克霍爾德氏菌均無明顯地變化。進一步分析表明,土壤有效磷、速效鉀含量和土壤pH是影響這幾類細菌的主要因素,而馬賽菌群落的變化可能會影響玉米地上部生物量和產量。本研究表明,盡管化學施肥是影響玉米地上部生物量和產量的主要原因,但是伯克霍爾德氏菌等根際微生物群落也可能是影響它們的潛在生物因素。
伯克霍爾德氏菌;馬賽菌屬;根際微生物;施肥;溶磷
棲息于植物根、莖或葉的伯克霍爾德氏菌目屬于變形菌門下的β-變形菌綱,是一類革蘭氏陰性菌,其生理特征主要表現為嚴格需氧、兼性厭氧和專性厭氧化能異養型,主要類群包括:伯克氏菌科、草酸桿菌科、產堿菌科(Alcaligenaceae)和叢毛單胞菌科[1-2]。其中多數是具有固氮、結瘤、溶磷和產生植物激素等功能的植物促生菌。如越南伯克霍爾德菌()和庫魯利伯克霍爾德菌()具有固定空氣中游離態氮的功能[3];瘤狀伯克霍爾德菌()除具有固氮功能外還能夠在植物的根部結瘤[4]。Castanheira等[5]通過基因組指紋圖譜和16S rRNA高通量測序發現禾谷伯克霍爾德菌()、真菌伯克霍爾德菌()和屬于洋蔥伯克氏菌群(complex)的菌株具有溶解礦物質磷、合成吲哚乙酸、生成鐵載體以及拮抗植物致病卵菌的能力。此外,一些洋蔥伯克霍爾德菌的菌株能夠棲息于谷物、玉米和水稻等作物的根際,通過提高作物養分吸收的方式增加作物產量[6-7]。可見,伯克霍爾德氏菌具有促進植物生長和發育的潛力。
大量研究表明,溫度、海拔高度、土壤pH和土壤類型是影響細菌群落的重要因素[8-10],因此它們也可能與伯克霍爾德氏菌的群落結構和組成密切相關。Stopnisek等[11]對不同生態系統、氣候條件和土壤類型中的伯克氏菌進行16S rRNA高通量測序和qPCR分析,表明年均溫度、海拔、地理位置(經緯度)和土壤類型會顯著影響伯克氏菌屬的群落組成和結構。此外,氮肥和磷肥的施加也可能會影響根際土壤中的伯克霍爾德氏菌的群落結構、組成和功能。Tilman等[12]研究表明長期施氮肥尤其是以硫酸銨作為氮肥會引起土壤酸化。在酸性環境下(3.5~7),伯克氏菌屬(屬于伯克霍爾德菌目,伯克氏菌科)有明顯的競爭優勢[11],因此氮肥施加引起的土壤酸化可能會帶來該菌豐度的增加。與長期施加磷肥的土壤相比,不施加磷肥處理顯著地增加了一類重要的溶磷菌——馬賽菌屬()(屬于伯克霍爾德菌目,草酸菌科)的豐度[13]。不僅如此,磷肥對伯克霍爾德氏菌的影響還與磷肥的種類密切相關。在玉米根際,與重過磷酸鈣(triple superphosphate)作為磷肥相比,長期以磷礦石(rock phosphate)作為磷肥能夠顯著地增加草酸桿菌科(主要是馬賽菌屬和草螺菌屬)的豐度[14]。最近,在海倫長期施磷礦石的農業土壤中,研究者分離到了一種具有溶磷能力的馬賽菌并命名為:12-OD1T[15]。目前已發表的研究大多數是關于伯克霍爾德氏菌群落變化和物種鑒定分離,對伯克霍爾德氏菌在不同類型土壤中的比較及其與作物產量的潛在關系有待于進一步研究。
本研究選擇了三種典型農田土壤(黑土、潮土和紅壤)作為供試土壤,在同一海拔高度和氣候類型的田間條件下設置了施肥(氮磷鉀)和不施肥兩種處理。通過對伯克霍爾德氏菌的引物序列[16]進行16S rRNA高通量測序,研究了玉米根際伯克霍爾德菌的群落結構和組成的變化及其對玉米地上生物量和產量可能的影響。
1 材料與方法
1.1 研究區概況
田間試驗設置于中國科學院封丘農業生態實驗站(114°24′ E,35°00′ N),位于河南省封丘縣潘店鄉,海拔 67.5 m,屬半干旱、半濕潤的暖溫帶季風氣候,年均溫為13.9℃,年降水量為605 mm,主要集中在6—9月份。年日照時數2 300~2 500 h。無霜期為220 d 左右。
1.2 研究方法
于2005年10月布置微區試驗,選擇三種長期旱地耕作的農田土壤(耕作歷史 20 年以上),分別為采自東北松嫩平原海倫的黃土母質發育而成的黑土、采自黃淮海平原封丘的黃河沖積物發育的潮土和采自南方丘陵區鷹潭的第四紀紅黏土發育的紅壤,各土壤理化性質見表1。在各地分層(20 cm每層)采集三種土壤的剖面(1.2 m 寬×1.4 m 長×1 m 深),運至封丘站后按原來的土層順序分別填裝到長1.2 m、寬1.4 m、深1 m的試驗小區,每種土壤設置2種處理,每種處理設置3個重復(3×2×3)。小區為砌磚水泥池(微區面積 1.2 m×1.4 m=1.68 m2),小區隔墻厚 20 cm,露出地表 20 cm,底部鋪石英沙,內壁覆蓋防水布。
2 種處理分別為:(1)不施肥處理(Unfertilized):每年6月初種植 1 季玉米,品種為當地品種鄭單958,不施用任何肥料,采用雨養,不灌溉,人工定期除草;(2)常規施肥處理(NPK):每年種植1季玉米,施肥量為 N 150 kg·hm–2、P2O575 kg·hm–2、K2O 60 kg·hm–2,肥料分別為尿素、(NH4)2HPO4和 KCl,種植前施加底肥(1/2 氮肥、全部磷肥和鉀肥),玉米大喇叭口期追施尿素(1/2 氮肥),其他條件與不施肥處理相同。本研究試驗樣品于2016 年玉米成熟期(9月18日)采集。
玉米根際土壤采用抖根法收集[17-18],具體操作如下:首先劇烈抖動玉米的根,去除根表面附著的大多數土壤,只保留根周圍1 mm左右的土視為根際土;其次稱取5 g含有根際土的根放入100 mL的無菌錐形瓶中,并向其中加入50 mL 0.85%的NaCl溶液(經滅菌),使用無菌鑷子小心地將根際土洗下,直至根表面無明顯土壤(重復該過程3次);最后將所有含有根際土的NaCl溶液小心轉移至滅菌過的50 mL離心管中,以9 000 r·min–1的速度離心10 min,倒去上清液后收集根際土(收集三次得到的所有根際土)。采集到的根際土分別以4℃和–20℃保存,以進行理化指標的檢測和DNA提取。需要檢測的理化指標測定方法參照文獻[19],包括土壤有機質含量、pH和營養物質含量(全氮、全磷、全鉀、有效磷、速效鉀和堿解氮)。
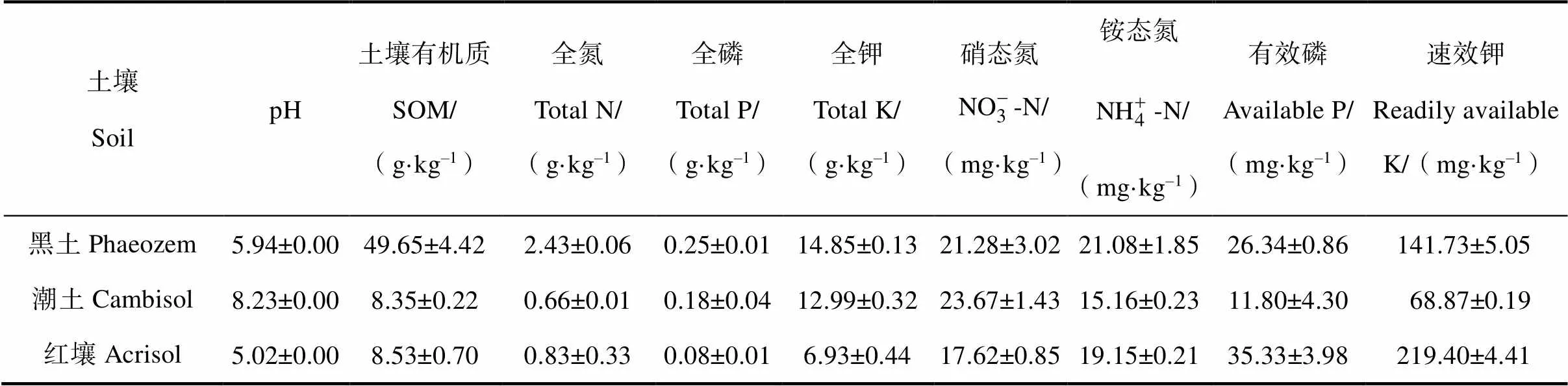
表1 供試土壤基本理化性質(2005年)
1.3 DNA提取和高通量測序
準確稱量1 g玉米根際土壤于無菌研缽中并加入0.5 g無菌石英砂,液氮研磨;使用Power Soil DNA isolation kit提取土壤總DNA。提取后使用超微量分光光度計(Nanodrop 2000,Thermo Fisher Scientific,Wilmington,DE,U.S.A)上機檢測各樣品DNA的質量和濃度,濃度≥20 ng·μL–1,OD260/280= 1.8~2.0的樣品為合格樣品,合格樣品在–80℃條件下保存。
利用Illumina測序平臺,對18個根際土壤樣本的DNA做伯克霍爾德氏菌進行高通量測序,以標準的細菌基因組DNA Mix作為陽性對照,根據選定的檢測區域確定相對應的擴增引物,對各樣本的檢測區域做高保真PCR擴增。伯克霍爾德氏菌的16S rRNA(V4-V5區)擴增引物序列為[16]:Primer F = Illumina adapter sequence 1 + TTTTGGACAATGG GGGCAAC,Primer R = Illumina adapter sequence 2 + CTTCGTTACCAAGTCAATGAAGA。研究表明該引物所得序列有99%屬于伯克霍爾德氏菌[16],且使用該引物在BLAST數據庫對比確定其屬于特異性引物。該細菌的16S rRNA(V4-V5區)區域擴增的PCR條件為:預變性步驟設置95℃、2 min;變性步驟設置94℃、20 s,退火步驟設置55℃、40 s,延伸步驟設置72℃、1 min,重復循環變性-退火-延伸三個步驟35次;末延伸步驟設置72℃、2 min。利用帶有Index序列的引物,通過高保真PCR將特定的標簽序列導入文庫末端。樣本添加特異性標簽序列的PCR條件為:預變性步驟設置98℃、30 s;變性步驟設置98℃、10 s,退火步驟設置65℃、30 s,延伸步驟設置72℃、30 s,重復循環變性-退火-延伸三個步驟11次;末延伸步驟設置72℃、5 min。之后應用核酸純化磁珠純化擴增產物,得到樣本的原始文庫。利用Qubit熒光定量儀對文庫精確定量,按相應比例(摩爾比)混合樣本。通過Agilent 2100 Bioanalyzer生物分析儀檢測混合樣本的文庫插入片段的大小,確認在210~252 bp之間無非特異性擴增,并準確定量測序文庫濃度。采用Miseq系列測序儀2×250 bp的雙端測序策略對文庫做測序。原始下機數據經過質量控制和過濾后,利用UPARSE軟件對其做OTU(Operational Taxonomic Unit)聚類分析,分類依據參照RDP(Ribosomal Database Project)數據庫的RDP Release 11.5版本。細菌測序中每個樣本獲得的序列數范圍為40 607~65 060 reads,為了盡量減少樣本中讀取計數變化的影響,本研究基于樣本序列最低數量(40 607 reads)對其做抽平處理,按照97%的相似性對所有序列做OTU劃分,各樣品文庫的覆蓋率均達到98%以上。
1.4 數據分析
本研究計算了同一土壤類型下施肥和不施肥對根際土壤中物種相對豐度的影響,且使用熱圖(heatmap)對數據進行了可視化,使用了皮爾森(Pearson)相關分析,以檢驗不同理化性質與物種相對豐度之間的相關性。同時利用典范對應分析(CCA)以研究不同理化指標對施肥情況下相對豐度顯著變化的伯克霍爾德氏菌群落結構和分布的影響。利用R語言中的lm函數對物種相對豐度變化與玉米地上生物量和產量進行了線性擬合。所有這些分析都是在R語言(R 3.5.1)中進行的(https://www.r-project.org/)。所涉及的R包分別為pheatmap、corrplot和vegan[20]。
為了評估土壤理化性質,伯克霍爾德氏菌的相對豐度與玉米地上生物量和產量之間的直接和間接聯系,本研究構建了結構方程模型[21](structural equation modeling,SEM)。構建過程主要分為以下三個步驟:首先基于已經掌握的知識和過去已發表過的文獻,判斷預測因子之間可能存在的相關性并預設模型;其次檢驗數據是否符合正態分布,對不符合正態分布的數據進行對數轉換,加載數據后檢查模型的整體適應性,本研究使用了2檢測(當>0.05時模型適應良好)、擬合優度指標(GFI,當GFI>0.9時模型適應良好)和近似均方根誤差[22](RMSEA,當RMSEA<0.05且>0.05時模型適應良好)來判斷模型的適應性,對于某些即使對數轉換后也難以符合正態分布的變量本研究使用了Bollen-Stine bootstrap檢測(當bootstrap>0.05時模型適應良好);最后通過合理的模型擬合,本研究解釋了模型的路徑系數以及其對應的顯著性值,并且本研究還計算了標準總體影響(standardized total effects,對兩個變量之間的直接和間接影響求和)。所有的結構方程分析在IBM? SPSS? Amos 20.0(AMOS IBM USA)中完成。
2 結 果
2.1 不同土壤類型下施肥對土壤理化性質、玉米地上部生物量和產量的影響
在本研究中,施肥會顯著增加三種土壤類型中的全磷、有效磷含量和玉米地上部生物量(0.05);而對土壤水分含量、pH、土壤有機質和玉米產量的改變會受到土壤類型的影響(表2)。例如,施肥會提高黑土的水分含量,提高黑土和潮土中的土壤有機質,而對紅壤中的水分含量和土壤有機質含量并無顯著的影響。此外,同種土壤與移置前相比,移置后其產量均有顯著的提高(<0.001)。
2.2 施肥對伯克霍爾德氏菌群落的影響
基于對伯克霍爾德氏菌的16s rRNA測序分析表明,相比黑土和潮土,紅壤中伯克霍爾德氏菌的豐富度和多樣性較低;在同種土壤類型中,與未施肥土壤相比,施肥并未顯著地影響伯克霍爾德氏菌的豐富度和多樣性(圖1a)。本研究主要檢測到三類主要的伯克霍爾德氏菌,分別為草酸桿菌科、叢毛單胞菌科和伯克氏菌科(圖1b),其中草酸桿菌均是優勢菌。伯克氏菌科在潮土中豐度最低。進一步分析表明,施肥對種水平伯克霍爾德氏菌相對豐度的影響可能與土壤類型有關(圖1c)。例如,在潮土中施肥顯著地增加了spp.(屬于伯克氏菌屬)、spp.(屬于馬賽菌屬)和sp. WG5(屬于馬賽菌屬)的相對豐度;在紅壤中施肥處理顯著增加了sp. ZM319的相對豐度(屬于草螺旋菌屬),顯著降低了spp.的相對豐度(0.05);而在黑土中施肥對所有檢測到的伯克霍爾德氏菌的相對豐度均無顯著影響。
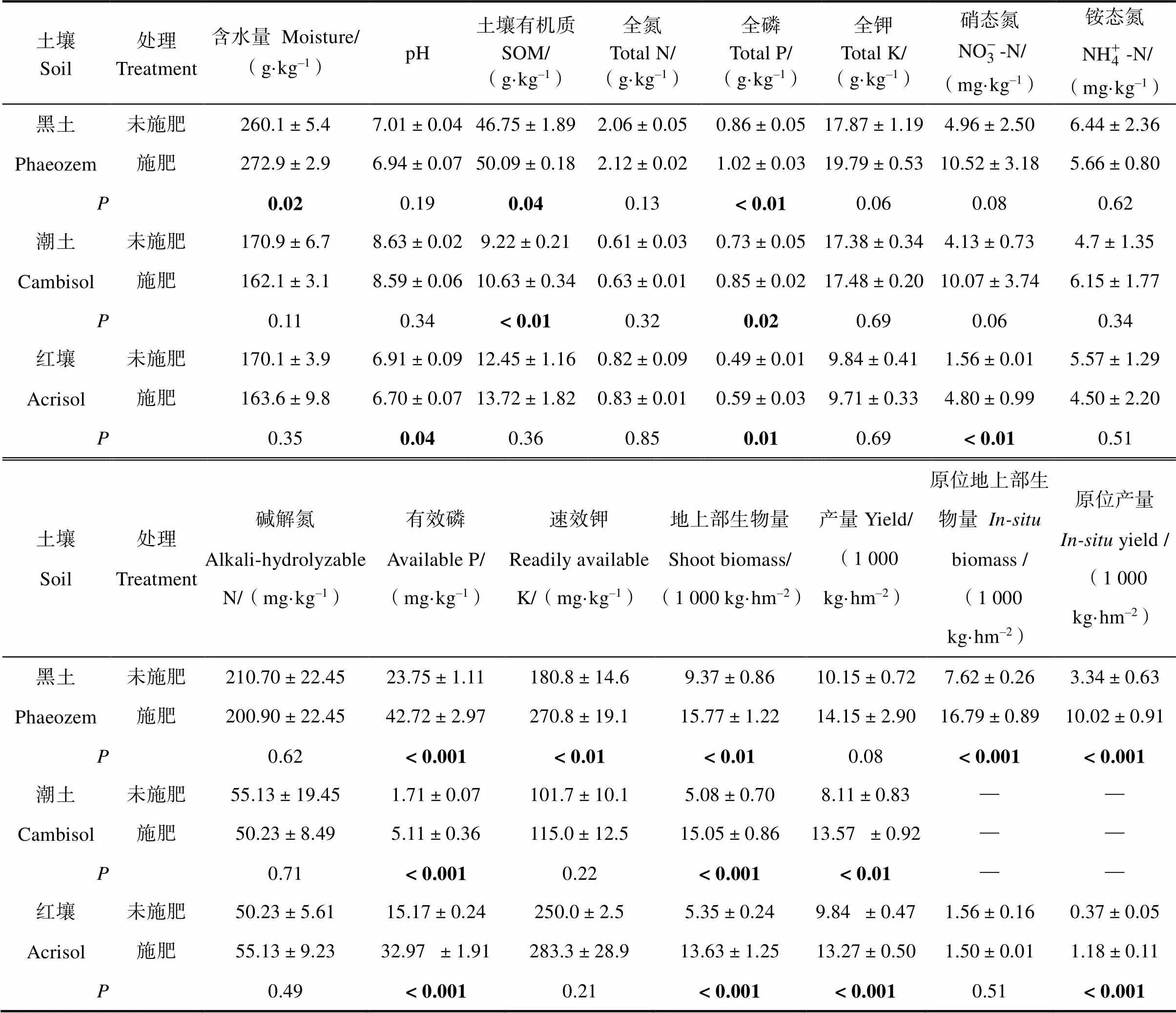
表2 同種土壤類型下施肥對土壤理化性質、玉米地上部生物量和產量的影響(2016)
注:未施肥處理unfertilized treatment;施肥處理 fertilized treatment;加粗表示處理之間存在顯著差異(<0.05)。下同。Note:Unfertilized treatment,fertilized treatment;bold indicates significant different between treatments(<0.05). The same below.

注:圖a)伯克霍爾德氏菌的豐富度和多樣性,其中小寫字母代表同種土壤施肥與不施肥之間的比較,大寫字母代表同一處理(施肥或不施肥)下不同土壤之間的比較,不同字母表示存在顯著差異;圖b)同一微生物分類等級下,不同處理土壤中微生物的相對豐度,其中數字代表測序得到的序列數,其中在屬水平下只展示了相對豐度在該屬中大于1%的物種;圖c)種水平伯克霍爾德氏菌的熱圖分析,P代表黑土Phaeozem,C代表潮土Cambisol,A代表紅壤Acrisol,U代表未施肥unfertilized,F代表施肥fertilized,如PU代表黑土未施肥;黃色方框代表在同一種土壤下施肥與未施肥之間的比較;“*”代表顯著性水平P<0.05,“**”代表P<0.01,“***”代表P<0.001。下同。Note:Fig. a)richness and diversity of Burkholderiales,in which lowercase letters represent a comparison between fertilized and unfertilized treatment under the same soil,capital letters represent a comparison between different soils under the same treatment,different letters indicate significant difference;Fig. b)relative abundances of microbes under different treated soils at the same classification level,in which numbers represent reads obtained by sequencing,only species with a relative abundance greater than 1% are shown at the genus level;Fig. c)heatmap analysis of Burkholderiales at the level of species,in which P,C,A,U and F represent Phaeozem,Cambisol,Acrisol,unfertilized and fertilized treatment,respectively. For example,PU represent Phaeozem-unfertilized;yellow boxes represent a comparison between fertilized and unfertilized treatment under the same soil. “*” represents significance level P<0.05,“**” represents significance level P<0.01,“***” represents significance level P<0.001. The same below.
2.3 土壤理化性質與伯克霍爾德氏菌群落之間的關系
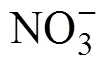
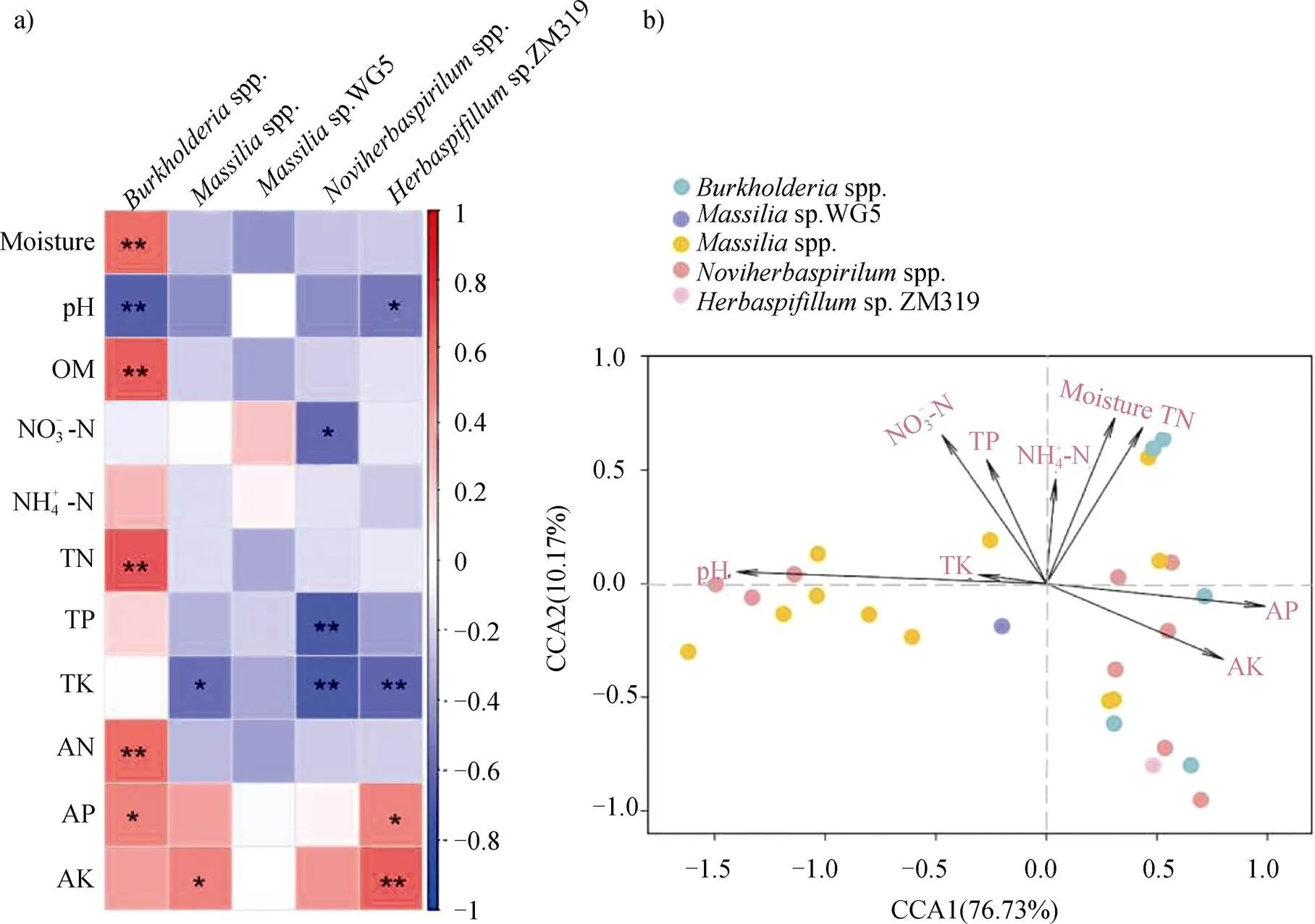
注:圖a)為存在顯著變化的伯克霍爾德氏菌與土壤理化性質之間的相關性分析,顏色深度代表相關性強弱,藍色表示負相關,紅色表示正相關;圖b)為典范對應(CCA)分析。Note:Fig. a)correlation analysis between Burkholderiales with significant changes and the soil physicochemical properties,in which color depth represents the strength of the correlation,blue indicates the negative correlation,and red indicates the positive correlation;Fig. b)canonical correspondence analysis(CCA).
2.4 生物因素、非生物因素與玉米地上部生物量和產量之間的關系
利用結構方程模型,建立了土壤營養狀況、pH及伯克霍爾德氏菌相對豐度與玉米地上部生物量和產量之間潛在的直接和間接聯系。結果表明:施肥對土壤營養狀態的改善既能夠直接地影響玉米地上部生物量(如有效磷)和產量(如硝態氮和速效鉀),也能夠通過影響土壤pH和馬賽菌屬的群落結構間接產生影響(圖3a)。此外,雖然施肥導致的土壤理化性質的改變對sp. WG5的相對豐度變化均無顯著影響(圖2),但是屬于馬賽菌屬的同種微生物之間存在明顯的正相關關系(=0.85,<0.01),這意味著其同屬內的其他物種可能通過增加sp. WG5的相對豐度從而影響玉米的產量。此外,標準總體效應的結果表明了有效磷和硝態氮含量的增加是提高玉米地上部生物量和產量的最主要因素,馬賽菌屬相對豐度的變化也會潛在影響玉米地上部生物量和產量(圖3b)。
2.5 伯克霍爾德氏菌相對豐度與玉米地上部生物量和產量的關系
對伯克霍爾德氏菌相對豐度與玉米地上部生物量和產量的線性回歸分析表明,其中馬賽菌屬的sp. WG5和spp.的相對豐度與玉米產量存在明顯的線性相關(圖4)(0.05)。在不同土壤中施肥對這兩種菌的影響并不一致,僅在有機質含量不高、土壤呈堿性的潮土中,施肥才會顯著影響馬賽菌的相對豐度;Mantel檢測也發現僅在潮土中馬賽菌相對豐度變化與玉米地上部生物量和產量之間有顯著相關性(表3)。
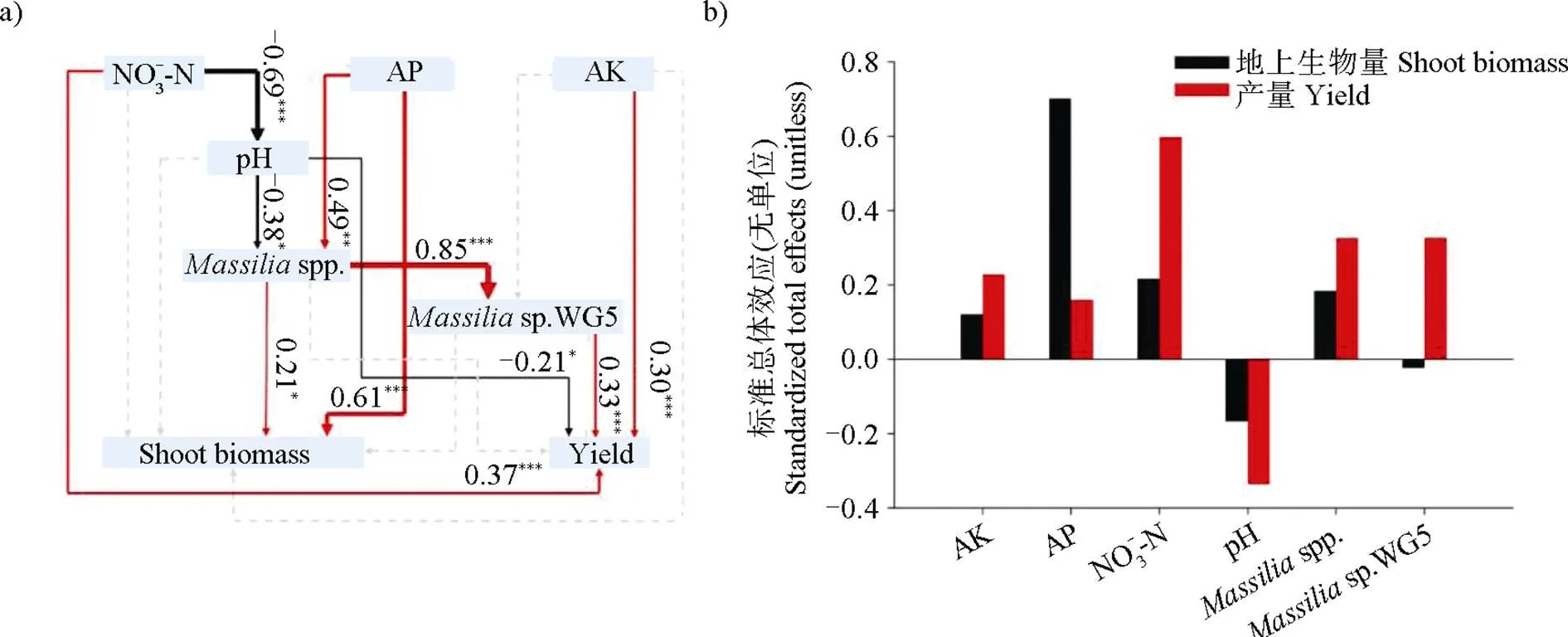
注:圖a)為結構方程模型(SEM),χ2 = 7.051,P = 0.632,df = 9;bootstrap P = 0.806;GFI = 0.931;RMSEA = 0.000,P = 0.662,灰色帶箭頭的虛線代表沒有顯著相關,紅色帶箭頭的實線代表顯著正相關,黑色帶箭頭的實線代表顯著負相關;圖b)為結構方程模型中各指標對地上部生物量和產量的總影響。Note:Fig. a)structural equation model(SEM),χ2 = 7.051,P = 0.632,df = 9;bootstrap P = 0.806;GFI = 0.931;RMSEA = 0.000,P = 0.662,in which dotted grey arrows represent non-significant paths(P>0.05),solid red arrows represent positive paths(P<0.05),solid black arrows represent negative paths(P<0.05). Fig. b)total effect of each index on shoot biomass and yield in structural equation model.
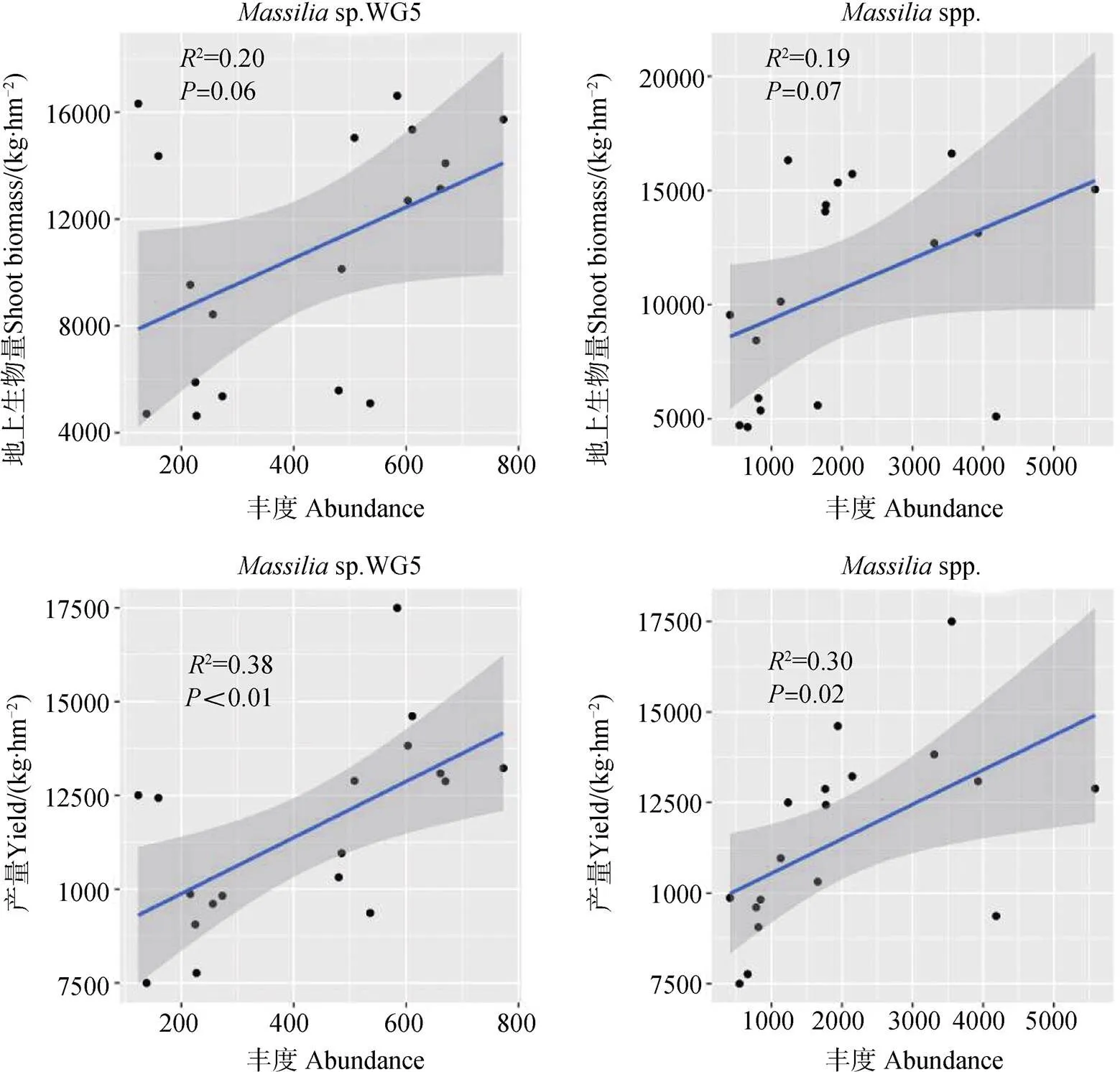
圖4 伯克霍爾德氏菌與地上部生物量和產量的線性擬合
3 討 論
基于伯克霍爾德氏菌的16S rRNA測序數據,本研究發現在同種土壤中施肥并沒有顯著改變根際土壤中伯克霍爾德氏菌的α多樣性(圖1a),這可能是因為在根際土壤中存在大量的根際分泌物[23-24],所以根際環境中碳可能不是伯克霍爾德氏菌的限制性因素[25]。這一點與Stopnisek等[11]的研究結果一致,土壤中有機質的含量不會影響伯克霍爾德氏菌的多樣性。此外,在本研究中草酸菌科是伯克霍爾德氏菌群落內的優勢菌(圖1b)。有證據表明該菌的多樣性主要受菌根真菌的影響[26-27],其大多數成員與菌根真菌存在共生關系[28],所以施肥可能對草酸菌科下群落的多樣性影響較弱。

表3 不同土壤類型下兩種馬賽菌對地上部分生物量和作物產量的Mantel檢測
研究表明在根際土壤草酸桿菌科下的馬賽菌屬是一種重要的功能菌[29],該菌屬中的多數成員具有溶磷[15]、降解菲[30]及提高作物對鹽的耐受力的功能[31]。與過去的研究一致[25],在三種土壤中,本研究均發現了豐富的馬賽菌(圖1b和圖1c)。然而,只有在潮土中馬賽菌(主要是sp. WG5和spp.)的相對豐度對施肥有顯著的響應,這可能與該菌的生存策略有關。研究表明富營養生存策略的細菌有更快的生長速度,同時對競爭和和營養狀態的改變有更高的敏感性[32-33]。已有研究證明了馬賽菌屬于富營養型細菌[25],并且大量存在于根際土壤中[34]。在本研究中結構方程模型分析發現土壤中有效磷含量與馬賽菌(主要是spp.)的相對豐度顯著正相關(圖3a;= 0.49,<0.01),而硝態氮含量的變化能夠間接影響馬賽菌的相對豐度。因此,在有效磷含量被顯著改善而土壤pH沒有變化的潮土中馬賽菌對施肥會有一個明顯的響應。對于黑土而言,因為其本身具有很高的有機質和有效磷含量(表2),因此在該土壤類型下碳和營養物質不是馬賽菌屬生長和繁殖的限制因子。黑土含有豐富的碳和營養物質,因此其可能包含更多的營富營養生存策略的微生物,這可能會給馬賽菌屬帶來較大的競爭壓力[25];同時,在移置到封丘后其土壤有機質含量的明顯降低,這將進一步增加富營養微生物間對生態位和生存空間的競爭。因此,施肥雖然會增加黑土中有效磷和速效鉀的含量,但是這些營養物質的改善并沒有增加馬賽菌屬的相對豐度。本研究中施肥顯著降低了紅壤的pH,從而增加馬賽菌(主要是spp.)的相對豐度(圖3a),這意味著馬賽菌更適合生活在偏酸性的土壤中。
本研究結果表明在弱堿性和有機質含量較低的潮土中,馬賽菌屬相對豐度的增加可能是提高玉米地上部生物量和產量的一個潛在生物途徑(圖3和圖4)。這可能是由于以下原因:首先大量的研究證明了馬賽菌是一類具有溶磷能力的菌屬[13-15,34],在過去的研究中無論是磷缺乏的土壤中[13],還是在長期施加磷礦石[14]的土壤中均有發現豐富的馬賽菌。相關研究還表明馬賽菌的豐度與磷酸酶的活性顯著正相關[34]。因此,潮土中馬賽菌相對豐度的增加能夠為玉米提供更多的有效磷。在本研究中,Mantel檢測也證明了在潮土中該菌屬相對豐度的變化顯著影響玉米地上部生物量和產量(表3)。其次,Silva等[14]在研究發現馬賽菌屬有利于提高玉米對磷的吸收能力。在本研究中,施肥土壤中玉米地上生物量和產量的變化分別是黑土中增加了68.30%和39.41%;潮土中增加了196.26%和67.32%;紅壤中增加了155.14%和34.86%(表2),潮土中玉米地上生物量和產量的增加相比于黑土和紅壤來說更高。施肥是提高玉米生物量和產量的重要因素(圖3b),潮土中馬賽菌屬群落結構的變化可能也是提高玉米地上生物量和產量的重要潛在生物因素。
4 結 論
氮磷鉀施肥顯著增加潮土中spp.、spp.和sp. WG5的相對豐度;增加紅壤中sp. ZM319的相對豐度,降低紅壤中spp.的相對豐度(< 0.05);黑土中所有檢測到的伯克霍爾德氏菌的相對豐度均無顯著影響。基于統計學分析,本研究發現馬賽菌屬相對豐度的變化可能是改變玉米地上生物量和產量的潛在生物途徑。由于該結果是基于統計學分析得到的,未來需要增加實驗對其進一步驗證。
[1] Pérez-Pantoja D,Donoso R,Agulló L,et al. Genomic analysis of the potential for aromatic compounds biodegradation in Burkholderiales[J]. Environmental Microbiology,2012,14(5):1091—1117.
[2] Stoyanova M,Pavlina I,Moncheva P,et al. Biodiversity and incidence ofspecies[J]. Biotechnology & Biotechnological Equipment,2007,21(3):306—310.
[3] Zhang H,Hanada S,Shigematsu T,et al.sp. nov.,a trichloroethylene(TCE)-degrading bacterium isolated from an aquifer polluted with TCE[J]. International Journal of Systematic and Evolutionary Microbiology,2000,50(2):743—749.
[4] Vandamme P,Henry D,Coenye T,et al.sp. nov. and,two additionalcomplex bacteria,may confound results of new molecular diagnostic tools[J]. FEMS Immunology & Medical Microbiology,2002,33(2):143—149.
[5] Castanheira N,Dourado A C,Kruz S,et al. Plant growth-promotingspecies isolated from annual ryegrass in Portuguese soils[J]. Journal of Applied Microbiology,2016,120(3):724—739.
[6] Tran Van V,Berge O,Ng? Kê S,et al. Repeated beneficial effects of rice inoculation with a strain ofon early and late yield components in low fertility sulphate acid soils of Vietnam[J]. Plant and Soil,2000,218(1/2):273—284.
[7] Pallud C,Viallard V,Balandreau J,et al. Combined use of a specific probe and PCAT medium to studyin soil[J]. Journal of Microbiological Methods,2001,47(1):25—34.
[8] Coenye T,Vandamme P. Diversity and significance ofspecies occupying diverse ecological niches[J]. Environmental Microbiology,2003,5(9):719—729.
[9] Chu H Y,Lin X G,Fujii T,et al. Soil microbial biomass,dehydrogenase activity,bacterial community structure in response to long-term fertilizer management[J]. Soil Biology & Biochemistry,2007,39(11):2971—2976.
[10] Fierer N,Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(3):626—631.
[11] Stopnisek N,Bodenhausen N,Frey B,et al. Genus-wide acid tolerance accounts for the biogeographical distribution of soilpopulations[J]. Environmental Microbiology,2014,16(6):1503—1512.
[12] Tilman D,Dodd M,Silvertown J,et al. The park grass experiment:Insights from the most long-term ecological study[M]//Leigh R A,Johnston A E. Long-term experiments in agricultural and ecological science. Wallingford,UK:CABI,1994:287—303.
[13] Samaddar S,Chatterjee P,Truu J,et al. Long-term phosphorus limitation changes the bacterial community structure and functioning in paddy soils[J]. Applied Soil Ecology,2019,134:111—115.
[14] Silva U C,Medeiros J D,Leite L R,et al. Long-term rock phosphate fertilization impacts the microbial communities of maize rhizosphere[J]. Frontiers in Microbiology,2017,8:1266. https://doi.org/10.3389/ fmicb.2017.01266.
[15] Zheng B X,Bi Q F,Hao X L,et al.sp. nov.,a phosphate solubilizing bacteria isolated from a long-term fertilized soil[J]. International Journal of Systematic and Evolutionary Microbiology,2017,67(8):2514—2519.
[16] Itoh H,Aita M,Nagayama A,et al. Evidence of environmental and vertical transmission ofsymbionts in the oriental chinch bug,Heteroptera:Blissidae)[J]. Applied and Environmental Microbiology,2014,80(19):5974—5983.
[17] Teixeira L C R S,Peixoto R S,Cury J C,et al. Bacterial diversity in rhizosphere soil from Antarctic vascular plants of Admiralty Bay,maritime Antarctica[J]. The ISME Journal,2010,4(8):989—1001.
[18] Edwards J,Johnson C,Santos—Medellín C,et al. Structure,variation,and assembly of the root-associated microbiomes of rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(8):E911—E920. https://doi.org/10.1073/pnas. 1414592112.
[19] Lu R K. Analytical methods for soil and agro-chemistry[M]. Beijing:China Agricultural Science and Technology Press,1999. [魯如坤. 土壤農業化學分析方法[M]. 北京:中國農業科技出版社,1999.]
[20] Dixon P. VEGAN,a package of R functions for community ecology[J]. Journal of Vegetation Science,2003,14(6):927—930.
[21] Grace J B. Structural equation modeling natural systems[M]. Cambridge:Cambridge University Press,2006.
[22] Schermelleh-Engel K,Moosbrugger H. Evaluating the fit of structural equation models:Tests of significance and descriptive goodness-of-fit measures[J]. Methods of Psychological Research Online,2003,2(8):23—74
[23] Dennis P G,Miller A J,Hirsch P R. Are root exudates more important than other sources of rhizodeposits in structuring rhizosphere bacterial communities?[J]. FEMS Microbiology Ecology,2010,72(3):313—327.
[24] Eisenhauer N,Lanoue A,Strecker T,et al. Root biomass and exudates link plant diversity with soil bacterial and fungal biomass[J]. Scientific Reports,2017,7:44641.
[25] Ofek M,Hadar Y,Minz D. Ecology of root colonizing(Oxalobacteraceae)[J]. PLoS One,2012,7(7):e40117. https://doi.org/10.1371/journal.pone. 0040117.
[26] Offre P,Pivato B,Mazurier S,et al. Microdiversity ofassociated with mycorrhizal and nonmycorrhizal roots of[J]. FEMS Microbiology Ecology,2008,65(2):180—192.
[27] de Boer W,Folman L B,Summerbell R C,et al. Living in a fungal world:Impact of fungi on soil bacterial niche development[J]. FEMS Microbiology Reviews,2005,29(4):795—811.
[28] Bianciotto V,Lumini E ,Bonfante P,et al. ‘Glomeribacter gigasporarum’ gen. nov.,sp. nov.,an endosymbiont of arbuscular mycorrhizal fungi[J]. International Journal of Systematic and Evolutionary Microbiology,2003,53(1):121—124.
[29] Yang E D,Cui D X,Wang W Y. Research progress on the genus[J]. Microbiology China,2019,46(6):1537—1548. [楊恩東,崔丹曦,汪維云. 馬賽菌屬細菌研究進展[J]. 微生物學通報,2019,46(6):1537—1548.]
[30] Lou J,Gu H P,Wang H Z,et al. Complete genome sequence ofsp. WG5,an efficient phenanthrene-degrading bacterium from soil[J]. Journal of Biotechnology,2016,218:49—50.
[31] Krishnamoorthy R,Kim K,Subramanian P,et al. Arbuscular mycorrhizal fungi and associated bacteria isolated from salt-affected soil enhances the tolerance of maize to salinity in coastal reclamation soil[J]. Agriculture,Ecosystems & Environment,2016,231:233—239.
[32] Barbosa E R M,Tomlinson K W,Carvalheiro L G,et al. Short-term effect of nutrient availability and rainfall distribution on biomass production and leaf nutrient content of savanna tree species[J]. PLoS One,2014,9(3):e92619. https://doi.org/10.1371/journal.pone. 0092619.
[33] Suding K N,Collins S L,Gough L,et al. Functional- and abundance-based mechanisms explain diversity loss due to N fertilization[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(12):4387—4392.
[34] Cardinale M,Suarez C,Steffens D,et al. Effect of different soil phosphate sources on the active bacterial microbiota is greater in the rhizosphere than in the endorhiza of barley(L.)[J]. Microbial Ecology,2019,77(3):689—700.
Community Structure of Burkholderiales and Its Diversity in Typical Maize Rhizosphere Soil
HUANG Ruilin1, ZHANG Na2, SUN Bo2, LIANG Yuting2?
(1. School of Environmental and Safety Engineering, Changzhou University, Changzhou,Jiangsu 213164, China; 2. State Key Laboratory of Soil and Sustainable Agriculture,Institute of Soil Science,Chinese Academy of Sciences,Nanjing 210008, China)
【】Under the class β-proteobacteria, Burkholderiales is a kind of Gram-negative bacteria, characterized physiologically as strict aerobic, facultative anaerobic and obligate anaerobic chemoheterotrophic types, and composed mainly ofBurkholaceae, Oxalobacteriaceae, Alcaligenaceae, and Comamonadaceae in taxonomy. In rhizospheric environment, Burkholderiales is an important group of pro-growth bacteria that can promote growth and development of plants. It can not only promote plant growth by producing phytohormones, but also improve the environment in which plants grow via nitrogen fixation, nodulation and phosphorus solubilization. Studies, so far accomplished, have demonstrated that soil physicochemical properties, soil pH, soil type and fertilization can affect the community structure and composition of Burkholderiales, but failed to address variation of the effects with soil type and its potential relationship with crop yield.【】In this study, 16S rRNA high-throughput sequencing of Burkholderiales was performed with a pair of specific primersBased on the findings, responses of Burkholderiales to nitrogen, phosphorus and potassium fertilization (N, P and K) in community structure and of the maize crops in three different types of agricultural soils (phaeozem, cambisol and acrisol) in shoot biomass and yield were investigated.【】Results show that application of chemical fertilizer did not affect much richness and diversity of the Burkholderiales in the three types of soil, as compared to the unfertilized plot. Moreover, three taxa of bacteria, i.e. Oxalobacteraceae, Comammonadaceae, and Burkholderiaceae, were detected at the family level of Burkholderiales. And Oxalobacteraceae was the dominant group. In addition, fertilization markedly increased relative abundance of the(mainlyspp.) and(mainlyspp. andsp. WG5) in the cambisol low in organic matter (<0.01), while it significantly increased relative abundance of the(mainlysp.), but decreased that of the(mainlyspp.) (<0.01) in acidic acrisol. However, it did not affect much the relative abundance of all detected groups ofBurkholderiales in the phaeozem high in soil organic matter and nutrient. Pearson correlation analysis and canonical correspondence analysis (CCA) indicates that nutrient (such as AP and AK) content and soil pH are the main factors affecting the community composition and structure of these bacteria (,and). Furthermore, linear regression analysis and Mantel test shows that only the relative abundance ofis significantly correlated with the shoot biomass and yield of maize (0.05). All these statistical analyses demonstrate that changes in community structure ofmay affect shoot biomass and yield of the crop. 【】This study indicates that although chemical fertilization is the main cause of the increase in shoot biomass and yield of maize, changes in community structure of rhizosphere microbes, such as Burkholderiales, may also be potential biological factors affecting shoot biomass and yield of maize.
Burkholderiales;; Rhizosphere microbes; Fertilization; Phosphorus solubilization
X172
A
10.11766/trxb201901040008
黃瑞林,張娜,孫波,梁玉婷. 典型農田根際土壤伯克霍爾德氏菌群落結構及其多樣性[J]. 土壤學報,2020,57(4):975–985.
HUANG Ruilin,ZHANG Na,SUN Bo,LIANG Yuting. Community Structure of Burkholderiales and Its Diversity in Typical Maize Rhizosphere Soil[J]. Acta Pedologica Sinica,2020,57(4):975–985.
* 國家自然科學基金項目(41622104)資助Supported by the National Natural Science Foundation of China(No.41622104)
,E-mail:ytliang@issas.ac.cn
黃瑞林(1992—),男,河南項城人,碩士研究生,主要研究方向為土壤微生物。E-mail:fhruilin@163.com
2019–01–04;
2019–04–08;
2019–05–09
(責任編輯:盧 萍)

