金紅石型TiO2/ZnTiO3復合材料的制備及其光催化性能
朱曉東王 娟羅宇浩代華龍喻 強馮 威*
(1.成都大學機械工程學院,四川成都 610106; 2.四川新亞無損檢測有限公司,四川成都 610213)
1 引 言
隨著全球工業(yè)的發(fā)展,環(huán)境污染越來越嚴重,利用光催化技術降解污染物是解決污染問題的一種重要手段[1]。TiO2作為一種環(huán)境友好光催化材料,以其價格低廉、無毒無害、化學性質(zhì)穩(wěn)定、效率高等優(yōu)點而備受關注[2-3]。由于純TiO2存在光生電子-空穴對易復合、對太陽光利用率低等缺點[4-5],在實際使用中,通常對其進行改性處理,以提高光催化性能[6-9]。在改性方法中,離子摻雜被廣泛采用。Anju等[10]采用水熱法制備了純TiO2與不同元素(Fe,Co,Ni)摻雜 TiO2的光催化劑,研究發(fā)現(xiàn)摻雜之后都能減小禁帶寬度,增加對光的利用率,提高光催化性能。Kalantari等[11]利用超聲輔助浸漬法制備了Fe、N單摻雜和共摻雜TiO2光催化劑,研究表明Fe、N的摻雜都能導致改性TiO2樣品帶隙能的降低,對光的利用增強,摻雜后光催化性能均高于純TiO2,且Fe、N共摻雜樣品表現(xiàn)出最佳光催化活性,對二苯并噻吩(DBT)的去除率達到59.8%。當摻雜濃度過高,就可能出現(xiàn)新相,形成半導體復合結構,半導體復合結構能夠加快光生電子與空穴的遷移,提高光催化活性[5,7]。張進等[12]采用溶膠-凝膠法制備了TiO2-ZnTiO3納米復合薄膜,研究結果表明,Zn濃度越高,ZnTiO3含量越多,半導體TiO2與ZnTiO3通過耦合作用,促進光生電子-空穴的分離,使其光催化性能更好,在Ti/Zn=6∶1時,復合薄膜在紫外光下對亞甲基藍(MB)溶液的降解率可達94%。TiO2/ZnTiO3體系研究集中在銳鈦礦TiO2[5]以及銳鈦礦/金紅石混晶TiO2[12],針對純金紅石TiO2/ZnTiO3復合結構的研究較少。一般認為金紅石的光催化活性低于銳鈦礦或者混晶結構,但是也有研究表明經(jīng)過一定的改性處理,金紅石活性明顯提高,甚至高于銳鈦礦[1,3]。因此,對金紅石進行改性,探索提高金紅石基復合光催化劑性能有很好的研究意義。本文通過溶膠-凝膠法制備了金紅石型TiO2/ZnTiO3復合光催化劑,對樣品進行了晶體結構、表面形貌、元素價態(tài)等表征,并以MB為目標污染物,研究了金紅石型TiO2/ZnTiO3復合光催化劑的光催化性能。
2 實 驗
2.1 材料制備
在溶液A中依次加入體積比為2∶1的無水乙醇和鈦酸丁酯,在B溶液中加入去離子水、冰乙酸、無水乙醇,其體積比為2∶3∶6。攪拌均勻后將溶液B滴加入A溶液中,保持攪拌形成溶膠,室溫下陳化形成凝膠后將其置于烘箱中在100℃下烘干,對其進行650℃下保溫1 h的熱處理即得最終純TiO2粉體。在溶液B中加入一定量硝酸鋅,其余步驟相同,即可制得不同Zn/Ti濃度的光催化劑,本次實驗Zn/Ti原子百分比為0.5%、2%、8%。
2.2 表征技術
樣品晶體結構采用DX-2700型X射線衍射儀進行分析(XRD),形貌由SU8220型掃描電子顯微鏡進行分析(SEM),元素組成以及價態(tài)由XSAM800型多功能表面分析系統(tǒng)進行分析(XPS),光生電子與空穴復合檢測采用F-4600型熒光光譜儀進行分析(PL)。
2.3 光催化實驗
以MB水溶液為目標污染物,初始濃度為10 mg/L,取100 mL倒入燒杯,加入樣品粉體0.1 g,超聲分散10 min,隨后將其置于暗態(tài)攪拌30 min以達到吸附脫附平衡,然后用250 W氙燈作為光源,反應開始后每隔30 min取樣一次,離心分離后取上層澄清溶液,在λ=664 nm處測試其吸光度A,并由公式(A0-At)/A0×100%計算降解率,其中A0、At分別為初始以及t時刻的吸光度,整個測試過程持續(xù)90 min。
3 結果與分析
3.1 XRD分析
圖1為純TiO2與Zn-TiO2樣品的XRD圖。可以看到純 TiO2圖在2θ為 27.4°、36.1°、41.2°、54.4°、56.7°、69.1°的位置出現(xiàn)了明顯的衍射峰,分別與金紅石晶型的(110)、(101)、(111)、(211)、(220)、(301)晶面相對應,表明純 TiO2是金紅石結構(PDF No.21-1276)。Zn-TiO2樣品的衍射峰強度降低,半高寬由純TiO2的0.160增大到0.186(8%Zn-TiO2),這可能是因為Zn2+的離子半徑(0.074 nm)大于Ti4+的離子半徑(0.060 5 nm),一部分Zn2+在取代Ti4+晶格位置時,由于價態(tài)與離子半徑的不同,會在取代位置附近形成晶格缺陷,使得非晶成分增加,結晶度降低,表明Zn加入會抑制TiO2晶型的完整性[13]。值得注意的是在Zn/Ti量比為2%與8%的樣品中,除了有金紅石特征峰外,還在 32.9°、35.4°、49.0°、53.5°、61.9°等位置出現(xiàn)了新的衍射峰,對應ZnTiO3的(104)、(110)、(024)、(116)、(214)晶面(PDF No.26-1500)[12],形成了金紅石 TiO2/ZnTiO3的半導體復合結構。且隨著Zn濃度增加,這些峰強度也隨之增大。
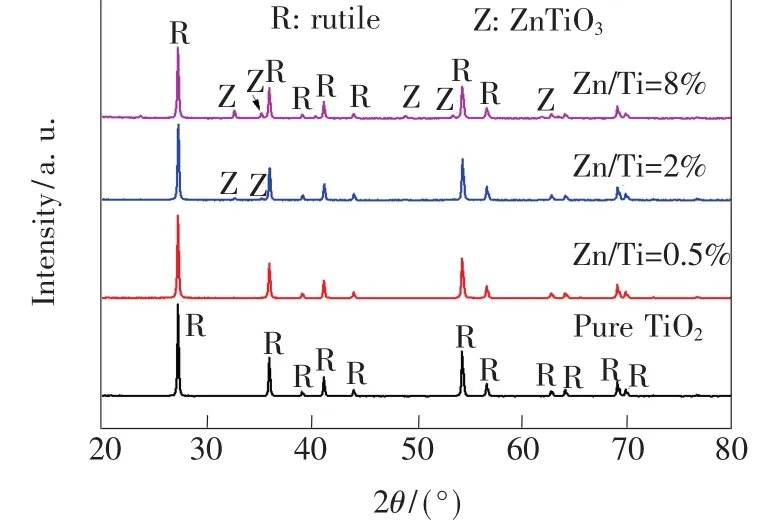
圖1 純TiO2和Zn-TiO2XRD圖Fig.1 XRD patterns of pure TiO2and Zn-TiO2
由謝樂公式計算樣品的金紅石平均晶粒尺寸,隨著Zn/Ti量比的提高,晶粒尺寸由純TiO2的50.5 nm減小到43.5 nm(Zn/Ti=8%),可能是因為Zn2+置換TiO2晶格中的Ti4+離子,相互作用形成Ti—O—Zn鍵,阻止了晶粒的生長[14-15]。
3.2 SEM分析
圖2為純TiO2與TiO2/ZnTiO3(Zn/Ti=8%)樣品的SEM照片。從照片中可以看出,樣品的顆粒形狀不規(guī)則,呈現(xiàn)板塊狀類似形貌,顆粒團聚現(xiàn)象嚴重,尺寸也有較大波動,從幾十納米到幾百納米均有分布。由于納米材料具有較大的比表面積,表面存在的大量孿晶、位錯等晶體缺陷使納米顆粒具有極大的不飽和性,容易自發(fā)團聚形成大顆粒[16]。由SEM照片對比可知,Zn加入對TiO2顆粒形貌改變不明顯。

圖2 純TiO2(a)及TiO2/ZnTiO3(Zn/Ti=8%)(b)SEM照片F(xiàn)ig.2 SEM images of pure TiO2(a)and TiO2/ZnTiO3(Zn/Ti=8%)(b)
3.3 XPS分析
為了分析樣品的元素組成及價態(tài),對純TiO2及TiO2/ZnTiO3(Zn/Ti=8%)進行XPS測試,結果如圖3所示。圖3(a)為全譜圖,從圖3(a)可知,TiO2/ZnTiO3(Zn/Ti=8%)組成元素為 Ti、O、Zn、C,C元素主要來源于測試過程中的污染。相對于純TiO2,出現(xiàn)了Zn元素特征峰,表明Zn元素已經(jīng)存在于樣品中。圖3(b)為Ti 2p高分辨圖譜,Ti 2p3/2和Ti 2p1/2軌道對應的結合能分別為 458.44 eV和 464.04 eV、458.50 eV和464.13 eV,表明 Ti元素為 +4 價[4,17];TiO2/Zn-TiO3(Zn/Ti=8%)的Ti 2p1/2和Ti 2p3/2結合能分別比純TiO2向高結合能偏移了0.09 eV和0.06 eV。從圖3(c)Zn 2p高分辨圖譜可知,Zn 2p在1 021.70 eV和1 044.85 eV兩處均出現(xiàn)了特征峰,分別對應于Zn 2p3/2和Zn 2p1/2,表明Zn元素以+2價形式存在[17-18]。圖3(d)為O 1s高分辨圖譜,純TiO2特征峰位于529.80 eV和531.75 eV,分別對應于晶格氧(O2-)與表面羥基(OH-)[4,17,19];與之類似,TiO2/ZnTiO3(Zn/Ti=8%)O 1s峰位于529.83 eV和531.66 eV,也分別對應晶格氧和表面羥基。結合圖3(b)和圖3(d)可知,Zn摻雜后樣品的Ti 2p和O 1s結合能均發(fā)生了微弱偏移,這可能歸因于Zn2+進入TiO2晶格和TiO2的Ti、O元素發(fā)生了相互作用[18]。計算可得,純TiO2表面羥基中氧元素含量占所有氧元素的比例為13.5%,TiO2/ZnTiO3(Zn/Ti=8%)為19.7%,表面羥基增多。Zn加入后樣品晶粒尺寸減小,且會使TiO2表面產(chǎn)生氧空位,吸附了更多的羥基,這些羥基與空穴結合反應生成氫氧自由基,具有很強的氧化能力,有利于對污染物的降解[19]。
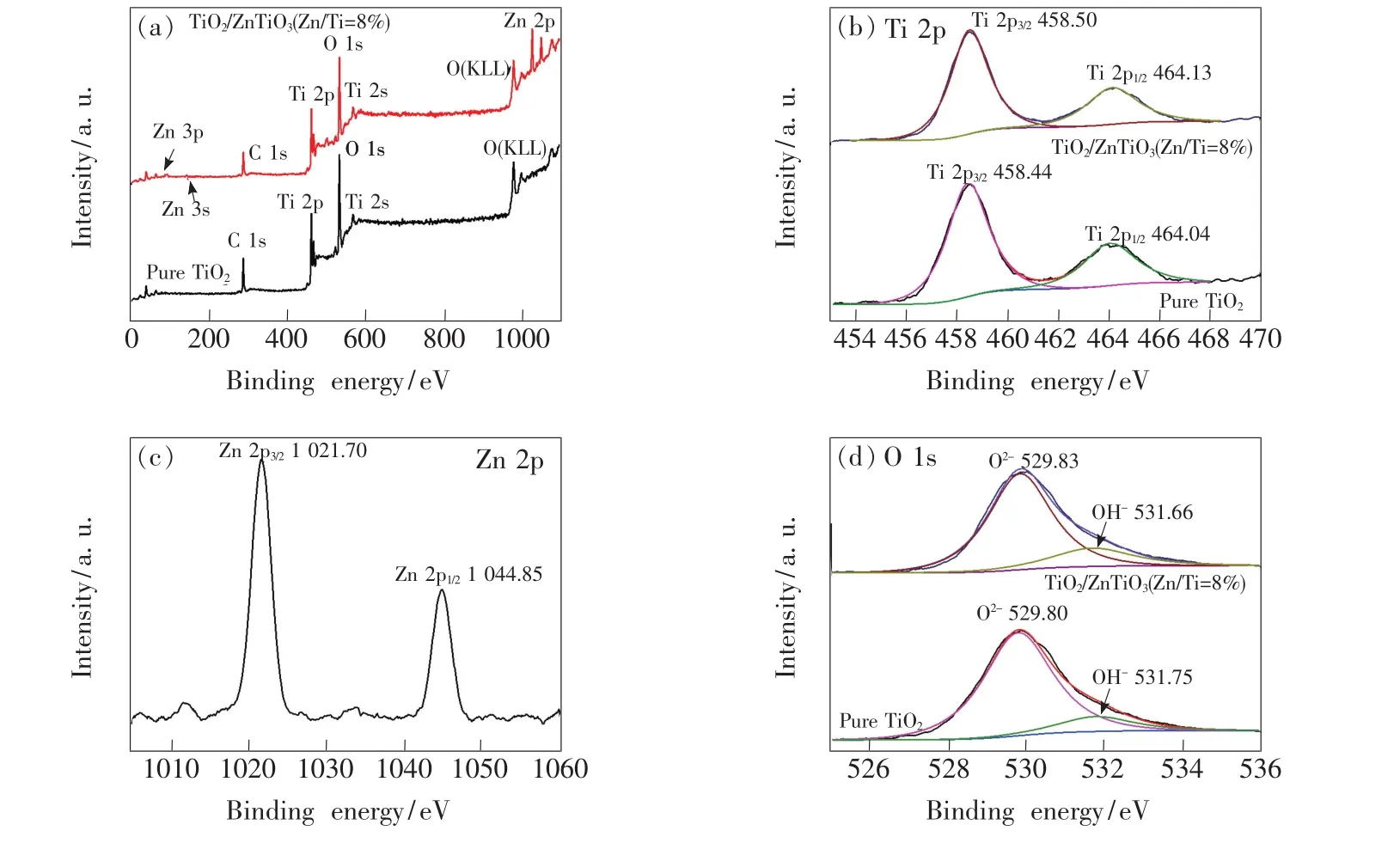
圖3 純TiO2及TiO2/ZnTiO3(Zn/Ti=8%)的XPS圖譜。(a)全譜圖;(b)Ti 2p高分辨圖譜;(c)Zn 2p高分辨圖譜;(d)O 1s高分辨圖譜。Fig.3 XPS spectra of pure TiO2and TiO2/ZnTiO3(Zn/Ti=8%).(a)Total spectra.(b)High resolution spectra of Ti 2p.(c)High resolution spectrum of Zn 2p.(d)High resolution spectra of O 1s.
3.4 PL分析
TiO2受到能量大于禁帶寬度能量的光照射時,價帶上的電子會躍遷至導帶變成光生電子,并在價帶形成對應的光生空穴,光生電子與光生空穴非常容易發(fā)生復合,釋放出光子。因此,高的PL峰強度代表著高的電子空穴復合率[20-21]。
圖4為樣品PL光譜圖,由圖可知,TiO2/Zn-TiO3(Zn/Ti=8%)的峰強度最低,表明具有最小的光生電子空穴復合率。0.5%Zn摻雜 TiO2、TiO2/ZnTiO3(Zn/Ti=2%)略高于純TiO2,這可能是Zn加入后非晶成分增多,在光催化劑表面引入了缺陷,這些缺陷成為了光生電子與空穴的復合中心,因此PL峰強度略有增強[22-23]。另一方面,在TiO2/ZnTiO3(Zn/Ti=2%)和 TiO2/ZnTiO3(Zn/Ti=8%)樣品中生成了新相ZnTiO3,ZnTiO3也是一種半導體,兩種半導體的能帶結構由于導帶和價帶位置不一致而產(chǎn)生交疊,加快了光生電子與空穴的遷移,降低了復合率,使得峰強度降低[5,12,24-26]。 且隨著摻雜濃度的增加,阻礙光生電子-空穴對的復合作用越強,峰強度降低越多,因此TiO2/ZnTiO3(Zn/Ti=8%)的峰強度最低。

圖4 純TiO2及Zn-TiO2熒光光譜Fig.4 PL spectra of pure TiO2and Zn-TiO2
3.5 光催化性能
圖5 為樣品對MB的降解曲線,90 min后,純TiO2、0.5%Zn 摻雜 TiO2、TiO2/ZnTiO3(Zn/Ti=2%)和TiO2/ZnTiO3(Zn/Ti=8%)對MB的降解率分別為36.9%、34.8%、39.9%、68.3%。隨著Zn/Ti量比的提高,樣品對MB的降解率先下降后升高。由XRD分析可知,Zn加入后衍射峰半高寬增大,表明結晶度有所降低,非晶成分增加,不利于光催化性能[13];此外,由PL測試結果可知,在Zn加入過程引入的晶體缺陷,會成為光生電子-空穴的復合中心,降低了量子利用率,不利于光催化活性。當Zn/Ti量比進一步增加時,生成了新相ZnTiO3,與金紅石形成TiO2/ZnTiO3半導體復合結構,如圖6所示,金紅石的導帶位置高于ZnTiO3導帶,其導帶上的光生電子能夠遷移至ZnTiO3導帶;同時,金紅石的價帶位置低于Zn-TiO3價帶,光生空穴遷移至ZnTiO3價帶,抑制了金紅石中光生電子與空穴的復合[5],有利于提高光催化效率,這與PL光譜分析結果一致。此外,XPS結果顯示TiO2/ZnTiO3(Zn/Ti=8%)表面羥基含量高于純TiO2,在光催化過程中可以生成更多的氫氧自由基,能有效地降解MB分子,因此TiO2/ZnTiO3(Zn/Ti=8%)的光催化性能最好。
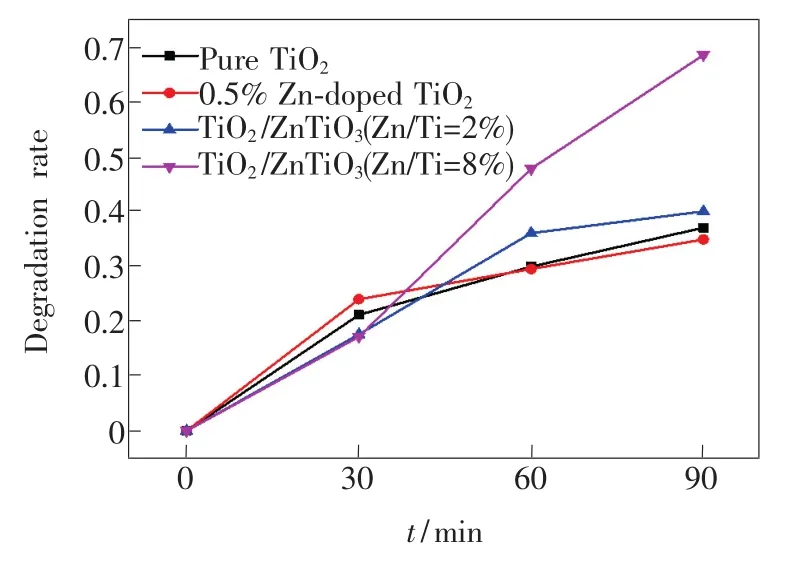
圖5 樣品對MB的降解曲線Fig.5 Photocatalytic degradation curves of MB for samples
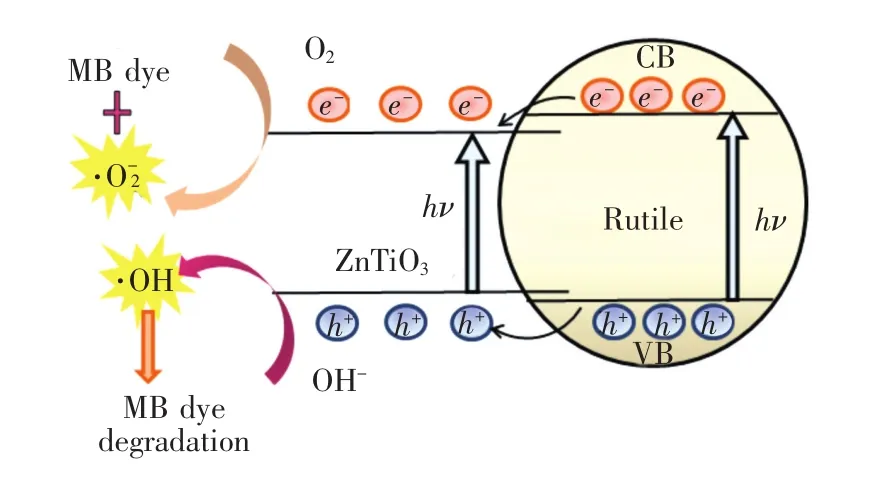
圖6 TiO2/ZnTiO3光生電子與空穴遷移示意圖Fig.6 Schematic diagram of TiO2/ZnTiO3photogenerated electrons and holes migration
光催化降解MB的一級動力學曲線如圖7所示,ln(Ct/C0)與反應時間t呈線性關系。反應速率常數(shù)k可用公式kt=-ln(Ct/C0)[4]計算得到(其中t為反應時間,Ct表示時間為t時MB的濃度,C0表示初始濃度)。在一定反應時間內(nèi),k越大,表明光降解反應速度越快,光催化活性越高。純TiO2、0.5%Zn 摻雜 TiO2、TiO2/ZnTiO3(Zn/Ti=2%)和TiO2/ZnTiO3(Zn/Ti=8%)的一級反應速率常數(shù)k分別為0.004,0.003,0.005,0.012 min-1,TiO2/ZnTiO3(Zn/Ti=8%)的k值大約為純TiO2的3倍,具有最快的反應速率,結果與降解率高低保持一致。
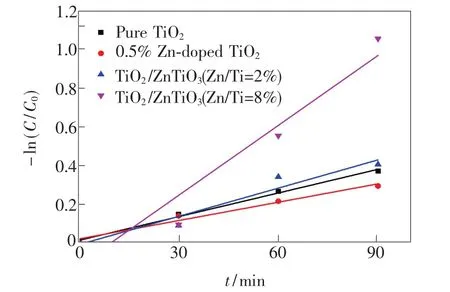
圖7 樣品降解MB的動力學曲線Fig.7 Degradation kinetics curves of MB over samples
4 結 論
采用溶膠-凝膠法制備了TiO2/ZnTiO3復合光催化劑,對其進行了晶體結構、表面形貌、元素組成與價態(tài)、光生電子空穴與復合等分析,以MB降解率評價其光催化性能,結論如下:(1)650℃熱處理后,TiO2為金紅石結構,Zn加入減小了TiO2的晶粒尺寸;Zn/Ti量比達到2%時,生成新相ZnTiO3,形成了金紅石TiO2/ZnTiO3半導體復合結構;(2)TiO2/ZnTiO3(Zn/Ti=8%)表面羥基含量高于純TiO2,形成的TiO2/ZnTiO3復合結構有利于加快光生電子與空穴的轉移;(3)TiO2/ZnTiO3(Zn/Ti=8%)的光催化性能最好,對MB的降解率是純TiO2的1.85倍,其一級反應速率常數(shù)是純TiO2的3倍。

