便攜式近紅外測定龍膽中水溶性浸出物及龍膽苦苷含量
吳曉燕,侯曉琳,宿 瑩,劉 戰,姜雨昕,孫 金,翁麗麗
長春中醫藥大學藥學院中藥鑒定教研室,長春 130117
龍膽為龍膽科植物條葉龍膽GentianamanshuricaKitag.、龍膽G.scabraBge.、三花龍膽G.trifloraPall.或堅龍膽G.rigescensFranch.的干燥根及根莖。龍膽為常用大宗藥材,龍膽中最主要的藥效成分為環烯醚萜苷類,包括龍膽苦苷、獐牙菜苦苷、獐牙菜苷、馬錢苷酸等[1],具有抗病毒、抗腫瘤、保肝利膽等多種生物活性,可用于膽囊炎、肝炎及高血壓等疾病的防治[2],療效顯著,也是常用中成藥的原料藥。龍膽在我國分布廣泛,藥用資源開發潛力巨大,具有非常重要的藥用價值。近年來,隨著研究的深入,對龍膽的需求也不斷擴大。利用現代的先進科技手段,能盡最大可能保障和控制龍膽的質量,從而篩選優良藥材資源,以更好地利用其價值。
在控制中藥質量的方法中,傳統的方法,如高效或超高效液相色譜法、氣相色譜法、紫外可見光分光光度法等都需要花費較多的時間用于提取、分離及進樣檢測[3]。而近紅外光譜分析技術具有分析速度快、對樣品破壞性小、無需繁瑣的預處理、綠色無化學污染等優點,將該技術與化學計量學方法結合可以實現對樣品的快速、無損、定性或定量分析[4-5],可以在現場進行質量評價,因此彌補了中藥材采收或收購現場質量把關的不足,節省了檢測時間,提高了工作效率。
現代研究表明龍膽的有效成分主要是龍膽苦苷,為水溶性成分,在傳統的凈制過程中會有大量有效成分流失等問題[6],故水溶性浸出物與龍膽苦苷含量均為控制龍膽藥材質量的重要指標。龍膽水溶性浸出物及龍膽苦苷含量的傳統測定方法結果準確,但在種植龍膽的山區存在檢測的儀器不方便、可操作性低等現象,在測定過程中也存在著操作繁瑣、工作量大、耗時長等問題[7],不能滿足大批量的現場快速分析要求,易受到環境制約。本研究采用NIR法分別對龍膽藥材水溶性浸出物含量及龍膽苦苷含量進行定量分析,以期利用近紅外分析方法的快速、便捷的優勢對龍膽藥材質量控制提供參考。實驗中用到的Micro PHAZIR Rx手持式近紅外光譜儀體積小、重量輕,便攜安全,無需制備樣品,可在幾秒鐘內執行快速的現場分析,在生產種植基地也具有極好的適用性。
1 儀器與試劑
Micro PHAZIR Rx手持式近紅外光譜儀(賽默飛世爾科技中國有限公司);島津高效液相色譜Prominence-ILC-2030(島津企業管理中國有限公司);HH-S2恒溫水浴鍋(600 W,50 Hz;上海越眾儀器設備有限公司);KDM型調溫電熱套(山東鄄城華魯電熱儀器有限公司);FA1004電子天平(d=0.000 01 g;上海佑科儀器儀表有限公司);KQ3200E超聲波清洗器(500 W,40 KHz;昆山市超聲儀器有限公司);Water Purifier實驗室專用超純水機(上海和泰儀器有限公司);DHG-9053A電熱鼓風干燥箱(上海一恒科學儀器有限公司)。
甲醇(色譜級,北京化工廠),水為超純水。
90批龍膽藥材均由吉林省北藥材加工有限公司提供,產地分別為吉林、遼寧、黑龍江,經長春中醫藥大學翁麗麗教授鑒定均為龍膽科植物龍膽的干燥根及根莖;龍膽苦苷對照品(規格:20 mg,純度,97.6 %;批號:110770-201515;購自中國食品檢定研究院)。
2 實驗方法
2.1 水溶性浸出物含量測定
照《中華人民共和國藥典》2015年版一部“浸出物測定法”項下“水溶性浸出物測定法”,對90批龍膽藥材進行測定[8]。
2.2 龍膽苦苷含量測定
照《中華人民共和國藥典》2015年版一部高效液相色譜法(通則0512),對90批龍膽藥材進行測定。
2.2.1 色譜條件
以十八烷基硅烷鍵合硅膠為填充劑,色譜柱型號:Agilent Eclipse XDB-C18(4.6×250 mm,5 μm);以甲醇-水(25∶75)為流動相;流速1.0 mL/min;柱溫25 ℃;進樣量10 μL;檢測波長為270 nm。理論板數按龍膽苦苷峰計算應不低于3 000。
2.2.2 對照品溶液制備
取龍膽苦苷對照品適量,精密稱定,加甲醇制成每1 mL含0.2 mg的溶液,即得對照品溶液。
2.2.3 供試品溶液制備
取龍膽藥材粉末(過四號篩)0.5 g,精密稱定,精密加入甲醇20 mL,稱定重量,加熱回流15 min,放冷,再稱定重量,用甲醇補足減失的重量,搖勻、濾過,濾液備用,精密量取續濾液2 mL,置10 mL量瓶中,加甲醇至刻度,搖勻,濾過,即得。
2.2.4 測定法
分別精密吸取對照品溶液、供試品溶液各10 μL注入超高效液相色譜儀,測定,用外標法計算含量,即得。
2.3 近紅外光譜采集
稱取約5 g龍膽藥材粉末(過四號篩),放入石英樣品杯中,均勻鋪平,采用積分球漫反射采集光譜,采集光譜波長范圍為1 600~2 400 nm,溫度為23~27 ℃,相對濕度為30%~40%;以空氣為參比扣除背景采集光譜圖,每批龍膽樣品重復掃描5次,計算平均光譜,樣品的近紅外光譜疊加圖見圖1。
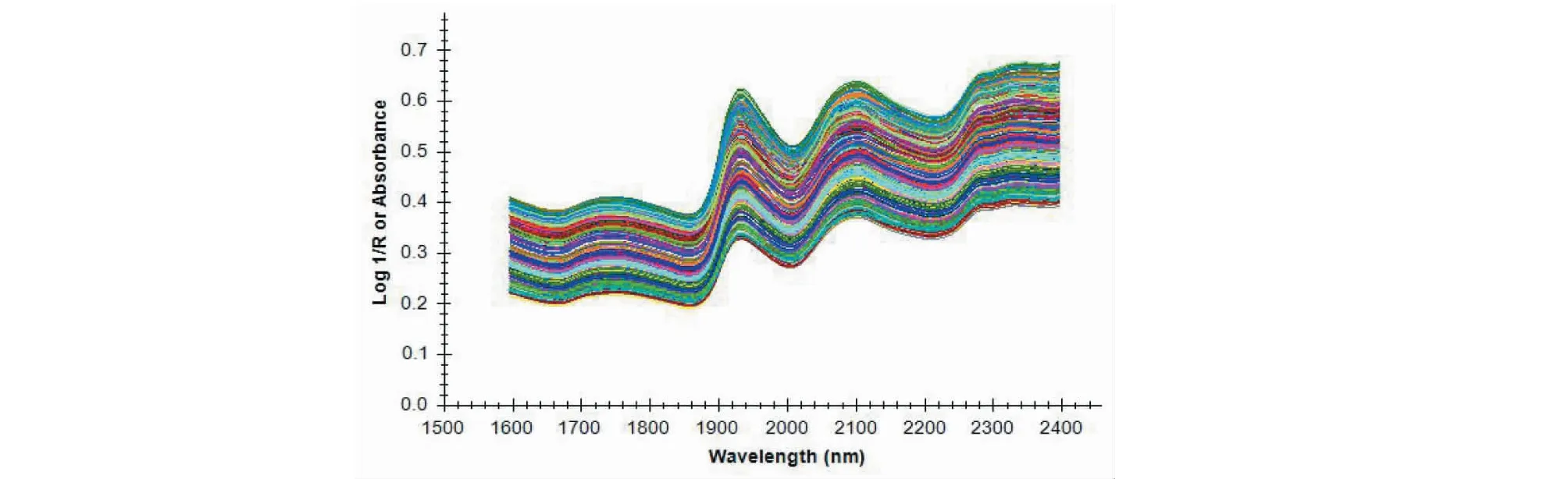
圖1 90批龍膽近紅外光譜疊加圖Fig.1 Near-infrared spectra superposition diagram of 90 batches of Gentianae Radix et Rhizoma samples
2.4 水溶性浸出物、龍膽苦苷含量近紅外定量分析模型的建立
采用主成分分析法(principal components analysis,PCA)對龍膽樣品光譜進行聚類分析,利用光譜文件掃描數據計算打分,統計樣品間差異情況,按馬氏距離大于3.0的樣本判定為異常,剩余樣本劃分成校正集和驗證集,保證驗證集樣品所測水溶性浸出物及龍膽苦苷含量的化學值含量范圍均不超過校正集,分別建立水溶性浸出物、龍膽苦苷含量的近紅外模型。
本實驗借助Method Generator(Version 4.0.0.0)分析軟件對光譜進行預處理,采用偏最小二乘法(PLS)建立模型,以校正集內部交叉驗證決定系數(R2)、校正均方差(RMSEC)、預測均方差(RMSEP)和主因子數為指標參數來評價模型預測的準確性和穩定性。
3 結果與討論
3.1 樣品集的劃分及化學值測定結果
經主成分分析法對龍膽樣品光譜進行聚類分析,90批樣品馬氏距離均小于3,判定無異常數據。從90批龍膽藥材樣品中隨機選擇70批作為校正集,剩余20批作為驗證集。保證驗證集樣品所測水溶性浸出物及龍膽苦苷含量的化學值含量范圍均不超過校正集,分別建立近紅外模型,校正集和驗證集水溶性浸出物、龍膽苦苷含量分布情況見表1。由表1可以看出,校正集、驗證集數據分散程度較高、代表性較強,驗證集樣本水溶性浸出物、龍膽苦苷的平均值、標準差與校正集也接近,說明驗證集設置較合理。
表1 樣品中水溶性浸出物與龍膽苦苷的含量
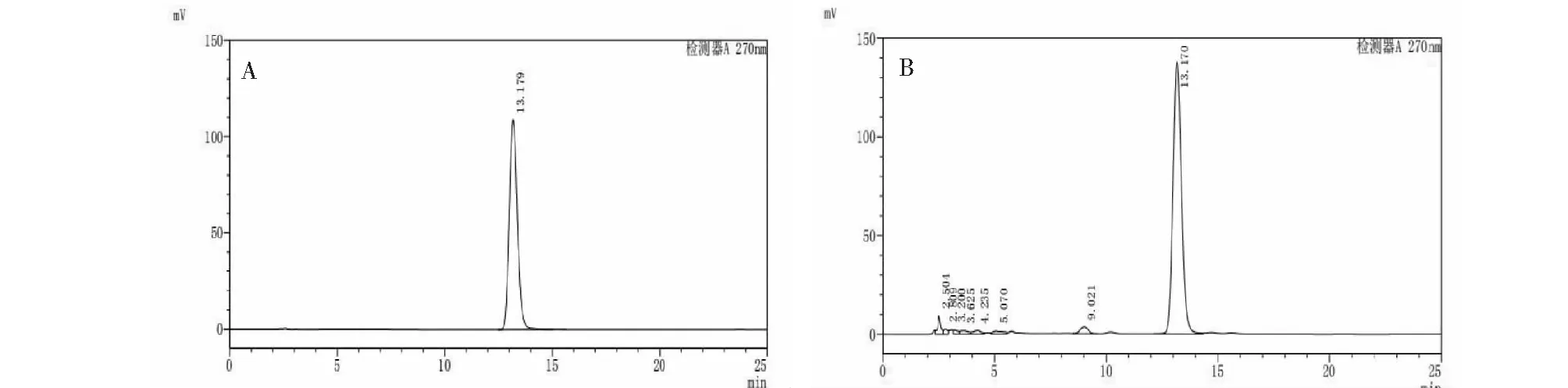
圖2 高效液相色譜圖Fig.2 High performance liquid chromatography注:A.龍膽苦苷對照品高效液相色譜圖;B.供試品高效液相色譜圖。Note:A.High performance liquid chromatography of gentiopicroside reference substance;B.High performance liquid chromatography of the tested product.
3.2 光譜預處理
在樣品的光譜采集過程中,由于環境的溫濕度、樣品顆粒均勻度及儀器自身等因素都會引起近紅外光譜的不穩定和基線的偏移[9],因此對近紅外光譜預處理是有必要的。常用的光譜預處理方法有未處理(NONE)、標準正態變量進行交換處理(SNV)、一階導數法(FD)、二階導數法(SD)、Normalize Range(NR)、Savitzky-Golay(SG)平滑等[10]。當RMSEC、RMSEP越小,表明模型的預測性能越好,當R2值越接近1時,表明所建立的模型預測值與樣品實測值的相關性越好[11]。采用軟件自帶的幾種不同的預處理方法對R2、RMSEC、RMSEP的影響結果見表2。
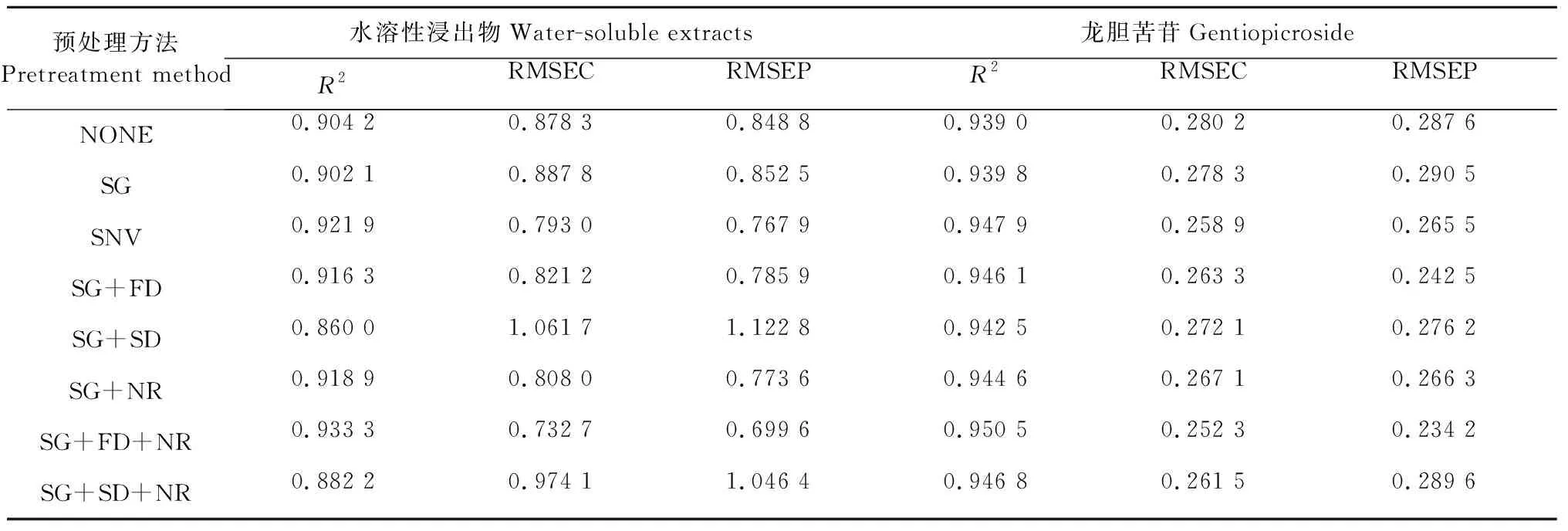
表2 不同預處理方法對近紅外模型R2、RMSEC、RMSEP的影響
通過比較不同預處理方法,確定龍膽水溶性浸出物近紅外模型及龍膽苦苷含量近紅外模型的光譜預處理方法均為SG+FD+NR。
3.3 主因子數選擇
采用PLS方法建立定量分析模型時,主因子數是優化模型的關鍵步驟,主因子數的選擇反映的是未知樣本被測組分產生的光譜變化,直接影響到模型實際預測能力[12]。一般情況下,RMSECV越小,所建立的模型預測精度越高。主成分數選取過大,容易引入不必要的信息,出現過擬合而帶進過多噪音;但若主成分數選取過小,則會引起模型預測性能欠擬合,原始光譜中有用信息缺失[13-15]。實驗中,水溶性浸出物模型RMSECV最小值為1.060 5,與之對應的主因子數為6,龍膽苦苷含量模型的RMSECV最小值為0.351 4,與之對應的最佳主因子數為8,所建模型擬合度均較好。
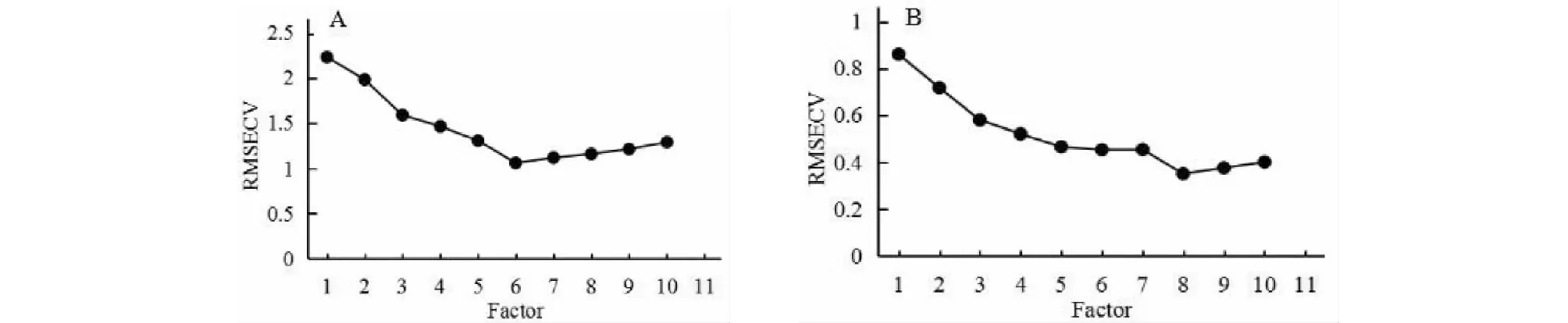
圖3 主因子數對RMSECV的影響Fig.3 Effect of main factors on RMSECV注:A.水溶性浸出物;B.龍膽苦苷。Note:A.Water-soluble extracts;B.Gentiopicroside.
3.4 定量模型的驗證
按照上述的實驗方法校正模型最優化參數,分別建立龍膽藥材水溶性浸出物含量及龍膽苦苷含量的PLS模型。待測定的20批樣品,按照“2.3”方法采集光譜,將光譜圖輸入校正模型中,結果見圖4。其中龍膽水溶性浸出物近紅外模型相關系數R2為0.933 3,校正均方差RMSEC為0.732 7,預測均方差RMSEP為0.690 6。龍膽苦苷含量近紅外模型相關系數R2為0.950 5,校正均方差RMSEC為0.252 3,預測均方差RMSEP為0.234 2。
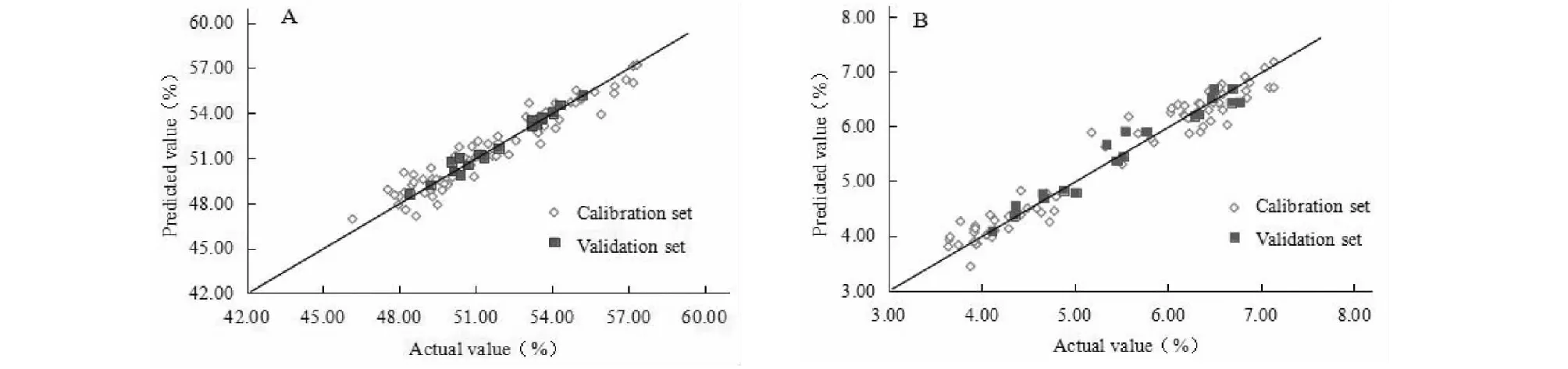
圖4 實測值和預測值相關圖Fig.4 Correlation diagram between measured values and predicted values注:A.水溶性浸出物;B.龍膽苦苷含量。Note:A.Water-soluble extracts;B.The content of gentiopicroside.
20批驗證集樣品參考值與模型預測值具體結果如表3、表4,經計算,水溶性浸出物、龍膽苦苷絕對偏差均在10%以內,平均相對偏差分別為0.06%、0.30%,模型預測性能良好。
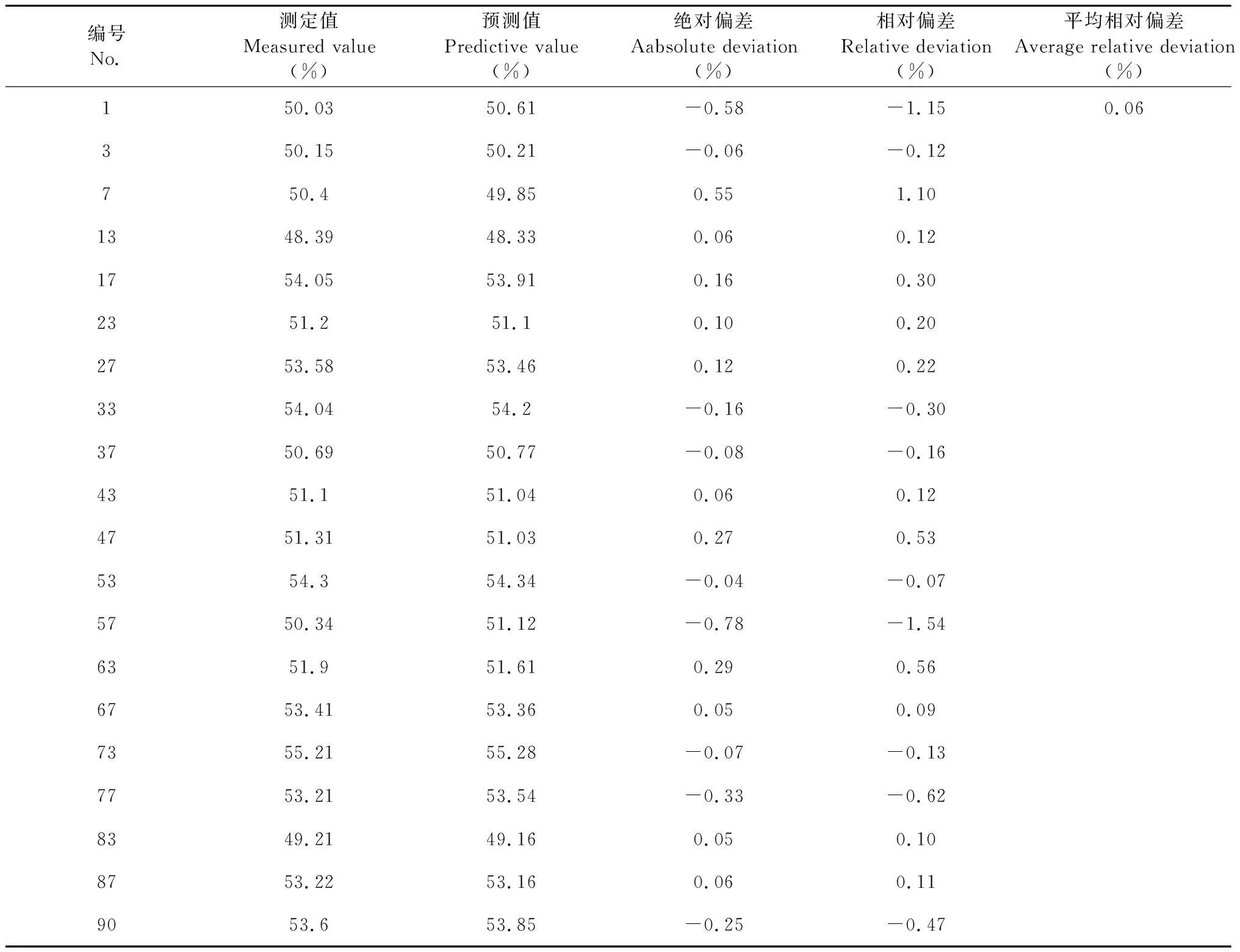
表3 驗證集樣品平均回收率(水溶性浸出物)
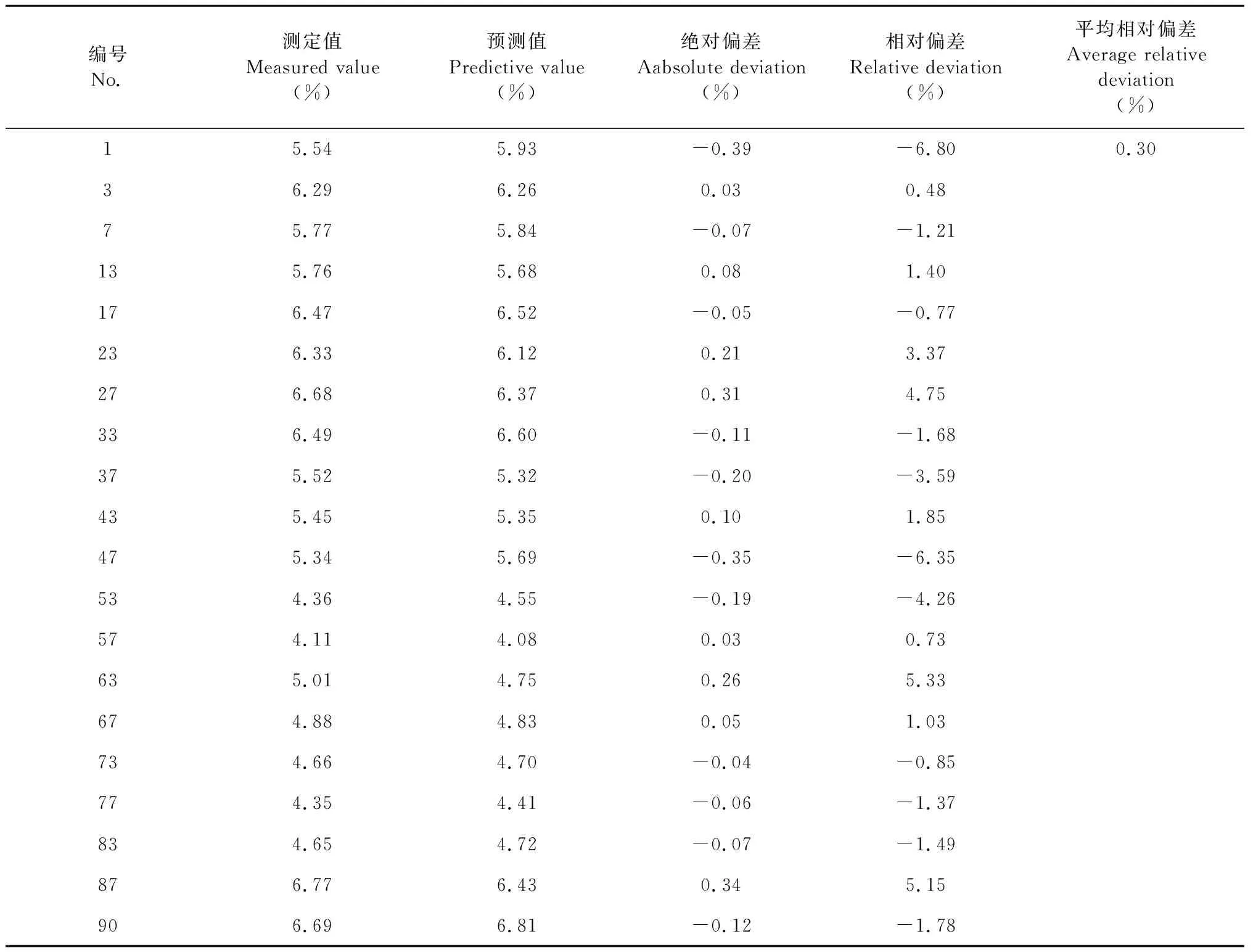
表4 驗證集樣品平均回收率(龍膽苦苷含量)
4 結論
本實驗根據《中華人民共和國藥典》2015年版一部標準,采用傳統熱浸法及高效液相色譜法與近紅外光譜法相結合的方式,建立了利用NIR快速測定龍膽藥材中水溶性浸出物及龍膽苦苷含量的模型,模型通過SNV、FD、SD、NR等方法的組合嘗試篩選出適合的預處理方法,并采用PLS方法分別對龍膽水溶性浸出物及龍膽苦苷含量建立定量分析模型。經驗證集樣品進行模型驗證,平均相對偏差分別為0.06%、0.30%,其結果均達到較好的水平,可見所建模型預測性較好,能夠滿足實際快檢應用中的需要。在實際工作中只需要掃描樣品的近紅外光譜圖,將其分別代入模型即可預測出龍膽水溶性浸出物及龍膽苦苷的含量。
與傳統的高效液相色譜法相比,近紅外光譜法具有操作過程方便快捷,無需預處理,一次測定僅需幾分鐘即可完成,并且結果較準確的特點,可廣泛應用于龍膽原藥材質量控制中的快速、批量檢測,在龍膽藥材的質量控制及在線監測等方面具有廣闊的應用前景,為采購藥材提供一種隨時檢測分析的便捷方法,同時也對種植、生產、使用單位快速了解龍膽質量也具有重要意義。
近紅外光譜技術能夠實現企業在生產過程中的快速檢測龍膽水溶性浸出物及龍膽苦苷含量,降低人工成本。但這種快捷、簡便、低成本的快速現場檢測方法,其準確度、精密度較傳統檢測方法而言會有所降低[16]。便攜式近紅外作為一種快速測定方法,其穩定性也一定程度上受外界因素制約。后期可以考慮通過不斷增加樣本量及樣品篩選,在保證模型的精確性的情況下,不斷提高模型的預測性、穩定性和適用性,推廣近紅外光譜技術在中藥材大規模生產過程中的作為一種快速檢測方法的應用。近年來,我國越來越重視近紅外分析儀器在中藥品質分析中的應用,相信未來手持式近紅外光譜儀也會不斷提高寬光譜范圍、高分辨率、高信噪比,朝著高性能、低成本的方向一直發展。

