基于證據的概念構建
徐守兵


關鍵詞:離子反應;離子方程式;概念
離子方程式作為一種重要的化學語言,其書寫規則早已形成了一種經典的模式,一般有“四步法”和“三步法”兩種書寫方法。相應地,教師們也常把教學設計的重心放在為如何將一種基礎化學語言(化學方程式或電離方程式)依據一定規則轉換成另一種高級化學語言(離子方程式)。這種教學方法的優點是可以使學生在短時間掌握一般離子方程式的書寫技能,不足是不少學生并不能真正理解離子反應的概念,學習過程中微粒觀等化學觀念提升也很少。如今,面向開展以“素養為本”的新課程教學,更多的教師認識到離子反應等概念教學必須超越知識和技能,涵蓋更有深度的、可遷移性的理解,它應該是師生通過實驗觀察獲取證據再結合邏輯推理“協同思考”中構建起來的。筆者發現,教學中多讓學生從宏觀實驗現象出發,再從微觀角度探析離子反應的過程,結合定量的證據推理,進而寫出富有動態反應過程的離子反應方程式,可以較好地落實化學教學中培養學生“宏觀辨識與微觀探析”“證據推理和模型認知”等關鍵學科能力的要求。
一、究竟是誰發生了反應
從宏觀視角寫出常見酸、堿、鹽之間發生反應的化學方程式并不困難,教師在教學中有意識地引領學生通過對宏觀現象的觀察,真切體驗微觀反應的過程,是從微觀視角寫出離子方程式的關鍵。教學可從一個個學生熟悉的實驗再觀察和深入討論逐漸展開。
實驗1:展示硫酸銅溶液、氯化鋇溶液,并將2mL0.1mol/L硫酸銅溶液和2mL 0.1mol/L氯化鋇溶液混合。
[教師]硫酸銅溶液中有哪些粒子?
[學生]硫酸根離子、銅離子、水分子。
[教師]溶液中銅離子分布均勻嗎?依據是什么?
[學生]均勻,整個溶液中藍色深淺一樣。
[教師]溶液中硫酸根離子分布均勻嗎?依據是什么?
[學生]也均勻,溶液處處顯電中性,帶正電荷的銅離子分布均勻,帶負電荷的硫酸根分布自然也是均勻的。
[教師]大家可以想象出氯化鋇溶液中自由移動的氯離子、鋇離子吧?
[學生]不難想象。
[教師]兩種溶液混合后發生化學反應了嗎?依據是什么?
[學生]發生反應了,因為觀察到有白色沉淀產生,它是新物質硫酸鋇。
[教師]反應前后銅離子存在狀態有無實質性變化?
[學生]反應后上層溶液仍顯藍色,與反應前相似,說明反應前后銅離子都是自由移動的,無實質性變化。
[教師]可以理解成銅離子并沒有真正參與化學反應嗎?
[學生]贊同。通過測量溶液的導電性進行間接表征。
[實驗]
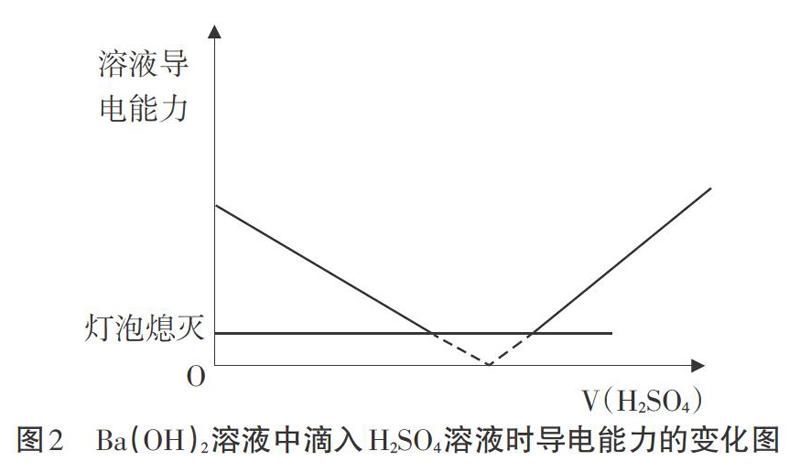
[實驗操作]如圖1,向燒杯中加入一定量的Ba(OH)2溶液,滴加幾滴酚酞試液,再向燒杯中逐滴滴加稀H2S04溶液,攪拌,觀察溶液中的現象和小燈泡亮度的變化。
[實驗現象]反應體系中出現白色沉淀,燈泡逐漸變暗直至完全熄滅,又過一段時間后酚酞褪色,再繼續滴加硫酸,再經一段時間后燈泡又逐漸亮起。
[實驗解釋]邊分析實驗,邊畫出示意圖(如圖2)
[投影]溶液導電能力變化示意圖
[創設問題情境]燈泡熄滅是否表征分散系不導電?
[學生]不一定,燈泡熄滅后一段時間,酚酞仍顯紅色,說明溶液中仍存在自由移動的OH-。此時導電性較弱,燈泡不亮了。
[教師]實驗現象能否較好幫我們判斷哪個離子方程式更合理?
[學生]可以想象補全燈炮熄滅到重新亮起這一段時間的導電性變化趨勢,但可能性并不唯一,所以并不能確定說明哪個更合理。
[學生]要是有更靈敏的檢測手段測量分散系的導電性,就更好說明了。
[教師]介紹一種更靈敏的檢測分散系中離子濃度的電導率儀。
[探究]如圖3,向燒杯中加入15mL約0.01mol/LBa(OH)2溶液,滴加幾滴酚酞試液。再向燒杯中逐滴滴加約0.1mol/L H2S04溶液,攪拌,觀察燒杯溶液中的現象和投影儀上溶液電導率的變化。
[實驗現象]溶液中出現白色沉淀,電導率逐漸減小,當溶液紅色完全褪去的瞬間,電導率恰好達到最小,繼續滴加硫酸,電導率又逐漸變大(如圖4)。
[分析]電導率達到最底點時酚酞恰好褪色毫無爭辯地說明體系中Ba2+s0}=BaS0、H++OH-=H20反應具有精確的化學計量關系,結合H2S04、Ba(OH)。電離產生離子之間的計量關系,應當是②Ba2+20H-+2H+S024-=BaS04 +2H20最合理。
本教學片斷中的兩個實驗均非教材實驗,圖1實驗是我校早年研制的導電性測定實驗,實驗中燈炮熄滅和酚酞褪色有一定的時問錯位,但結合基本的物理學知識和微觀想象,學生初步得出兩組離子反應之間的協同性。圖2實驗是筆者新近開發的數字化升級版實驗,實驗的創新點是使用了合適的數字化實驗手段,實驗的突破點是經過多次試驗找到了合適的試劑濃度,實驗的成功點是電導率的突變和酚酞褪色的時間恰好一致,實驗的可靠性是已經過我們的教學實踐檢驗,教學的效果是學生們看到溶液的電導率發生突變時酚酞恰好褪色都會發生一片歡呼。
三、離子反應的有序性
在真實的化學世界中,物質往往是不純凈的,反應的可能性往往也是多樣的,如變質的亞硫酸和氫氧化鈉的反應、變質的氫氧化鈉和硫酸的反應、氯化鈉和碘化鈉的混合液與硝酸銀的反應等,揭示這些復雜體系離子反應的多樣性和有序性,有助于離子反應系統化知識的建立,有助于理解自然界變化的復雜性和簡約性。以混合堿和鹽酸的反應為例進行教學分析。
問題情境是從一組對比實驗現象差異性的分析導入的,教師分別向碳酸氫鈉溶液和碳酸鈉溶液中滴加稀鹽酸,前者立即產生了大量的氣泡,后者剛開始無明顯現象,一段時間后開始產生氣泡。教師有意設計的差異性對比實驗自然激起學生的疑問,碳酸鈉溶液中滴加稀鹽酸,產生的氣泡自然是二氧化碳,問題是剛開始一段時間沒有氣泡產生發生了什么反應?在學生們討論問題的過程中,教師趁勢拋出一個問題,如何“看見”開始時溶液中的反應?聯系到碳酸鈉的俗名,學生們容易想到滴加酚酞試液給溶液染色。教師又分別向碳酸氫鈉溶液、碳酸鈉溶液中滴加了酚酞,然后做了類似的對比實驗,這次學生們觀察到向滴有酚酞的碳酸鈉溶液中滴加稀鹽酸時,剛開始滴加時溶液的紅色無明顯變化,溶液中也無明顯的氣泡,一段時間后溶液的顏色逐漸變淺,顏色和碳酸氫鈉中相似時開始明顯產生氣泡。宏觀實驗現象之間的聯系,使學生們在想象中“看見”碳酸鈉和稀鹽酸微觀反應的歷程:①CO2+H+=Hco3②HCO-+H+=H20+C02 ,再經過理性的思考,學生對CO2、HCO;與H+結合力的大小也不難判斷,實際上也正是CO2與H+更大的結合力,才使得反應開始后,溶液中雖然同時存在CO2-、HCO;,但H+還是主要和CO2一結合成HCO3。接下來,當教師提出向碳酸鈉和碳酸氫鈉的混合溶液中滴加稀鹽酸反應的有序性問題時,學生們稍加思考便能作出正確回應。
在隨后學習的氫氧化鈉和碳酸鈉混合液與鹽酸反應的過程中,學生們想再次利用酚酞扮演宏觀和微觀的橋梁角色,實驗的現象與向滴有酚酞的碳酸鈉溶液中滴加稀鹽酸是相似的,因此分析微觀離子反應的有序性是比較困難的。在教師的提議下,同學們在實驗過程中進一步引入了定量控制,向20mL含0.1mol/L NaOH溶液及0.1mol/L Na2C03溶液混合液的錐形瓶中滴加2~3滴酚酞,磁力攪拌器適當速率攪拌,用酸式滴定管滴加0.1mol/L HCl溶液,觀察到較長時間內溶液的紅色無明顯變化,也無氣泡產生,當溶液紅色幾乎褪去時,開始明顯產生氣泡,記錄此時消耗鹽酸的體積V1,繼續滴加鹽酸至溶液中無明顯氣泡產生時,記錄又消耗的鹽酸的體積V2,學生們發現V1顯著大于V2,其比值約等于2。上述實驗中定量手段的引入,有助于引導學生實驗觀察從感性認識走向理性探究,為學生想象微觀離子反應的歷程提供了進一步的實驗依據。V1>V2,一方面說明CO}得H+是分步進行的,同時也說明OH-得H+先于C02學生們經過討論最終達成共識,稀鹽酸和混合堿反應的過程應當分為3步,離子反應依次為①H+OH-=H20,②CO2+H+=HCO3,③Hc0+H+=H20+C02。
心理學上認為,概念是人腦對客觀事物本質的反映,概念是思維活動的結果和產物,同時又是思維活動借以進行的單元。可見,化學概念既是化學學科的基本要素,又是化學思維的基本單位,這就要求化學概念的學習和教學,不能只是聚焦于實驗事實和技能,更不能連實驗都不做或只是口頭描述,簡單地將化學概念教學處理成“一個定義,幾個注意點”,并認為可以通過大量習題的訓練而達成對化學概念的深刻理解。化學概念的教學要以形成學生的化學核心觀念為本,教學安排一般要從能夠為概念構建提供證據的實驗觀察開始,教師適時提出一些事實性問題引發學生的觀察和思考,討論中教師要有意識地將基于事實層面的思考與概念層面的思考有機結合起來,通過協同思考,促進學生獲得對概念的深層次的理解,從而能將思考遷移到其它陌生的新情境中去,整個教學中教師要多用引導式教學,多鼓勵學生獨立探索并構建意義。
使學生掌握精確的學科概念,是課堂教學成功與否的一個重要標志。

