熔鹽電脫氧法制備金屬及合金的研究進展
賈雷,嚴紅燕,李慧,劉暢,張帥
(華北理工大學冶金與能源學院 現代冶金技術教育部重點實驗室,河北 唐山 063009)
現階段,工業上制備純金屬及合金的方法主要有重熔法、金屬熱還原法、碳熱法和電解法[1]。重熔法用于金屬與合金的還原、熔化和精煉,俄羅斯、西歐等發達國家利用重熔法生產了氧含量小于0.1%的金屬與合金,該法的熔煉溫度在1700 ~2000℃,成本比金屬熱還原法高兩倍。金屬熱還原法[2]是1948年美國杜邦公司利用鎂熱還原法(Kroll法)取代鈉法了(Hunter法)生產出了噸級海綿鈦[3],實現工業化生產而進入大眾視野。目前該法廣泛用于生產金屬及合金如鈦鐵合金、鉿、鋯等一系列金屬。經過半個世紀的發展,該法仍然存在生產不連續,能耗大,產品質量不穩定,純度較低的問題。碳熱法是為解決金屬熱還原法能耗較大這一問題而提出并被應用的生產金屬與合金的新方法,該法生產的產品價格低廉但會形成碳化物,影響產品質量。電解法包含水溶液電解和熔鹽電解,這種方法流程短,污染小,常被用來生產超純金屬,是新時期下最具發展潛力的綠色冶金新工藝。
傳統熔鹽電解法發展歷程是在1807 年,英國化學家H.Davy 首次電解NaOH 制取得到金屬Na,隨后1886 年,美國的霍爾(C.M.Hall)和法國的埃魯(P.L.T.Hero)申請了NaAIF6-Al2O3熔鹽電解法制備金屬鋁的專利[4],這也是傳統熔鹽電解法制備提煉低熔點金屬的靈感思路來源,以高溫熔鹽為電解質電解相關金屬的鹵化物或氧化物,利用其產物密度的不同得以分離,得到低熔點金屬。
熔鹽電脫氧法是由生產低熔點的傳統熔鹽電解法發展而來用于生產高熔點金屬。最初在1997年,劍橋大學的三位冶金學家Derek J.Fray、Tom W.Farthing和George Zheng Chen試圖通過電解將鈦表面上的氧化膜消除掉,但是意外的發現這個過程可以直接將鈦氧化物脫氧制備成金屬鈦。在1998 年申請了利用熔鹽電脫氧法制備金屬鈦的專利[5],2000 年時在Nature 上報道了由二氧化鈦直接熔鹽電脫氧法制備了金屬鈦的FFC 劍橋法(Fray-Farthing-Chen Cambridge Process)[6],該法區別于傳統的在熔鹽陰極上沉積的方法,其能耗低、流程短、環境友好,是一種具有劃時代意義的綠色生產金屬及合金的新方法。
1 FFC 法電解原理
FFC 電脫氧法的關鍵是以經壓片燒結后的固態氧化物為陰極,以石墨 (或惰性材料) 為陽極,在低于金屬熔點及熔鹽分解壓的條件下進行電解。在陰極金屬氧化物被還原成金屬或者合金,而在陽極氧離子通過CaCl2熔鹽到達陽極放電,產生O2(惰性陽極)或者CO 及CO2氣體(石墨陽極)。
以電解三氧化二鉻制備單質鉻為例:將Cr2O3粉末經壓鑄,燒結后用耐高溫的金屬導體連接當作陰極,以石墨棒當作陽極,在650 ~ 950℃的CaCl2熔鹽體系中電解。
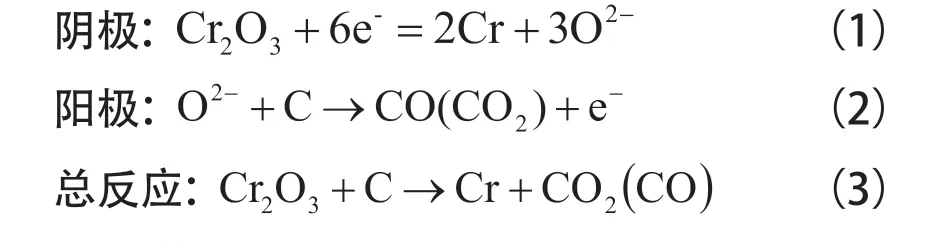
Chen[7]研究了陰極氧化物還原的動力學建立了金屬/固體氧化物/熔鹽三相反應界線模型,證實了還原過程是從導電性較差的氧化物的表層向內層的逐漸轉變還原為金屬的過程。同時Vishnu[8]在CaCl2熔鹽中制備金屬鈾時發現表層有88.3%的UO2還原為金屬鈾,而片體內部有96.3%的UO2未被還原,進一步佐證金屬/固體氧化物/熔鹽三相反應界線模型的合理性。
動力學模型已經建立但對于FFC 劍橋工藝的還原機理卻有氧離子化和鈣熱還原兩種意見相左的觀點。Frary 等[6]認為還原是固態氧化物中的氧在電場作用下直接離子化形成O2-,與陽極石墨碳反應生成氣體的直接電脫氧過程。為了說明這一問題,QIU 等[9]采用循環伏安法利用金屬孔洞電極研究了NiO 和Cr2O3的陰極電化學行為,NiO 和Cr2O3分別比鈣析出電位正0.8 V 和0.3 V,如果是鈣熱還原熔鹽中應存在大量的CaO,但只檢測到少量的氧從而證實了直接電脫氧機理的合理性。Wang等[10]在850℃的CaC12熔鹽中用FFC 法的電解稀土氧化物Tb4O7時,發現當設置電解電壓(3.6 V- 4.2 V)大于CaCl2的分解電壓3.2 V 時,由于產生大量的金屬鈣,阻礙了Ca2+的向氧化物內部擴散和O2-的向外擴散,最終影響了電解效率,反證了直接電脫氧的合理性。
而Chen 等[11]則認為由于金屬鈦溶解氧的電極電勢比鈣離子還原成鈣的電極電勢更正,更先發生反應,而鈣還會與低價鈦的氧化物反應生成鈦酸鹽,之后再進一步還原為金屬單質或合金,鈣的存在促進還原的進行。同時日本北海道大學Ryosuke Suzuki等[12-13]確定CaCl2易水解在熔鹽中存在CaO,而CaO 的理論分解壓為2.6 V(850℃),在熔鹽電脫氧時設置電解電壓為3.0 V,勢必產生金屬鈣,在高溫下會參與到氧化物的還原過程中。并依據此還原機理提出了鈣熱還原電解法(OS 法)[12],在CaCl2-CaO-Ca 體系中,電壓的設置在CaO和CaCl2之間,充分發揮鈣的還原作用還原金屬氧化物,實現了連續化生產。目前已成功制備TiCr2[14]金屬間化合物、Ni[15]、Ta[16]、Ti-29 Nb-13 Ta-4.6 Zr[17]、V-Ti[18]等合金。
此外也有關科學家認為直接電脫氧的同時存在鈣的還原作用,其還原過程是雙重作用下的結果。Dring 等[19]通過分析TiO2的電脫氧過程為TiO2→Ti3O5、Ti2O3、CaTiO3→TiO →Ti,在 此還原過程中的還原電位均比鈣的還原電位正0.5V以上,但同時TiO →Ti 還原電位與鈣的還原電位相當,故而在直接電脫氧過程中一定程度上會存在鈣的熱還原。Schwandt 等[20]控制不同的電解電壓檢測中間產物,發現了CaTiO3的存在,且通過長時間低電壓電解得到了金屬Ti,從而更進一步確認了Ca 析出電位前的TiO2的還原。同時劉美鳳[21-22]等也做了相似的試驗,通過確定不同電壓條件下的電解產物分析后發現在0.5 V ~ 1.5 V 的低于CaO 的分解電壓條件下陰極的還原機理是直接電脫氧,當施加的電壓高于CaO 的分解電壓為2.5 ~ 3.1 V 時陰極還原是直接電脫氧和鈣的還原共同作用的。
通過以上分析說明FFC 法的陰極還原機理是由直接電脫氧和鈣的還原共同作用下的,符合金屬/固體氧化物/溶鹽三相反應界線動力學模型的還原過程。其中在熔鹽中加入少量的CaO 或金屬鈣有利于還原的進行,但如果熔鹽中存在過量的鈣會引起短路和CO2還原等副反應,產生碳化物,影響連續生產和產品質量。
2 陰極的制備
陰極是電脫氧成功的關鍵,而球磨、壓制和燒結的工藝的不同又會影響陰極的粒度組成、孔隙率和導電性。通常為保障一定的孔隙率和機械強度會把球磨粒度控制在微米級,把壓制力度控制在10 ~ 15 MPa 之間。隨燒結溫度的升高則會使晶粒增大,機械強度提高,孔隙率降低,發生晶型轉變,當晶型發生變化就會產生氧空穴,材料導電性就會得以加強。同時也有人研究在陰極中摻雜適量的造孔物質,會提高孔隙率、氧離子的擴散速度及導電性。
龔衛星[23]在制備鎳鎢合金時,稱取磨細后的質量比Ni2O3:WO3=4:5 的粉末,在15 MPa 壓力下壓制成h=2 ~ 4 mm,Φ=10 mm、m=2.5 g的圓狀片,在800℃電爐中燒結2 h,冷卻后在用Φ=2 mm 的銅絲穿過在陰極燒結片中央鉆好的圓孔制成了陰極。其燒結過程中發生Ni2O3→NiO,WO3+NiO →WO3NiO →NiWO4等一系列反應。朱靖[24]以ZrO2和Cr2O3為原料,按n( Zr): n( Cr)=1:2 混合,加入1. 5%的PVB,在6 MPa 下壓制成型,在900 ℃燒結2 h,在3.1 V 電壓下,900 ℃的CaCl2熔鹽中電解15 h,Cr2O3首先還原為單質Cr,然后ZrO2或CaZrO3在單質Cr 表面還原,形成放電容量為268. 75 mA·h /g的ZrCr2合金。胡玲[25]在制備鈦鎢合金時,以蒸餾水為粘連劑、15MPa壓力并保壓30 s和選取900℃時管式電阻爐的中溫區燒結,在900℃的CaCl2熔鹽體系電解,著重分析了分解電壓相差大小對電解的影響,發現WO3優先于TiO2完成還原。郭春芳[26]在原料中添加4%石墨粉制備了ZrO2-Ni2O3燒結片,發現石墨碳粉的加入可以提高燒結片的孔隙率,形成尺寸均勻的顆粒,在電解過程中促進氧空位和電子產生使電脫氧速率提高。李晴宇[27]采用熔鹽電脫氧法制備鋯時,在ZrO2中摻雜了CaCO3,提高了陰極的電化學反應活性,進而提高了ZrO2電解脫氧的速度。同樣杜繼紅[28]在TiO2陰極中摻雜不同百分含量的CaCO3粉末制備金屬Ti,得出了相同的結論。Li W 等[29]進一步采用NH4HCO3造孔劑來提高片體孔隙率。Centeno 等[30]采用三種不同造孔劑石墨、聚乙烯和聚苯乙稀,來制備具有不同孔隙結構的TiO2片體。TNohira 等[31]通過向SiO2片體中摻雜Si 提高片體導電性,增加了電解過程中金屬/固體氧化物/溶鹽三相反應界線接觸面積,提高了反應速度。王中磊[32]以摻入5%聚乙烯醇為粘結劑于15 MPa 壓力下制成Ф8 mm 的圓片狀體,在1200℃燒結8 h 后的Dy2O3試樣為陰極,在3.1 V電壓下電解8 h 得到脫氧率達98.24%的金屬鏑。
3 電脫氧法制備金屬及合金的研究進展
3.1 金屬單質
自從FFC 劍橋工藝在Nature 上發表以后,國內外的研究者利用此方法制備金屬單質Cr、Si、Co、Ce 及合金進行了許多的嘗試。
在難熔金屬方面,對鈦的研究最早也最為成熟。Schwandt 等[33]通過研究TiO2電解不同時間產 物 發 現 經TiO2→Ti3O5和CaTiO3→Ti2O3和CaTiO3→CaTi2O4→Ti 過程進行,經24 h 后得到節支狀金屬鈦。Vishnu[34]在相同的條件下則主要研究了燒結溫度和氧化物顆粒尺寸對制備鈦的影響。劉政偉[35]等在CaCl2-NaCl 和CaCl2熔鹽中得到純度分別為95.78%和99.18%的金屬鉻及鉻鎳合金,并創新性的提出用CaCr2O4為原料電解效率會更高。Gordo 等[36]在 CaCl2熔鹽中確定了電解還原的較佳參數,電池電壓2.7 ~ 2.8 V,熔鹽溫度850 ~ 950℃,電解時間4 ~ 6 h 制備了不同形貌的金屬鉻。趙炳建等[37]將900℃燒結的Cr2O3試樣在820℃的CaCl2熔鹽中,2.8 V 電壓下電解12 h 后得到金屬Cr。Wang 等[38]報道了在K2CO3-Na2CO3 熔鹽中進行Fe2O3電脫氧試驗,采用Fe2O3陰極,NiCuFe 惰性陽極,在750℃條件下成功實現Fe2O3陰極電脫氧制得金屬Fe,陽極放電產生O2。其產品碳含量與所施加電壓密切相關,當施加電勢負于-2.10 V(參比電極Ag/Ag2SO4)或施加電壓高于2.30 V 時,由于在陰極還原為碳,導致碳含量增加明顯,較佳電解條件下,碳含量維持在0.1%左右。
在稀土金屬方面,Wang 等[39]首次報道用FFC 方法直接電化學還原重稀土氧化物Tb2O7制備得到重稀土金屬Tb,從而使該方法的應用進一步得到拓寬。Pyonghun[40]在CaCl2熔鹽中一步電解Dy2O3得到了金屬Dy,沒有檢測到中間產物的生成,并發現在低電壓范圍內控制環節是電荷轉移,高電壓時還原過程則由擴散控制。B Claux[41]在CaCl2-KCl 熔鹽中以CeO 為原料用FFC 法制備了輕稀土Ce。
在半導體材料方面Emre[42]首次研究了在CaCl2-NaCl 熔鹽中溫度從750℃升高到850℃,粒度從小于64 μm 降低到小于38 μm 對多孔SiO2粒料的影響,在電解16 h 后實現多孔SiO2粒料的完全還原,并發現添加NaCl 降低了還原速率。
在張慶軍[43]在850℃的CaCl2熔鹽中,以燒結后的Co3O4片體為陰極,高密度石墨碳棒為陽極,經850℃燒結的氧化物試樣,在3.1 V 工作電壓下電解12 h,可制備出海綿狀純相的金屬Co。L Rong 等[44]在1023 K 的混合CaCl2-NaCl 熔體中研究了固體GeO2的電化學還原,發現在2.5 V 的電池電壓下實現了GeO2到純鍺的快速電解,電流效率為約92%。EY Choi 等[45]在熔融的LiCl-Li2O 電解質中研究了不同密度(55%,60%,70%和80%)的多孔顆粒UO2電化學還原,得到了較低密度和較小尺寸的UO2擁有更快的還原速率的結論。
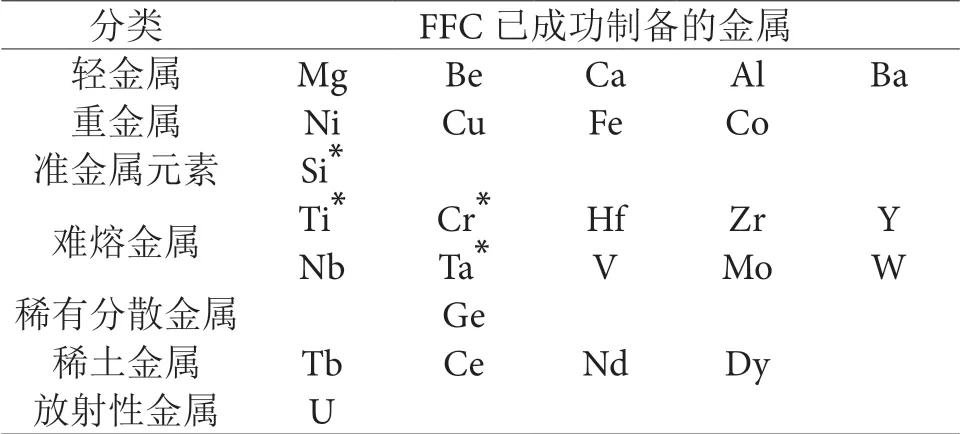
表 1 FFC 法已成功制備的金屬Table 1 Metals successfully prepared by the FFc method
就不同氧化物其電解所需時間亦不同比如Dy2O3完全電解需要50 h,TiO2需要24 h 甚至更長時間才可電解完全,Nb2O5需要12 ~ 20 h 才可電解完全,而WO3只需5 h 即可電解完全,而在高溫下NiO、Fe2O3導電性良好,更容易還原。同時也有研究表明[46]混合電解制備合金時,可以大大縮短電解時間,提高電解效率。
3.2 合金
3.2.1 鈦基合金
劉美鳳[47]在槽電壓為2.8 V,溫度為900℃的熔融CaCl2體系中,分別以TiO2和Cr2O3的混合物為陰極,石墨為陽極,電解6 h,得到了氧含量為0.20%的TiCr2的合金。況文浩[48]利用FFC 法在900℃,2.6 ~ 3.2 V 槽電壓的條件下,于CaCl2熔鹽中電解還原高鈦渣/SiO2復合陰極,經8h 后成功制備出了疏松多孔、粒徑為2 ~ 5 μm 的Ti5Si3合金粉末。
3.2.2 鐵基合金
周忠仁[49]首次采用電沉積鈣-鈣還原法研究了FeTiO3的間接電解還原過程和反應機理,FeTiO3被鈣還原為Fe 和CaTiO3,進而CaTiO3被鈣還原與鐵反應生成Fe2Ti、FeTi 合金,電壓高于3 V,燒結階段加25%NH4HCO3,在973 K,電解14 h 得到鐵鈦儲氫合金。艾剛華[50]在槽電壓為3.2 V、溫度為900℃的CaCl2熔鹽電解質中,摻雜用于降低中間產物的SiO2混同鈦鐵礦精礦制成陰極,控制摩爾比Ti:Fe:Si=1.2:1:0.2,石墨為陽極,電解2 h 得到疏松多孔、顆粒尺寸較均勻的FeTi 合金粉體。QIU G H 等[51]以Tb4O7和Fe2O3為原料直接合成了TbFe2儲氫合金。還原的先后順序依次為Tb4O7,Fe2O3和Tb2O3。當電解電壓為2.6~3.1 V 時Fe2O3→Fe,而后Tb2O3與Fe 反應生成TbFe2。PANIGRAHI M 等[52]以FeTiO3/TiO2混合物為原料,在950℃的CaCl2熔鹽、3 V 電壓下直接制備出FeTi 儲氫合金。CC Qi[53]分別在LiCl-KCl 和LiCl-KCl-CaCl2熔鹽中,在1073 K,3.2 V電化學條件下從鈦鐵礦中還原制備了鐵鈦合金,并發現CaCl2促進FeTiO 的還原。
3.2.3 金屬間化合物
ZHAO B J[54]在820℃的CaCl2/NaCl 混合熔鹽中,以燒結NiO-CeO2片為陰極,高純石墨棒為陽極,制備出純相的CeNi5,并獲得了較滿意的儲氫性能。DAI L[55]以Co3O4 和CeO2的混合物為原料于850℃燒結后在CaCl2熔鹽中、3.1 V 電壓下電脫氧生成容量達183 mA·h/g,140 次循環后容量保持率為92.8%的CeCo5儲氫合金,還原過程:1.Co3O4→Co,2.CeO2→CeOCl →CeCo5合金。該課題組[56]又以MnO2和ZrO2混合物為原料在900℃的CaCl2熔鹽中直接合成了純相具有儲氫性能的ZrMn2合金。還原過程:1、MnO2→Mn,2、ZrO2→CaZrO3→ZrMn2合金。LiuXuYang[57]通過試驗和模擬研究了CaTiO3在鈦鐵礦精礦電脫氧制備Fe-Ti 合金過程中的形成行為,并在燒結試樣中摻加CaCO3 以提高電流效率。熊禮以[58]鈦鐵礦為原料在等摩爾的CaCl2-NaCl 熔鹽和純CaCl2熔鹽中中進行電解還原,發現摻入1%的CaO,在純CaCl2熔鹽中,在3.2 V 電解電壓下,經800℃燒結和電解所得電解效率和產品質量最好,得到TiFe儲氫合金。ANIK M 等[59]以La2O3和NiO 為原料在850℃的CaCl2熔鹽中電脫氧制得放電容量達207 mA·h /g,合金容量保持率高于90%的La2Ni7儲氫合金。Glowacki 等[60]以Nb2O5-SnO2為原料利用新型電脫氧的方法制造了低溫超導Nb3Sn 材料,并討論了從Nb2O5-SnO2混合物的形成Nb3Sn的過程。魏岳山[61]以CaCl2為電解質體系,利用FFC 法制備了釔鋁中間合金。薛向欣等[62]發明專利將氧化物混料、壓片、燒結后作為陰極,高純石墨棒作為陽極,在惰性氣體保護下,置入盛有熔融電解質的反應器中進行電解,電解產物清除表面熔鹽,得到V-4Cr-4Ti 合金。張慶軍[63]以La2O3、CeO2、NiO 混合物為原料壓片,燒結后作為陰極,在工作電壓為3.1 V、850℃的CaCl2熔鹽中電解12 h,得到了海綿狀La0.5Ce0.5Ni5三元儲氫合金。還原過程:1、NiO →Ni2、La2O3和CeO2與CaCl2反應生成LaOCl、CeOCl 在Ni 表面形成La0.5Ce0.5Ni5合金。
3.2.4 金屬與非金屬化合物
張臻[64]以高鈦渣和石墨粉混合物料為陰極,石墨棒為陽極在CaCl2-NaCl 熔鹽中加入1%CaO、電解溫度為900℃、槽電壓3.2 V,電解時間為6 h后得到平均值約為50 nm 的TiC/SiC 復合粉體。陳孔豪[65]在700℃的CaCl2-NaCl 熔鹽中,3.2 V 電壓下,以石墨為陽極,分別以TiO2/C 和CaTiO3/C 為陰極,制得了TiC 合金。
4 FFC 商業化面臨的問題
FFC 商業化的發展道路由來已久,從1998 年British Titanium Corporation B Ti 公司的成立開始千克級規模試驗到2003 年澳大利亞的BHPBpition 公司開發的類似于FFC 法和OS 法的Polar 法生產出公斤級鈦,再到2006 年Metalysis 公司結合FFC 和Polar 法從開始研發到目前已成功擴大到年產10 t取得成功。但現如今FFC 法的發展還有一些問題需要解決:(1)用于生產大規模金屬的陰極難以制備。(2)為保障其熔鹽,槽內氣氛,溫度的穩定性的電解槽難以設計。(3)陽極石墨腐蝕嚴重(4)電脫氧速率慢,電流效率低。(5)快速處理電解槽中陰極產物,以實現連續化生產。
5 總 結
FFC 電脫氧法具有能耗低、流程短、環境友好的特點,是一種具有極大潛力的劃時代意義的綠色生產金屬及合金的新方法。其還原過程是由直接電脫氧和鈣的還原共同作用下的結果,符合金屬/固體氧化物/溶鹽三相反應界線動力學模型,在陰極試樣中增加孔隙度和導電性有利于電解的進行。現如今利用該方法生產金屬鈦、鉻、硅已經實現工業化生產的規模,而生產如Co、Hf、Zr、Dy 等金屬已經在實驗室取得成功,雖目前想要實現工業化生產還有許多問題需要解決,但是隨著技術的不斷進步,熔鹽電脫氧法在材料制備領域取得成功。

