不同途徑感染后5 型腺病毒在C57BL/6J 小鼠體內的分布
陳偉盛,高亞奇,梁 寧,陳海宇,陳興致,詹純列,張修彥(中國人民解放軍南部戰區總醫院,廣州 510010)
腺病毒(adenovirus,Ad)作為基因表達載體的研究始于1960年代[1],主要研究Ad 載體引入外源基因的可行性和安全性[2-5]。Ad 載體轉導基因有很多優點[6]:①宿主范圍廣,既可以感染分裂期細胞,也可以感染非分裂期細胞[7-8];②安全性好,Ad 無需整合進宿主細胞基因組,整合突變致癌率低,基因毒性小;③相對穩定,病毒基因組重排頻率低;④容量大,理論上最大容量可達35 kb;⑤相對容易制備,滴度高。Ad載體是目前基因治療最為常用的病毒載體之一。本文旨在研究滴鼻、灌胃、尾靜脈注射及腹腔注射5 型腺病毒(Ad5)后,病毒在C57BL/6J 小鼠體內的分布情況,從而為Ad 載體作為基因治療的小鼠研究提供基礎數據。
1 材料與方法
1.1 實驗動物
SPF 級C57BL/6J 小鼠112 只,雌雄各半,6~8 周齡,體質量16~20 g,購自廣東省醫學實驗動物中心[SCXK(粵)2018-0002],飼養于南部戰區總醫院動物實驗中心[SYXK(粵)2019-0100],實驗程序符合南部戰區總醫院實驗動物倫理委員會要求(20180051812),并遵守國際慣例。
1.2 主要試劑和儀器
TRIzol(9109)購自日本Ta KaR a 公司;BestarTMqPCR RT kit(2220)、BestarTMqPCR MasterMix(2043)均購自德國DBI 公司;DEPC(6079)購自上海Macklin 公司;Ad 購自深圳市百恩維生物科技有限公司;反轉錄試劑盒購自德國DBI 公司;Phanta?Max Super-Fidelity DNA Polymerase、2×Phanta Master Mix 均購自諾唯贊生物科技有限公司;DNAzol Reagent 購自美國Invitrogen 公司;Stratagene Real time PCR(Mx3000P)儀購自美國Agilent 公司;PCR 擴增儀器(K960)購自杭州晶格科學儀器有限公司;超微量紫外分析儀(Q6000UV)購自美國Quawell Technology 公司;高速離心機(TGL-16G)和低速離心機(TDL-80-2B)均購自上海安亭科學儀器廠。
1.3 標準曲線
使用DNAzol Reagent 提取病毒DNA,取1×109pfu/mL 的Ad5 溶液125 μL,加入含有250 μL DNAzol 的離心管中,上下顛倒混勻,室溫放置5 min,加入100 μL 異丙醇,置于旋渦混合器上充分混勻,室溫放置5 min。6000r/min 離心5 min,棄上清,加入500 μL 75%乙醇溶液后,再6000 r/min 離心5 min,棄上清,加入8 mmol/L NaOH 溶液20 μL 溶解。提取的病毒DNA 的吸光度(A)比值A260/A280為1.86,質量濃度為1.33 μg/μL。將DNA 原液5 μL 加45 μL 雙蒸水稀釋10 倍,以此類推稀釋102、103、104、105、106和107倍,最后用稀釋液作為模板進行qPCR 檢測,繪制標準曲線。
1.4 動物處理及定量聚合酶鏈反應(qPCR)檢測
112 只小鼠分為滴鼻組、灌胃組、尾靜脈注射組和腹腔注射組,每組28 只,雌雄各半。每只小鼠Ad 用量100 μL(1×109pfu/mL)。于4 種途徑感染后1 d、2 d、3 d、4 d、5 d、6 d 和7 d分別取4 組中雌雄各2 只小鼠,脫頸椎處死,解剖取淋巴結、睪丸、附睪、子宮、卵巢、脾臟、腎臟、肝臟、肺、心臟、腦、血液和骨髓組織,提取RNA。以2 μg RNA 為模板,按照Bestar qPCR RT Kit 說明書配制反轉錄反應體系,總體系為10 μL,反轉錄成cDNA。以cDNA 為模板,配制qPCR 體系。Ad5 上游引物為5'- AGGTGCTTGCCACCTATCAC-3',下游引物為5'-TTTTGGCACTTCGTTGAGCG-3'。內參β-actin 上游引物為5'- CATTGCTGACAGGATGCAGA-3’,下游引物為5'-CTGCTGGAAGGTGGACAGTGA-3'。
在PCR 反應管中充分混勻,置入Agilent Stratagene 熒光定量PCR 儀Mx3000P 進行熒光定量PCR 實驗。反應條件為:95 ℃ 2 min,94 ℃20 s,58 ℃ 20 s,72 ℃ 20 s,40 循環。每個樣本檢測重復3次。
2 結果
2.1 標準曲線
構建標準品的擴增曲線和標準曲線如圖1A和圖1B。從圖1A中可以看出10 倍梯度稀釋后的標準品質粒有良好的特異性擴增。圖1B所得到的標準曲線方程為y=-3.3877x+ 27.204,相關系數R2為0.9999,標準品起始反應模板濃度與Ct 值呈良好的線性關系。
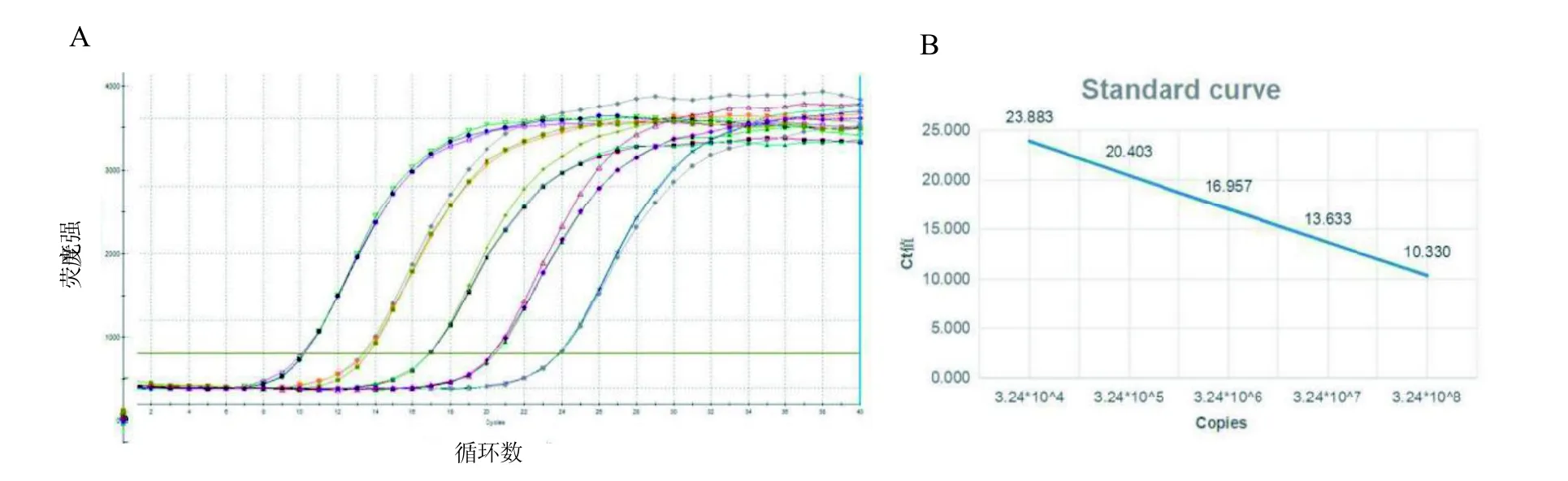
圖1 標準品的擴增曲線(A)和標準曲線(B)Figure 1 Amplication curve (A) and standard curve (B) of standard samples
2.2 Ad5 在各組織中的分布
滴鼻組在肺和脊髓中檢測出Ad5,肺組織中Ad5 含量隨著時間降低,處理后7 d肺組織中Ad5含量比處理后1 d 下降91.9%,4 d 比3 d 下降29.6%;脊髓組織在處理后1~3 d,Ad5 含量隨時間增加,之后開始下降,7 d 比1 d 下降26.1%。
尾靜脈注射組在肝臟和脾中檢測出Ad5,肝臟和脾臟中Ad5 含量隨時間逐漸下降。7 d 肝臟Ad5 含量比1 d 下降23.4%;脾臟含量7 d 比1 d下降93.9%,其中5 d 比4 d 下降43.8%,下降最快。
腹腔注射組在脊髓、脾臟、附睪和睪丸中檢測出Ad5,脊髓Ad5 含量在感染后2 d 最高,7 d 比1 d 含量下降39.3%;脾臟和附睪中Ad5 的含量隨時間逐漸下降,脾臟Ad5 含量7 d 比1 d下降94.2%,附睪含量7 d 比1 d 下降54.3%;睪丸中Ad5 含量有波動,可能是因為Ad5 含量太少,實驗誤差造成,其總體呈下降趨勢,7 d 比1 d 含量下降64.7%。
灌胃組小鼠各器官和組織中均未檢出Ad5。
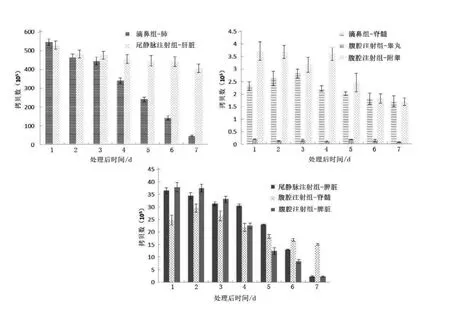
圖2 檢測到Ad5 的小鼠組織Figure 2 Tissues of different groups with detectable adenovirus type 5
3 討論
Ad 廣泛應用于腫瘤、心血管等領域的基因傳遞、再生醫學以及疫苗載體[9-13]。在許多臨床試驗中,Ad 都被證明是安全的載體[14]。研究不同途徑感染后Ad5 在體內主要臟器的生物分布,可為基因治療、疫苗載體的小鼠實驗研究中給藥途徑選擇提供可靠的實驗數據。
本實驗結果顯示,滴鼻組小鼠在肺組織和脊髓中,可以檢測到Ad。本課題組曾將Cre Ad 滴入B6.129S4-Krastm4Tyj/J 轉基因小鼠鼻內,誘導其表達突變Kras基因,從而獲得肺癌模型[15]。根據本實驗結果,滴鼻感染后4 d Ad 下降比較多,可將每7 d 滴鼻一次優化為每3 d 滴鼻一次。
本實驗結果還顯示,灌胃組在所有組織中均沒有檢測到Ad5,這可能與消化系統對Ad5 的滅活有關。
本研究中,尾靜脈注射組在肝臟和脾臟中檢測到Ad5。王鳴等[16]通過尾靜脈注射Ad 后7d 在肝臟基本檢測不到Ad,而Ohashi 等[17]給β-葡萄糖醛酸酶缺陷小鼠靜脈注射表達人β-葡萄糖醛酸酶的重組Ad,肝臟、脾臟中酶的表達至少持續到35 d。本研究結果表明,肝臟中Ad 下降速度較慢,可每7 d 重復注射一次。苗玉發等[18]給C57BL/6小鼠肌肉注射治療性HIV 的Ad 載體疫苗,發現病毒載體在脾臟、骨髓有較少分布,性腺中沒有檢測到病毒載體。
本實驗結果顯示,腹腔注射Ad5 后,附睪和睪丸中有病毒載體,子宮和卵巢中未發現Ad5,附睪和睪丸中Ad5 含量只有其他陽性組織中檢測出含量的1%~10%,脊髓中Ad5的含量比滴鼻組約高10 倍。
綜上,肺部感染實驗,可每3d 滴鼻一次;肝臟感染實驗,可以用尾靜脈注射Ad5 的方法;脾臟感染實驗,可以采用尾靜脈注射或腹腔注射Ad5 的方法;脊髓感染實驗,可以采用腹腔注射Ad5 的方法。

