慢性不可預知性溫和應激致抑郁樣大鼠模型的研究進展
趙 謙, 王安娜, 高雪松, 李 麗, 趙靜潔
(1. 首都醫科大學附屬北京友誼醫院中醫科,北京 100050;2. 北京市隆福醫院康復醫學科北苑院區,北京 100010)
抑郁癥(depression)是一種伴隨行為學改變、神經系統改變和其他生理病理變化的心身障礙性疾病,其發病機制復雜,癥狀表現多樣,嚴重影響患者的生存質量和社會功能。世界衛生組織報告指出,到2030年,抑郁癥將成為最大的健康挑戰[1]。對抑郁癥病理機制的研究和療效確切的藥物研發迫在眉睫。建立人類疾病動物模型對于認識疾病的發生、發展規律及防治措施意義深遠,是現代醫學研究的重要方式。在模擬抑郁癥的動物模型研究中,有藥物、手術及基因敲除等多種不同的方式,而慢性不可預知性溫和應激(chronic unpredictable mild stress,CUMS)模型是近年來廣受關注的一種抑郁癥研究模型,其疾病發生和表現形式更符合人類的發病原因,可模擬人類的抑郁癥狀及一系列抑郁后生物化學改變,符合模型三效度(預測效度、結構效度、表面效度)要求,已被廣泛應用于抑郁癥研究領域。本文檢索中英文數據庫中關于CUMS 模型的相關文獻,從造模方法、行為學特征和病理生理特征三個方面對其進行全面綜合思考,綜述CUMS 致抑郁樣大鼠的生理病理變化,以期為抑郁癥研究動物模型的選擇提供思路。
1 資料和方法
1.1 資料來源和檢索策略
作者于2019年1月在中國知網(CNKI)、萬方數據知識服務平臺、PubMed 數據庫進行檢索;其中檢索式為主題(包含題目、關鍵詞和摘要)和關鍵詞,檢索詞為CUMS、慢性不可預知性應激(chronic unpredictable stress,C US)、慢性應激(ch r oni c mi l d s t r es s,CMS)、抑郁的(depressive)和大鼠(rat),共檢索出3291 篇相關文獻。
1.2 文獻納入標準和排除標準
納入標準:(1)以CUMS、CUS、CMS作為造模方法,探討模型動物病理變化的相關文獻;(2)2010年12月至2019年8月公開發表的期刊文獻;(3)同類文獻選擇研究設計合理、科學可信的文章或在權威雜志上發表的文章。
排除標準:(1)文獻為個案報道或編輯意見文體;(2)文獻存在研究方向重復、實驗動物品系不明、造模流程缺失等問題;(3)非中英文研究文獻。
1.3 質量評估與數據提取
本次綜述最終納入文獻120 篇,引用文獻69篇。 約2/3 文獻是近5年內的。如中英文觀點一致,選擇文獻質量較高的納入。納入的文獻著重闡述慢性應激對抑郁樣大鼠病理改變機制的相關研究。因造模應激方法多,時間長短不一,不適合Meta 分析,僅作定性描述。
2 文獻研究情況
2.1 造模方法
動物模型作為精神類疾病的研究工具,通過模型操作導致動物行為改變,研究者將這些行為變化與精神疾病相對應,以此加深對人類精神疾病病理學的認識。1980年Katz 等[2]將大鼠暴露于各種應激中,建立了CMS 模型。他們發現,抗抑郁藥物可以逆轉應激大鼠的行為學變化,并且使應激大鼠糖水消耗減少。盡管目前CMS模型已被廣泛應用于抑郁癥的研究中,但各個實驗室對于這個模型的名稱不盡相同,例如CMS、CUS和CUMS 等。盡管名稱不同,但對于應激壓力來說,實際操作中并無較大差異;“不可預知unpredictable”則指的是隨機使用應激操作[3]。
2.1.1 動物品種選擇 在本文所納入的文獻中,選用SD 大鼠作為模型動物的文獻占74.56%,選用Wistar大鼠作為模型動物的文獻占25.44%,其中雄性大鼠占74.34%。所選用大鼠的體質量在150~300 g。
2.1.2 應激種類選擇 研究者所選的應激種類主要有:禁水禁食、晝夜顛倒、持續光照、束縛、白噪音(聲音中頻率分量的功率在整個可聽范圍內都是均勻的)、傾斜鼠籠、冰水游泳、夾尾、足底電擊、水平振蕩、兩籠合并、熱應激、濕籠、強光頻閃、懸尾、陌生物品和異味應激等。CUMS 的應激方法眾多,各實驗室選擇的組合方式不盡相同。Antoniuk 等[4]在發表于2019年的Meta分析中共對408篇論文的應激規程進行了定量分析。他們發現,在大鼠的CUMS 模型中,大多數應激規程中都包括禁食和禁水(分別為12.5% 和12.2%)、晝夜顛倒(11%)、濕墊層(10.7%)、籠傾斜(10.2%)、社會壓力(7.7%)、強迫游泳(6.5%)和束縛(4.4%)。本文對所納入文獻中涉及的應激出現的頻率也做了統計,可供讀者在選擇CUMS應激種類時作參考(表1 )。
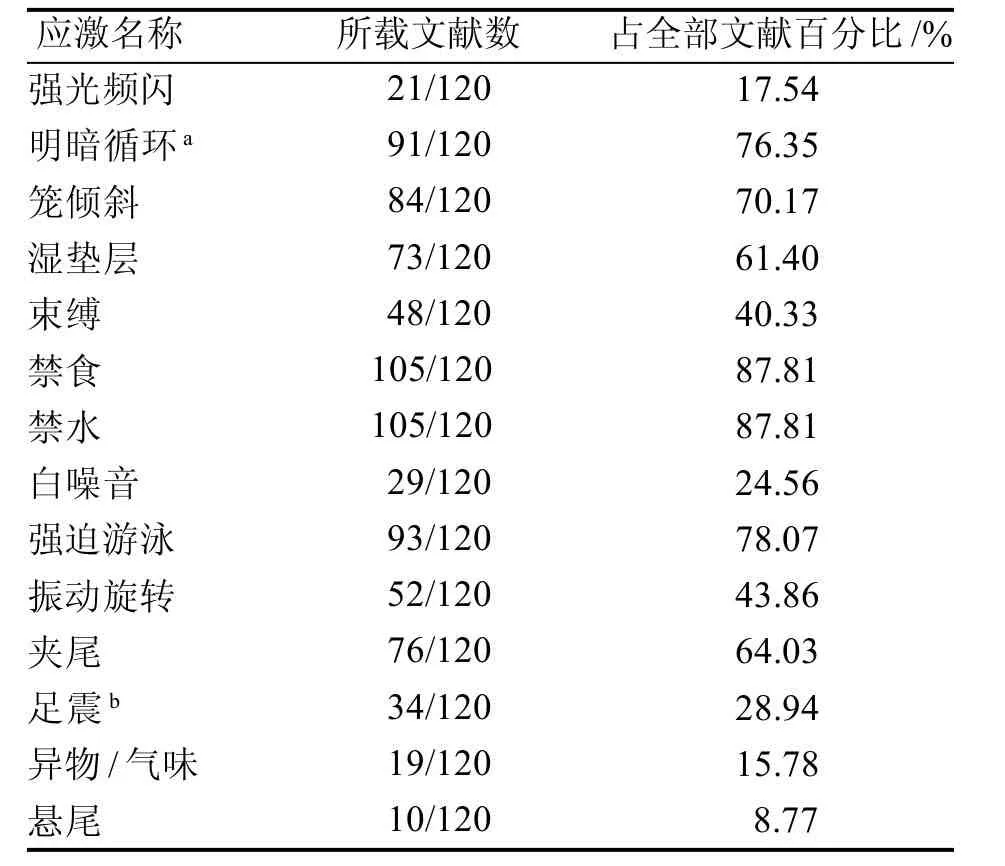
表1 CUMS模型造模所使用應激方法的文獻數量及頻率統計Figure 1 Statistical datum of literature quantity and frequency of stress methods used in CUMS
2.1.3 應激的具體操作 實驗者們多采用禁食禁水24 h、濕墊層24 h、籠傾45°、5 ℃冷水游泳10 min、40 ℃熱水游泳10 min、夾尾1 min等進行應激操作,每日使用1 種應激或多種應激,同種應激方法不能連續出現,使大鼠不能預知應激的發生,以避免產生適應。然而值得注意的是,在對應激時段的安排方面 ,有研究顯示為9∶00~11∶00,也有文章認為大鼠需要相對安靜和睡眠的時候予以應激會增加應激強度,使大鼠更易發生應激反應,大部分文章未描述具體應激時段;每一種應激的具體操作也無統一標準。
2.1.4 造模時間 Antoniuk 等[4]通過糖水偏好實驗發現,實驗動物對造模時間的敏感性存在差異。SD 大鼠對6 周和8 周的造模時間更敏感,造模3 周、4 周、6 周的Wistar 大鼠的糖水消耗值更低。本文所納入的文獻中,造模時間為3 周的文獻占35%,5 周和6 周的文獻各占9%,另有少量文獻造模時間選用2 周、11 周或12 周。
2.2 模型評價
行為學實驗廣泛用于神經精神類疾病動物模型的評價,在嚙齒類動物情緒測試中,可用于評估模型動物的抑郁、焦慮行為。20世紀末,研究者對CUMS模型大鼠的行為學評價方法比較單一,主要應用糖水偏好實驗說明獎賞系統受損可能是大鼠快樂體驗能力缺乏的主要機制[5]。此后模型評價方法逐漸豐富,曠場實驗、高架十字迷宮實驗和游泳不動實驗等逐漸被應用于模型評價中。
2.2.1 糖水偏好實驗 1981年,Katz 等[6]首次在抑郁大鼠造模過程中發現,應激后的大鼠蔗糖和糖精水的消耗減少達50%,并進一步發現三環類抗抑郁藥丙咪嗪可顯著增加模型組大鼠糖水的消耗量,隨后Willner 等[7]使用糖水偏好實驗對CUMS 大鼠進行評價,發現隨著應激時間的延長和應激強度增加,模型大鼠的糖水消耗率明顯下降,且該結果可被抗抑郁藥物去甲丙咪嗪改善。他們的實驗同時排除了大鼠糖水消耗減少是由于熱量調節失調或應激后血糖升高引起糖水攝入量降低的猜想。此重要發現說明了內源性抑郁癥的核心特征是獎勵機制缺陷和快感缺乏。現代研究表明,作為中腦“獎勵中心”的單胺核團,多巴胺系統邊緣通路與獎賞機制有關[8];外側韁核則是大腦的“反獎勵中樞”,其簇狀放電方式增強了對腹側被蓋區與中縫背核的抑制,進而導致了快感缺失與行為絕望,是抑郁癥發生的充分條件[9-10]。
研究者通過計算正常對照組大鼠與模型大鼠糖水總消耗量、糖水偏好率[糖水偏好率(%) = 糖水消耗/總液體消耗×100 %]的差別發現,模型大鼠糖水偏好率顯著下降,即可認為其快感缺失,并進一步認為模型大鼠出現了抑郁表現。
2.2.2 曠場實驗 礦場實驗也稱敞箱實驗、戶外情景反應,是基于探索的行為學方法檢測,它以觀察活動量來說明大鼠在新奇環境中的啟動、探究行為,以及緊張恐懼情緒和對新環境的警覺性。1934年,Hall[11]首先將該測試用于動物的情緒研究。利用嚙齒類動物畏懼空曠場地而又會對新事物產生探索欲望的特性,在同一時間段、相同環境下比較不同組動物的活動狀態,客觀定量地反映活動量及自主活動功能:水平活動反映動物的運動活性;垂直運動反映動物對新鮮環境的好奇程度;水平移動格數及直立次數表示大鼠的探究行為;理毛時間和次數反映了大鼠對環境警覺性水平;中央格停留時間表示啟動活動的潛伏期及回避陌生環境時間;排便量反映了動物在新環境中的緊張恐懼狀態。基于抑郁癥患者對社會的參與度下降,推測抑郁大鼠在曠場中的表現應為運動量減少及回避行為產生。Kennett 等[12]的實驗表明,抑郁大鼠在曠場中表現出水平移動減少、排泄增加、直立水平降低及停留曠場中央時間顯著延長,出現蜷縮、僵硬等回避行為。
曠場實驗目前用以評價動物自發活動以及焦慮狀態,它貫穿于嚙齒類動物的行為學研究,并推廣到神經學及精神藥理學的研究,在檢測抗抑郁藥物時具有良好的表面效度。
2.2.3 高架十字迷宮實驗 該實驗利用大鼠對新環境的探究特性和對高懸敞開臂的恐懼,形成矛盾沖突,評價動物是否處于抑郁焦慮狀態。高架十字迷宮有一對開臂和一對閉臂。小鼠由于嗜暗性會傾向于在閉臂中活動,但出于好奇心和探究性又會在開臂中活動。在面對新奇應激時,動物同時產生探究的沖動與恐懼,這就造成了探究與回避的沖突行為。該實驗以進入開放臂次數(open arm entry)、進入開放臂時間(open arm time)、進入封閉臂次數(close arm entry)、進入封閉臂時間(close arm time)、向下探究次數和封閉臂后腿直立次數等為主要檢測指標。開放臂和中央平臺區向下探究次數則反映大鼠的探索行為,代表動物對陌生環境的好奇探究或因恐懼而尋求逃避;進入開放臂和封閉臂總次數反映動物運動能力。眾多研究表明,動物進入開臂次數及停留時間與焦慮情緒呈負相關,進入開臂次數越少、停留時間越短,說明動物的焦慮情緒越嚴重。
2.2.4 強迫游泳實驗 該實驗是基于絕望的行為學檢測方法,由法國學者Porsolt 等[13]在1977年發明,起初用于行為絕望(behavioural despair)抑郁模型的評價。實驗將大鼠被迫困在局限性透明圓柱形容器中游泳,初入水時大鼠游泳運動劇烈以對抗環境的不適,進而進入一種特征性的漂浮不動狀態:身體微蜷,僅露出鼻孔維持呼吸,前爪停止刨水,后爪偶有劃動。這種不動狀態實際是動物不能脫離困境后放棄逃脫念想的行為,反映了大鼠的絕望狀態,屬于“行為絕望”。實驗通過觀察CUMS模型大鼠的強迫游泳的靜止時間(除維持其鼻子在水面上必要動作以外,沒有任何其他動作)、掙扎時間(大鼠前爪劇烈運動)及游泳時間(前后爪有規律的上下劃動)評價模型大鼠的絕望程度。研究表明,與對照組相比,CUMS 模型大鼠的游泳不動時間即靜止時間更長,絕望狀態更明顯。
2.2.5 懸尾實驗 與游泳不動實驗相似,懸尾實驗同樣是基于絕望行為的檢測方法。該實驗主要以固定動物的尾端并將其倒懸,使其因不適體位產生以逃避為導向的劇烈掙扎,活動一段時間后不能擺脫困境,不動狀態間歇性出現,此不動性被認為類似絕望行為[14],不動時間越長,則絕望表現更明顯。近兩年在藥理學[15]和轉基因動物檢測[16]方面的研究均表明,懸尾實驗是針對抑郁動物模型可行、有效的行為學評價方法,同時也是抗抑郁藥物活性篩查中非常靈敏的行為學檢測方法[17]。然而由于大鼠體質量相對較大,固定尾部環節較難實施,采用懸尾實驗的研究相對較少。
2.3 病理生理特征
目前對于抑郁癥發病機制尚未有統一的認識。眾多研究結果表明,抑郁癥可能是一種涉及多機制的疾病。目前對于抑郁癥的發病機制較公認的有單胺類假說、受體假說、神經元營養/再生假說和基因易感性假說等。應激模型大鼠在造模后形成的一系列病理生理特征與人類抑郁癥的發病機制較為符合,總結如下。
2.3.1 單胺類神經遞質及受體失調 單胺是與人類情感精神情緒有關的神經遞質,主要包括去甲腎上腺素(norepinephrine,NE)、五羥色胺(5-hydroxytryptamine,5-HT)、多巴胺(dopamine,DA)。1965年,Schildkraut 等提出的經典“單胺假說”是第一個關于抑郁癥的神經化學理論,該假說認為NE 或5-HT相對或絕對不足是抑郁癥發生的主要原因[18]。基于該假說,早期抗抑郁藥物通過抑制突觸間隙中單胺類遞質的降解(單胺氧化酶抑制劑),抑制突觸間隙單胺類遞質的再攝取(三環類抗抑郁藥),提高突觸間隙中單胺類遞質的濃度,從而產生抗抑郁作用。目前三環類抗抑郁藥、5-HT 去甲腎上腺素再攝取抑制劑(SNRI)、選擇性5-HT 再攝取抑制劑(SSRI)仍然是最有效的抗抑郁藥物[19]。現代研究者們通過CUMS動物模型發現CUMS確實可以引起單胺類神經遞質的失調,如:Alam 等[20]和Duo等[21]發現CUMS模型大鼠海馬組織中NE含量下降;一些研究者[21-23]發現模型大鼠海馬、腹側被蓋區、蒼白球以及腹側蒼白球中DA 的含量下降;Natarajan 等[24]發現CUMS 模型大鼠內側前額葉皮質和背中縫的5-HT 含量均有所下降。
隨著進一步探索,研究者們提出了“現代單胺假說”:單胺類遞質自身受體的適應性調節與抑郁癥治療密切相關,傳統抗抑郁藥物作用的同時急性提高了單胺遞質的水平,并誘導單胺系統產生長期的適應性改變,使抑制性自身受體失敏,從而使中樞系統單胺遞質活性進一步升高,產生治療效果。近些年對單胺類遞質轉運蛋白和受體的研究取得了許多進展,如:Le Francois 等[25]測定了模型大鼠前額葉皮質和中腦5-HT1A 的RNA和蛋白水平,結果顯示兩個區域內二者含量均下降。吳帥等[26]和王玉婷等[27]發現模型大鼠眶額葉和紋狀體內多巴胺D1 受體的含量明顯下降。費慧芝等[28]測定模型大鼠海馬去甲腎上腺素轉運體(noradrenaline transporter,NET)基因的mRNA和蛋白表達量,發現海馬內NET mRNA及蛋白的含量明顯增多。
2.3.2 其他遞質受體障礙 隨著神經生物化學理論的發展 ,研究者發現更多種類的受體參與到抑郁癥的病理生理過程,包括促離子型受體和促代謝型受體,主要為抑制性氨基酸類γ- 氨基丁酸(γ-aminobutyric acid,GABA)及興奮性氨基酸類谷氨酸和門冬氨酸。如Zhu 等[29]發現模型大鼠伏隔核中GABA 轉運蛋白水平下降,GABA能神經元興奮性降低;吳帥等[26]、劉慧等[30]和陳慧彬等[31]發現模型大鼠海馬內N- 甲基天冬氨酸受體NR2B 亞基含量顯著上升。Cuccurazzu 等[32]和Liu等[33]分別測定模型大鼠mGlu2 受體表達、谷氨酸受體亞基GRIA3 的含量,結果發現,二者表達均下調。Li等[34]不僅發現CUMS模型大鼠細胞外谷氨酸積累,還發現其所伴隨的死亡相關蛋白激酶1(DAPK1)和N-甲基-D-天冬氨酸受體(NMDAR)的相互作用有所增加,DAPK1 和磷酸化GluN2B表達增多;他們的研究表明DAPK1 與NMDAR GluN2B亞基的相互作用是抑郁癥病理生理學中的關鍵組分,并且可能是抑郁癥新的治療靶點。此外,GAB A 類受體a 和c 均為促離子型受體,GABAb 作為促代謝型受體較新出現于CUMS 模型大鼠研究中,如Gao 等[35]發現模型大鼠下丘腦室旁核中GABAb 受體的表達含量減少,突觸前GABAb 受體的含量增加。
2.3.3 神經元營養/再生減少 目前,許多研究者將目光聚焦于神經營養因子假說,起初該假說的研究對象主要涉及腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)、腦源性神經營養因子前體(precursor of brain-derived neurotrophic factor,proBDNF) 及成熟型腦源性神經營養因子(mature form of brain-derived neurotrophic Factor,mBDNF)等單獨的神經因子。該假說認為抑郁癥患者腦BDNF 水平下降可能與神經營養因子的可塑性降低有關[36]。研究顯示,CUMS 模型大鼠腦內BDNF 等神經營養因子含量均出現下降,如:Dandekar 等[37]和孫合亮等[38]發現模型大鼠海馬、腦脊液內BDNF 含量顯著下降;Bai 等[39]發現模型大鼠海馬內proBDNF 的表達明顯減少;Zhang 等[40]研究發現,mBDNF 的親和性受體TrkB 激動劑可改善模型鼠的抑郁癥狀。因此推測抑郁癥的發生可能與B D N F、proBDNF 和mBDNF 之間的動態平衡被打破有關,pr oBDN F 可能是抑郁癥的危險因素,而mBDNF 可能是抑郁癥的保護性因子。隨著研究的深入,研究者們發現組織型纖溶酶原激活劑(tissue-type plasminogen activator,tPA)可通過促使proBDNF 向mBDNF轉化而使抑郁癥狀得到緩解,纖溶酶原激活物抑制劑-1(plasminogen activator inhibitor-1,PAI-1)則可抑制tPA 的表達[41]。如Zhang 等[42]發現CUMS 大鼠的海馬proBDNF / mBDNF 比值下調,海馬中tPA水平升高;Han 等[43]發現模型大鼠tPA、PAI-1 的mRNA表達均降低。因此研究者認為tPA-纖溶酶原系統通過調控proBDNF 向 mBDNF 轉變,在抑郁癥的病理生理過程中發揮重要作用。
近年來,研究者們對CUMS模型大鼠神經細胞信號通路改變的探究也逐漸增多,包括環磷酸腺苷反應原件蛋白(CREB)-BDNF 信號通路、環磷酸腺苷(cAMP)/蛋白激酶(PKA)-CREBB D N F 通路和B D N F- 細胞外信號調節激酶(ERK)-CREB 通路。研究部位主要集中在杏仁核和海馬。如Yu 等[44]發現了模型大鼠腹外側杏仁核內CREB-BDNF 信號通路改變,CREB 和BDNF 含量均明顯減少。Luo 等[45]研究了模型大鼠海馬神經元內cAMP/PKA-CREB-BDNF通路的變化,他們發現該通路上BDNF、PKA、CREB以及磷酸化CREB 的表達均顯著減少。Xie 等[46]發現BDNF和NGF的上游調節和信號通路中鈣調蛋白依賴性蛋白激酶Ⅱ(CaMK Ⅱ)表達下調,及其兩個亞基CaMK Ⅱα 和CaMK Ⅱβ 的磷酸化水平上升。
2.3.4 細胞因子假說 隨著人們對抑郁癥發病機制認識的不斷深入,細胞因子學說發展迅速,該學說也稱免疫研究學說,認為抑郁癥的發生可能與外周、中樞免疫系統激活后免疫細胞合成或分泌的蛋白增多有關,從而引起與抑郁癥相關的各種行為、神經生物化學改變。目前,CUMS 模型研究主要集中于細胞因子假說中的白細胞介素(interleukinin,IL)和腫瘤壞死因子(tumor necrosis factor,TNF),研究部位多在海馬、前額葉皮質、血清等。眾多研究表明,IL-1β、IL-6 和TNF-α 等細胞因子可作用于大腦,外周循環中細胞因子的水平也與抑郁密切相關,如:Su 等[47]、Gaiguier 等[48]和Avolio 等[49]分別測定了模型大鼠血清以及海馬、杏仁核、前額葉皮質中IL-1β 的含量;Pan 等[50]發現模型大鼠腦脊液和前額葉皮質中IL-1β和IL-1β mRNA的含量均有所增加;Jia 等[51]和Yazir 等[52]發現模型大鼠血中IL-6的含量減少;Dandekar 等[37]發現CUMS 模型大鼠海馬中IL-2、IL-5、IL-7 和IL-18 的含量明顯增多。TNF 由巨噬細胞產生,分為TNF-α 和TNF-β,其中涉及TNF-α 變化的研究較多。如Yazir 等[52]發現模型大鼠海馬、大腦皮層以及細胞中TNF-α的含量有所上升。此外,還有少量研究涉及T 淋巴細胞的輔助細胞Th 細胞(CD4+)和T 淋巴細胞的毒性細胞Tc 細胞(CD8+)。如關素珍等[53]測定了模型大鼠體內CD4+、CD8+T 細胞的含量,發現CD4+T 細胞的含量下降、CD8+T 細胞的含量上升。
2.3.5 內分泌系統紊亂 神經內分泌假說是抑郁癥發病機制中較公認的假說之一。它包括:下丘腦-垂體-腎上腺素軸(hypothalamic-pituitaryadrenal axis,HPA)、下丘腦-垂體-甲狀腺軸(hypothalamus-pituitary-thyroid axis,HPT)和下丘腦-垂體-性腺軸(hypothalamus-pituitarygonadal axis,HPG)等負反饋失調。外界應激作用于感覺器官,將應激信號傳遞給大腦,再傳遞給中樞神經系統,下丘腦室旁核分泌相應激素,通過垂體門脈系統運送到腦垂體,垂體繼續釋放相應激素,最后作用于各腺體,形成負反饋。
2.3.5.1 HPA軸 CUMS會使得模型大鼠下丘腦釋放促腎上腺皮質激素釋放激素(corticotropin releasing hormone,CRH)、垂體釋放促腎上腺皮質激素(adreno-cortico-tropic-hormone,ACTH)以及腎上腺在ACTH 的刺激下釋放皮質酮(corticosterone,CORT)的含量均明顯增多。如Wang 等[54]發現模型大鼠血清中CRH 和ATCH 的含量明顯增多,Wu 等[55]、Su 等[47]和Scorrano 等[56]分別測定了模型大鼠血清、前額葉皮層、毛發中CORT 的動態變化,發現CORT 的含量均明顯升高。
2.3.5.2 HPT軸 CUMS能使得下丘腦促甲狀腺激素釋放激素(thyrotropin-releasing hormone,T R H)釋放增加,促甲狀腺激素(t h y r o i d stimulating hormone,TSH)釋放減少,三碘甲狀腺原氨酸(thyroid,T3)釋放增加。如宋美卿等[57]實驗發現,模型大鼠血清內T3 和TRH 的含量升高,TSH 含量減少。
2.3.5.3 HPG 軸 研究發現,CUMS 模型大鼠下丘腦分泌的促性腺激素釋放激素(gonadotrop(h)in(hormone)-releasing hormone,GnRH)含量明顯減少;CUMS 雌性大鼠垂體所分泌的促卵泡刺激素(follicle stimulating hormone,FSH)增多,卵巢分泌的雌二醇(estradiol,E2)減少。雄性模型大鼠睪丸分泌的睪酮(testosterone,T)減少,如Yazir 等[52]發現,模型大鼠血清中T 含量明顯減少。
2.3.6 其他 現有的各種病理機制仍不足以解釋抑郁癥這一多病因、異質性疾病。另有一些研究者試圖通過針對抑郁癥其他方面的病理機制研究為抗抑郁藥物找到新的作用靶點[58]。
腸道微生物組作為人體最大、最直接的外環境,對人體健康起到了重要作用。代謝通路是調節腸道微生物的重要途徑,研究者們發現,CUMS模型大鼠的腸道代謝出現了不同程度的異常。例如田俊生等[59]發現模型大鼠糞便提取物中內源性代謝產物谷氨酰胺、乳酸和天冬氨酸含量明顯增加,尿嘧啶、酪氨酸和苯丙氨酸含量則明顯降低。該課題組還測定了盲腸組織中代謝產物的變化規律,發現丙氨酸、絲氨酸和谷氨酸等增多,棕櫚酸和硬脂酸減少。Li 等[60]發現模型大鼠糞便代謝組中丁酸、直腸內丙酸鈉出現失調。
微RNA(microRNA,miR)應用于抑郁癥的研究近幾年逐漸興起,其研究部位主要集中在杏仁核、前額葉皮質以及海馬。例如Yu 等[44]和Fan 等[61]發現模型大鼠miR-134在腹外側杏仁核表達減少,在腹內側前額葉皮質中表達增加。Zhou等[62]發現模型大鼠海馬組織中mircoRNA 的異常表達,miR-382-3P、miR-183-5P、miR-3575-5P、miR-202-3P和miR-493-3P這五種microRNA的表達上調,而miR-370-3P 的表達下調。
對神經內分泌免疫網絡的研究也涌現出了許多新方向,如Sekar 等[63]發現CUMS 模型大鼠體內膽堿及肌醇水平升高,表明模型大鼠存在細胞膜代謝改變和炎性反應過程。Song 等[64]發現模型大鼠海馬CA1 區中產生了促炎因子前列腺素E2(PG E2),并因此使膠質細胞活化的環氧合酶(COX)-2 的表達增加。此外,他們發現CA1區中阻斷β形式的鈣/鈣調蛋白依賴性蛋白激酶Ⅱ型(βCaMKⅡ)的含量在模型大鼠中顯著上升。因此他們認為COX-2 / PGE2途徑活性的增強能較大程度上誘導大鼠產生抑郁樣癥狀。
近年來,離子通道也逐漸成為熱門抗抑郁研究的新方向[65]。串聯孔域弱內向整流鉀通道1[tandem-pore-domain weakly inward rectifying potassium channel(TWIK)-related K+channel 1,TREK1]為機械門控鉀通道,對CUMS 模型大鼠進行TREK1 阻滯,可有效改善大鼠的抑郁表現[66]。α-氨基-3-羥基-5-甲基-4-異惡唑受體(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionate receptor,AMPAR)為離子型谷氨酸受體,屬于是配體門控性離子通道,研究發現,CUMS 模型大鼠突觸上的該受體顯著減少[67]。此外還有研究者發現抑郁癥與鐵離子轉運之間存在聯系。這些研究不僅作為抑郁癥生理病理學的重要組成部分,也是新的潛在研究靶點。
3 討論與展望
在應激導致抑郁癥的動物模型中,常用的有CUMS 模型、習得無助模型(learned helplessness,LH)、慢性社會挫敗模型(chronic social defeat stress,CDCS)等等。CUMS 模型所致的疾病發生和表現形式,更能模擬人類的抑郁癥狀及一系列人類抑郁后引起的生化改變。該模型動物的情緒表現與人類相應情緒表現相似;產生情緒障礙的生物學機制與人類相同;對于情緒障礙有效藥物有明顯的反應性,即符合情緒障礙動物模型表面效度、結構效度和預測效度的評價標準,因此在抑郁癥研究領域被廣泛使用。然而,CUMS模型本身的可靠性、可復制性問題已經到了不能忽視的地步。筆者認為,目前CUMS 模型有以下幾點需要進一步探討。
第一,在實驗動物品系的選擇方面應充分考慮研究目的、實驗環境與動物遺傳異質性。Gururajan 等[68]認為,近交系和遠交系動物模型在變異程度方面存在差異,近交系動物的變異程度更低。大鼠與小鼠均為神經系統研究常用動物模型,小鼠多為近交系動物;而SD、Wistar 大鼠作為封閉群大鼠,雖可能較小鼠變異程度更大,但大鼠在神經藥理學方面表現良好,與小鼠相比,大鼠的體型更易進行侵入式研究。近年來,小鼠作為基因研究方向實驗動物的優勢較大鼠更為突出,因此不少研究者選用小鼠作為實驗動物。實驗中環境和模型動物本身遺傳產生的變異可相互影響。因此筆者認為,在選擇模型動物品系時應依據實際研究問題進行調整,因其異質性與抑郁程度相關,在動物品系的選擇上應將環境與遺傳本身的異質性考慮在內,使得模型更加穩定,避免出現較大的實驗誤差。
第二,目前CUMS 的操作規程還未標準化。CUMS 所涉及的應激種類較多,同時強調“隨機”,各實驗室的CUMS 操作流程幾乎都不相同,如何構建操作的標準流程成為模型發展的一個關鍵問題。通過總結造模方法可以發現,禁水禁食、晝夜顛倒、傾斜籠位、濕墊層和冷水游泳為高頻選擇項,持續光照、束縛、熱應激和水平振蕩為中頻選擇項。目前操作流程存在幾方面問題:應激項目沒有公認的選擇方案,應激的操作順序沒有統一規范,各應激的刺激強度沒有統一標準,各應激操作時間安排未作詳細敘述等;另外,各文獻所選組合方法不一,且未說明組合原因。筆者認為,未來CUMS 模型的發展需要將上述幾方面考慮在內,更嚴格規范CUMS 操作規程,是保證模型穩定性和可復制性的重要前提。
第三,動物模型作為疾病機制探討的輔助工具,其作用根本在于為藥物的研發服務,因此模型有效性即轉化價值顯得尤為重要。1969年McKinney等[69]以及1997年Willner[70]發表的論文中都將動物模型結構和預測效度的定義進行了總結和發展。目前評價模型有效性的標準主要有:同源性有效性、病原性有效性、機制有效性、內部有效性和外部有效性等。此外,對于如何設計動物模型使其能對人體病情進行經驗性預測,從而達到更高的模型有效性,筆者認為除了需關注疾病的核心行為和相關實驗室分子表型,也應將現代神經科學技術方法包括行為表征技術、機制探討技術、藥物開發技術等應用于傳統CUMS模型造模方法、模型評價等的革新中,以期為抑郁癥模型選擇提供思路,進而能更好服務于抗抑郁藥物的開發。

