莓實假單胞菌產低溫膽固醇酯酶發酵條件優化
韓廷玉,李盼盼,劉春瑩,于 爽,遲雪梅,遲乃玉,張慶芳
(1.大連大學 生命科學與技術學院,遼寧 大連116622;2.遼寧省海洋微生物工程技術研究中心,遼寧 大連116622;3.基因賽奧(大連)生物科技發展有限公司,遼寧 大連116622)
酯酶是指能夠催化酯鍵水解或合成的酶類,當發生水解時,能催化酯鍵產生相應的酸和醇;合成時,可以把酸的羧基與醇的羥基縮合并脫水,產物為酯類及其它香味物質。甾醇酯酶(sterol esterase)又稱為膽固醇酯酶,它他泛存在于包括人在內的高等動物、微生物等生物體內[1]。甾醇酯酶能夠在水相條件下催化甾醇酯水解生成甾醇和脂肪酸,同時在有機溶劑中通過酯化或酯交換進行催化酯合成反應[2]。甾醇酯酶作為一種重要的酶制劑,可幫助機體消化吸收油脂類營養物質,因其與人體脂質代謝及膽固醇吸收有關,甾醇酯酶是檢測血液中總膽固醇含量的重要酶制劑之一[3]。同時還可解決機械制漿造紙工藝中樹脂障礙問題的潛力[4],由于其廣泛的底物特異性和穩定性,在食品、醫藥、紙漿工業及化工行業等發揮重要作用[5]。
自然界中,微生物生產的甾醇酯酶具有生產成本低、工藝簡單、不易污染、不受季節影響及易形成規模化生產等優點,已成為目前研究熱點[6-7]。
本研究以莓實假單胞菌(Pseudomonas fragi)Q-06為出發菌株,對其發酵培養基和發酵條件進行單因素、Plackett-Burman(PB)、最陡爬坡試驗、Box-Behnken(BB)和響應面試驗[9-10]。通過對最優發酵條件的初步探究,提高酶產量和酶活力,以期為此海洋低溫甾醇酯酶的規模化生產打下良好的基礎,并提供參考依據。
1 材料與方法
1.1 材料與試劑
1.1.1 出發菌株莓實假單胞菌(Pseudomonas fragi)Q-06 篩選自渤海海泥中,保藏于遼寧省海洋微生物工程技術研究中心。
1.1.2 試劑
可溶性淀粉:哈靈生物公司;麥芽糖、葡萄糖、氯化銨:吉林東博生物公司;蔗糖、乳糖、硝酸銨:賽德試劑公司;牛肉膏:福建明福試劑公司;辣根過氧化物酶:生工生物(上海)股份工程有限公司;膽固醇氧化酶(cholesterol oxidase,COD):上海源葉生物科技有限公司;羅丹明B:國藥集團化學試劑有限公司;植物甾醇酯:江蘇春之谷生物制品有限公司。試驗所用試劑均為分析純或生化試劑。
1.1.3 培養基
保藏培養基:酵母浸粉10 g/L,蛋白胨10 g/L,葡萄糖6 g/L,K2HPO42 g/L,瓊脂粉20 g/L,單蒸水1.0 L,pH 7.0。
種子培養:胰蛋白胨10 g/L,牛肉膏5 g/L,NaCl 10 g/L,pH 7.0。
發酵培養基:植物甾醇酯0.5%,酵母粉0.3%,KH2PO40.1%,MgSO4·7H2O 0.03%,(NH4)2SO40.05%,葡萄糖0.5%,pH值為7.0。
1.2 儀器與設備
LFX-30B Thermo酶標儀:北京昊諾斯科技有限公司;HZP-256 全溫振蕩培養箱:上海智誠分析儀器制造有限公司;BA410E生物顯微鏡:麥克迪奧實業集團有限公司;NB-1630超凈工作臺:菲迪康樂(廣州)科學儀器有限公司;LDFX-50BI立式壓力蒸汽滅菌鍋:蘭州方盛生物科技有限公司;PHS-3E雷磁pH計:上海儀電科學儀器股份有限公司;UV-H232可見紫外分光光度計:菲迪康樂(廣州)科學儀器有限公司。
1.3 方法
1.3.1 菌株活化
將菌株Q-06接種于LB平板上,28 ℃活化培養24 h,重復活化3次,4 ℃保存備用。
1.3.2 種子液制備
將活化后的單菌落接種于種子培養基中,28℃、200r/min振蕩培養24 h,連續轉接3次。
1.3.3 發酵液制備
將二級種子液以3%~5%接種量,接種到發酵培養基中,28 ℃、200 r/min振蕩培養48 h。
1.3.4 菌株生長曲線與發酵產酶酶活曲線測定
無菌條件下,對發酵液每隔4h定時取樣。28℃、200r/min振蕩培養,利用分光光度計測定波長600 nm處吸光度值(OD600nm值),以確定菌株的生長情況和產甾醇酯酶活力的大小。
1.3.5 菌株粗酶液制備
對振蕩培養48h的發酵液,在溫度為4℃、轉速為8000r/min、時間為20 min條件下離心得到的上清,即為粗酶液[9]。
1.3.6 甾醇酯酶活性測定方法
酶活定義:在測定條件下,每分鐘催化1 μmol底物水解所消耗的酶量為一個酶活單位(IU)[9]。
根據甾醇酯酶活性的測定原理進行酶活性測定,具體操作參考曾誠等[3]的報道:分別配制底物溶液(在0.15 mol/L磷酸緩沖液中先后加入膽固醇亞油酸酯0.61 mmol/L,異丙醇8.0%,0.015 TritonX-100 mol/L,調節pH為7.0)與4-乙酰氧基氮雜環丁酮-苯酚工作液(0.15 mol/L磷酸緩沖液中分別加入1.48 mmol/L 4-乙酰氧基氮雜環丁酮,3.0 IU/mL過氧化物酶,0.5 IU/mL COD,0.01 mmol/L苯酚,pH 7.0),將兩者按照1∶2的比例混合,再加入適量酶液,充分混合后于37 ℃水浴條件下反應15 min,以滅活酶液作為對照,測量波長500 nm處的紫外吸光度值,平行3次,取平均值。相對酶活(%)即為樣品酶活與同組最高酶活之比。
1.3.7 發酵條件優化
在基礎培養條件為28 ℃、200 r/min、搖瓶發酵48 h,碳源、氮源添加量為3.0%的基礎上,分別改變不同的發酵條件,考察不同碳源種類(可溶性淀粉、葡萄糖、蔗糖、乳糖、麥芽糖、糊精)、最適碳源添加量(1.0%、2.0%、3.0%、4.0%、5.0%)、不同氮源種類(尿素、牛肉膏、NH4Cl、酵母粉、NH4NO3、蛋白胨)、最適氮源添加量(0.50%、0.75%、1.00%、1.25%、1.50%、1.75%)、不同無機鹽(1.0%KH2PO4、1.0%MgSO4·7H2O、1.0%(NH4)2SO4),不同的初始pH值(6.0、6.5、7.0、7.5、8.0、8.5)、培養溫度(22 ℃、24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)、轉速(150 r/min、160 r/min、170 r/min、180 r/min、190 r/min、200 r/min)、裝液量(30 mL/250 mL、50 mL/250 mL、70mL/250mL、90mL/250mL、110mL/250mL、130mL/250mL)、二級種子液接種量(2%、3%、4%、5%、6%、7%)對菌株Q-06生長的影響。
1.3.8 發酵條件Plackett-Burman試驗設計
在確定了菌株發酵產酶的最優單因素條件后,在此基礎上,在發酵產酶條件中選擇酵母粉添加量、葡萄糖、轉速、磷酸二氫鉀、pH、接種量、裝液量和溫度8個因素作為PB試驗的考察對象,進行PB試驗設計(N=12),最終確定3個顯著影響因素[10-11]。PB試驗設計見表1。

表1 發酵條件優化PB試驗設計因素與水平Table 1 Factors and levels of PB tests for fermentation conditions optimization

續表
1.3.9 最陡爬坡試驗設計
通過上述PB試驗后,得到影響菌株Q-06發酵產酶的3個顯著因素,然后對其進行步長設計,設計2個因素逐漸增大步長,1個因素逐漸減小步長,進行中心組合試驗[12]。
1.3.10 響應面試驗設計
以菌株Q-06發酵產酶的酶活性最高點為中心點,對上述最顯著的3因素進行3水平的Box-Behnken試驗設計。試驗因素與水平見表2。運用上述軟件所得到的最優結果對預測值進行驗證,取3次試驗均值[13]。
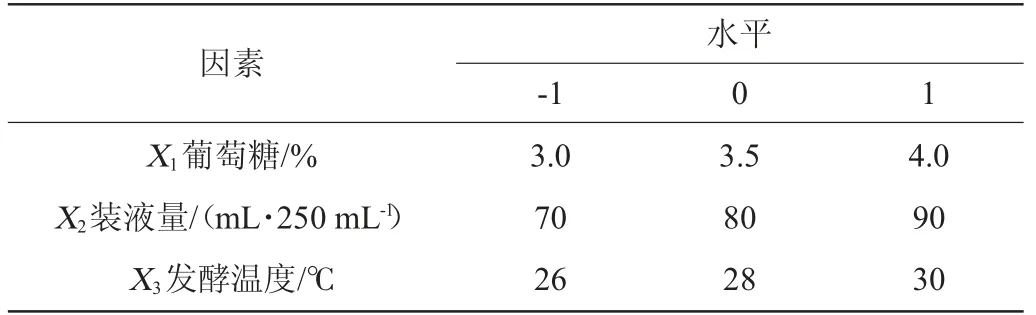
表2 發酵條件優化響應面試驗因素與水平Table 2 Factors and levels of response surface tests for fermentation conditions optimization
1.3.11 數據處理與分析
通過Design-Expert.8.0.5b 軟件對中心組合試驗數據進行顯著性檢驗。
2 結果與分析
2.1 菌株生長及發酵產酶酶活曲線
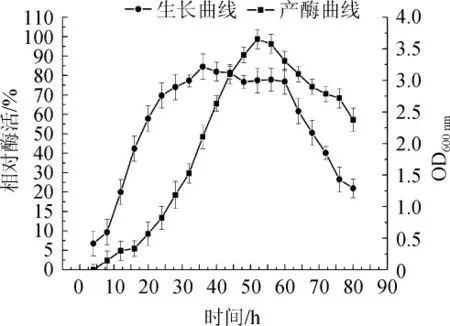
圖1 菌株Q-06生長曲線與發酵產酶曲線Fig. 1 Growth curve and enzyme production curve of strain Q-06
由圖1生長曲線可發現,甾醇酯酶菌株Q-06以4 h作為分界線,4 h前為遲滯期;從4 h后菌株生長迅速,開始進入對數生長期,該時期的菌株活力最旺盛,生長速率常數R最大代時最短;35 h后菌株開始進入穩定期,該階段菌株生長速率常數R=0,個數基本保持不變;60 h后菌株開始進入衰亡期,該時期菌株總數減少。從圖1產酶曲線中還可看出,在4~20 h之間菌株Q-06發酵酶活較低,20~48 h酶活迅速增加,當發酵時間為50 h時,達到酶活性最高點,而后酶活性緩慢下降,因此可判斷該菌株屬于同型發酵。
2.2 發酵條件優化
2.2.1 不同種類的碳源及添加量對發酵產酶的影響
碳源種類的差異對菌株產酶效果影響較大。由圖2可知,當發酵培養基以葡萄糖為發酵培養基碳源時,酶活力最高;以糊精為發酵培養基碳源時,產酶活力最低,因此選擇葡萄糖作為最優碳源。

圖2 不同類型的碳源對酶活的影響Fig. 2 Effect of different carbon sources on enzyme activity
確定葡萄糖為菌株Q-06發酵產甾醇酯酶的最適宜碳源后,改變其添加水平,選出葡萄糖最適添加量,結果見圖3。由圖3可知,隨著葡萄糖添加量的增加,菌株產甾醇酯酶的能力先升高后降低,當葡萄糖添加量為3%時,菌株產甾醇酯酶效果最好;因此,選擇葡萄糖3%為發酵培養基最適碳源添加量。
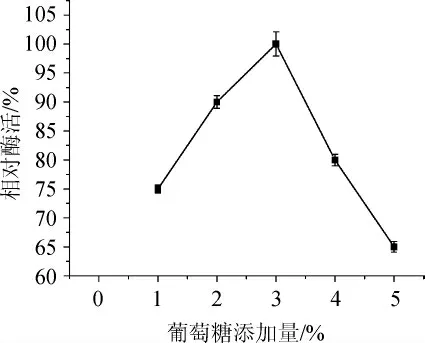
圖3 葡萄糖添加量對酶活的影響Fig. 3 Effect of glucose addition on enzyme activity
2.2.2 不同種類的氮源及添加量對發酵產酶的影響
為確定發酵培養基的最優氮源種類,分別選擇不同種類的有機氮源和無機氮源添加于發酵培養基中,結果見圖4。
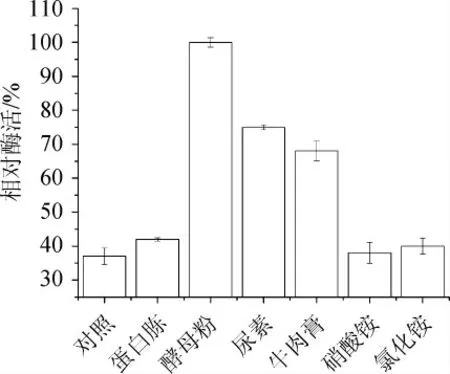
圖4 不同種類氮源對酶活的影響Fig. 4 Effect of different nitrogen sources on enzyme activity
由圖4可知,當發酵培養基以酵母粉為氮源時,發酵產酶活力最高,其次是尿素和牛肉膏。因此,選擇發酵產酶能力最高的酵母粉為最優氮源。
在確定酵母粉為菌株發酵產甾醇酯酶的最適宜氮源后,改變其添加量,選出適合發酵的最適氮源添加量,結果見圖5。
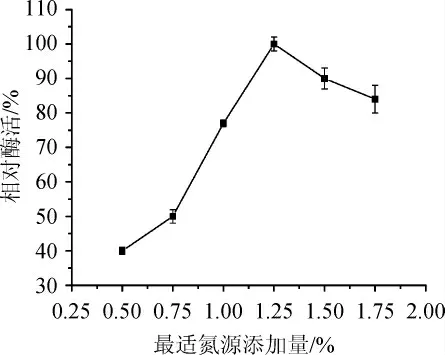
圖5 酵母粉添加量對酶活的影響Fig. 5 Effect of yeast powder addition on enzyme activity
由圖5可知,隨著酵母粉含量在0.50%~1.25%范圍內的增加,甾醇酯酶相對酶活不斷升高,當酵母粉添加量為1.25%,酶活最高,因此選擇1.25%酵母粉作為發酵培養基中最適氮源添加量。
2.2.3 不同種類無機鹽及添加量對發酵產酶的影響
由圖6、7可知,無機鹽(NH4)2SO4、MgSO4·7H2O、KH2PO4對發酵產酶均有一定的影響。當加入量為0.4%時加入KH2PO4的發酵液內相對活性最高。選出KH2PO4為最優無機鹽,然后調整KH2PO4添加量為0.1%、0.2%、0.3%、0.4%、0.5%,考察不同濃度KH2PO4對酶活的影響,結果表明,無機鹽KH2PO4最適添加量為0.4%。
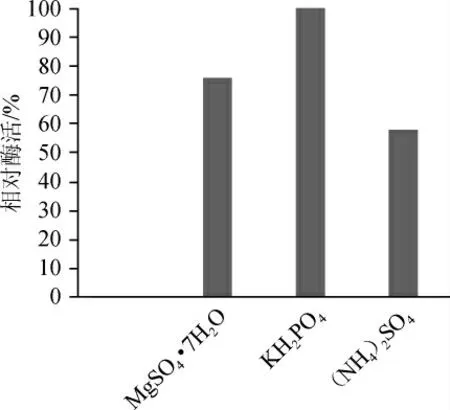
圖6 不同種類無機鹽對酶活的影響Fig. 6 Effect of different inorganic salts on enzyme activity

圖7 不同KH2PO4添加量對酶活的影響Fig. 7 Effect of different addition of KH2PO4 on enzyme activity
2.2.4 初始pH對發酵產酶的影響
適當的pH對菌株生長很重要,而且在生成產物時也需要適當的pH。由圖8可知,當初始pH為7.5時,酶活最高;當初始pH為7.5~8.5時,仍存在80%以上的相對酶活,說明該菌株耐堿性較強;當pH<7.5時,產酶活力直線下降。初始pH為7.5時相對酶活最高,故最適發酵pH為7.5。

圖8 初始pH值對發酵產酶的影響Fig. 8 Effect of initial pH value on enzyme production by fermentation
2.2.5 培養溫度對發酵產酶的影響
由圖9可知,隨著溫度的升高,酶活先不斷提高,當溫度達到28℃時酶的活性達到最大,當溫度繼續升高時酶的活性出現下降趨勢。這一結果說明了該菌株具備低溫酶的特點,可以在工業生產中節約更多的能量,最適培養溫度為28 ℃。
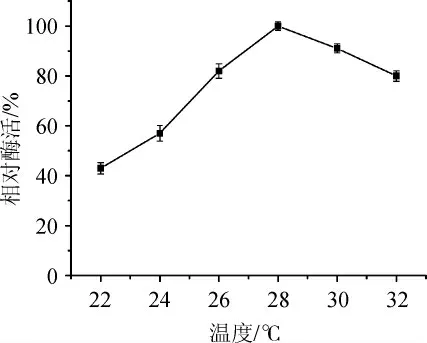
圖9 培養溫度對發酵產酶的影響Fig. 9 Effect of culture temperature on enzyme production by fermentation
2.2.6 轉速對發酵產酶的影響
發酵過程中,不同的轉速也會影響菌株產酶,原因是轉速調節著發酵過程的溶氧量,溶氧量的過高或過低直接影響菌株生長及后期酶的合成。由圖10可知,轉速<180 r/min時隨著轉速的加快相對酶活也不斷提高,當轉速提高到180 r/min以上對菌株產酶造成不良影響,導致相對酶活開始下降,當轉速為180 r/min時其相對酶活最高,故最適轉速為180 r/min。

圖10 轉速對發酵產酶的影響Fig. 10 Effect of rotation speed on enzyme production by fermentation
2.2.7 裝液量對發酵產酶的影響

圖11 裝液量對發酵產酶的影響Fig. 11 Effect of loading volume on enzyme production by fermentation
在一定程度上,搖瓶的裝液量對酶活影響較大。過少的裝液量不利于后期的中試生產的量產,降低企業的生產效率。由圖11可知,當裝液量為50 mL/250 mL時,發酵產酶活力最高,在裝液量超過50mL/250 mL時,酶的活性開始下降,不利于發酵產酶,故最佳裝液量為50 mL/250 mL。
2.2.10 接種量對發酵產酶的影響
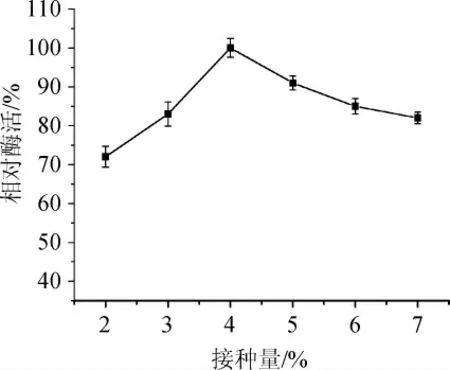
圖12 接種量對發酵產酶的影響Fig. 12 Effect of inoculum on enzyme production by fermentation
由圖12可知,在接種量從2%提高到4%,相對酶活迅速提高,當以4%~6%的接種量進行接種時,相對酶活力均高于90%,在接種量高于5%時發酵過程中菌密度過大菌株生長受抑制產酶量降低,當接種量為4%時,相對酶活最高。
2.3 Plackett-Burman設計篩選顯著因子
Plackett-Burman試驗設計結果與顯著性分析分別見表3和表4。由表4可知,葡萄糖、裝液量、溫度的P值均小于0.05,達到顯著水平,即影響值均大于95%,對試驗結果影響最顯著。
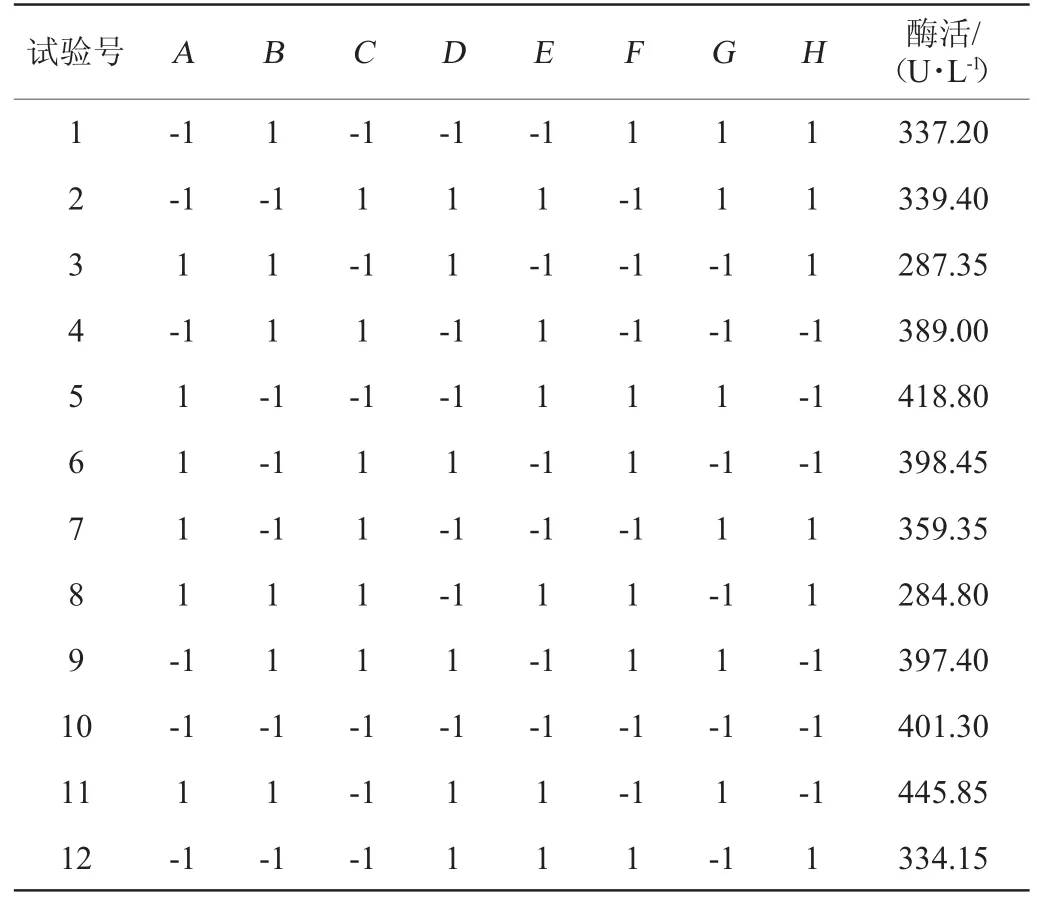
表3 Plackett-Burman試驗設計結果Table 3 Results of Plackett-Burman tests design

表4 Plackett-Burman試驗設計顯著性分析Table 4 Significance analysis of Plackett-Burman tests design
2.4 最陡爬坡試驗設計及結果
在完成PB試驗設計后,將葡萄糖和溫度的值按照步長依次減小,裝液量的值按照步長逐步增大,設計最陡爬坡試驗,結果見表5。由表5可知,當葡萄糖添加量為3.5%,溫度為28 ℃,裝液量為80 mL/250 mL時,微生物產甾醇酯酶活性最大。所以選擇以第2組實驗作為中心組合實驗的中心點,進行中心組合試驗設計。

表5 最陡爬坡試驗設計及結果Table 5 Design and results of the steepest ascent tests
2.5 響應面試驗設計
通過PB試驗和最陡爬坡試驗確定的3個顯著因素葡萄糖、裝液量和溫度后,再運用Design-Expert.V8.0.5b軟件,設計3因素3水平的BB試驗,響應面試驗結果見表6。
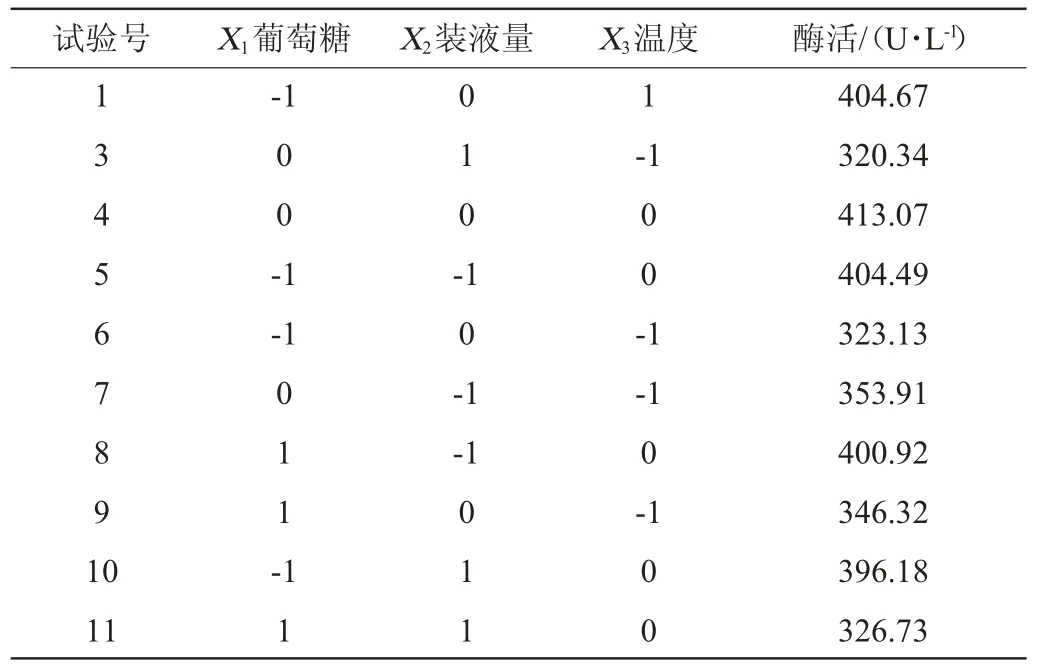
表6 發酵條件優化Box-Benhnken試驗結果Table 6 Results of Box-Benhnken tests for fermentation conditions optimization
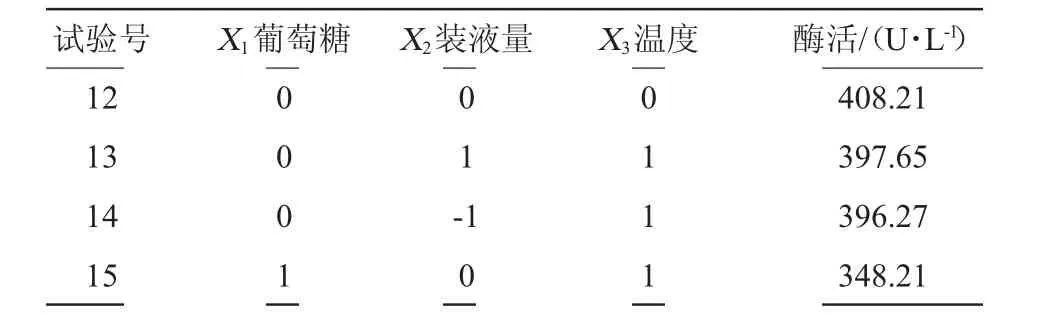
續表
通過Design-Expert.8.0.5b 軟件對中心組合試驗數據進行顯著性檢驗(見表7)和方差分析(見表8)。由此可以得到,菌株Q-06產甾醇酯酶酶活(Y)與影響發酵顯著因素之間的回歸方程如下:

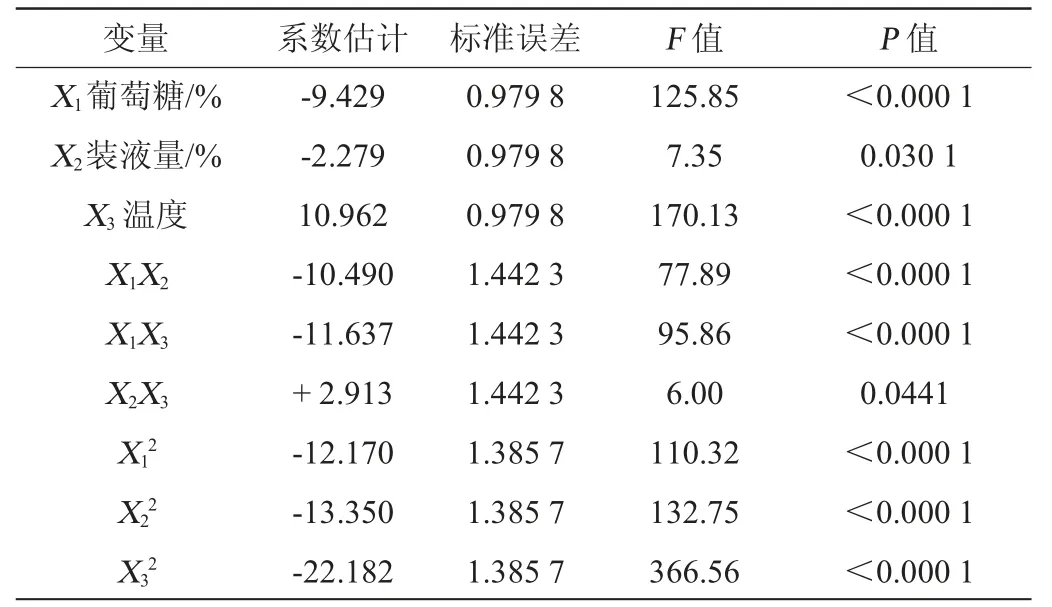
表7 回歸系數顯著性檢驗Table 7 Significance test of regression coefficients

表8 回歸方程的方差分析Table 8 Variance analysis of regression equation
由表7和表8可知,該設計中失擬項P>0.05,不存在失擬因素,因此,該模型有意義[14]。在回歸模型中,決定系數R2為99.37%,校正決定系數R2Adj為0.973 2,模型變異系數僅為2.68%。由此可以看出,該模型的擬合度較好,設計可靠。因此,可以使用該回歸方程代替試驗真實點分析和預測菌株實際發酵產酶結果。
統計軟件Design-Expert.V8.0.6對回歸方程進行分析,得響應面及等高線見圖13,通過對回歸方程進行分析,得到最佳工藝條件為,并根據實際操作條件調整為發酵溫度28 ℃、葡萄糖添加量3.0%、裝液量50 mL/250 mL,由優化前的360.00 U/L提高至479.64 U/L,是優化前的1.33倍。
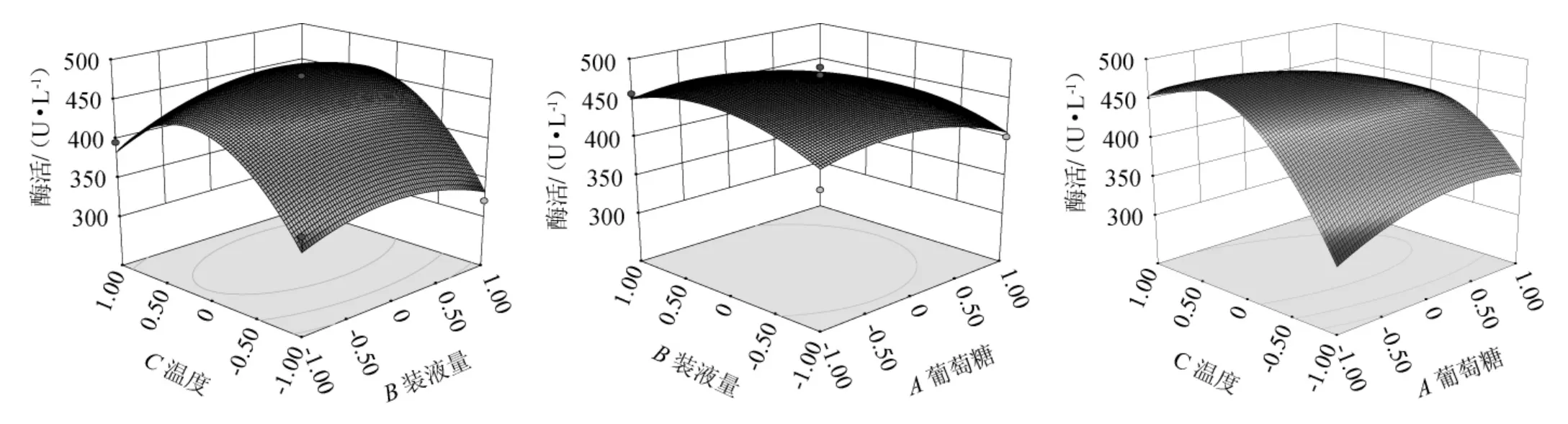
圖13 葡萄糖添加量、裝液量及溫度間交互作用對酶活性的影響的響應面及等高線Fig. 13 Response surfaces plots and contour lines of effects of interaction between glucose addition, loading volume and temperature on enzyme activity
3 結論
為了提高莓實假單胞菌(Pseudomonas fragi)Q-06產低溫膽固醇酯酶的能力,以單因素試驗為基礎,通過PB試驗設計響應面試驗,對菌株Q-06發酵產酶條件進行優化。結果表明,培養基配方中葡萄糖添加量3.0%,酵母粉添加量為1.3%,(NH4)2SO4添加量0.010%,MgSO4·7H2O添加量0.050%,KH2PO4添加量0.400%。最適宜發酵溫度為28 ℃,轉速180 r/min,接種量4%,初始pH 7.5,裝液量50 mL/250 mL。研究通過單因素及響應面法優化了發酵菌株發酵產酶的發酵條件。結果表明,發酵菌株Q-06產甾醇酯酶由優化前的360.00 U/L提高至479.64 U/L,是優化前的1.33倍。達到了優化目的,并為后續研究奠定了基礎。

