新型pH敏感型氧化錳納米探針的制備與表征
邢 新,司元純,陸依凡,許 瑞,陳喬爾,鄒多宏
與其他的成像方式,如CT、X線等相比,磁共振成像(magnetic resonance imaging,MRI)具有非電離、出色的空間及解剖分辨率等優勢[1]。然而MRI卻受到目標靈敏度低的限制。那么開發多種模式的納米探針就成為了解決這一問題的一種策略[2]。目前,癌癥仍然是當今死亡率最高的疾病之一[3]。MRI被廣泛地應用于腫瘤的診治,目前幾乎一半的MRI需要造影劑的參與[4],將納米探針與MRI技術結合,可以精確地定位腫瘤的部位[5];釓的復合物一直以來被廣泛的應用于此,然而釓離子具有潛在的毒性。因此,研究者們不斷地去開發低毒性、高靈敏度的基于其他順磁性金屬的納米探針[6]。該研究合成了一種錳基氧化物納米粒子(manganese oxide nanoparticles,MnO-NPs),它對pH響應,具有較高比表面積和低生物毒性,可以被開發成為新一代磁共振納米造影劑。
1 材料與方法
1.1 試劑與材料聚丙烯酸(poly acrylic acid,PAA)、谷胱甘肽(glutathione,GSH)購買自北京索萊寶科技有限公司;一水硫酸錳(manganese sulfate monohydrate,MnSO4·H2O)購買自上海阿拉丁公司;細胞計數試劑盒(cell counting kit-8,CCK-8)購買自日本同仁化學研究所。
1.2 儀器及其使用使用透射電子顯微鏡(JEM-2100F,日本JEOL公司)觀察樣品的形態;使用粒度分析儀(NanoBrook 90plus Zeta,美國Brookhaven公司)檢測樣品的粒徑大小;孔隙率分儀( TristarⅡ,3020M,美國Micromeritics公司) 測量樣品的氮吸附-脫附等溫曲線;X射線衍射儀(XRD,TTR-Ⅲ,日本Rigaku公司)分析晶體結構;熱重分析儀(TGA,Q5000IR,美國TA公司)對材料進行熱重分析;X射線光電子能譜分析儀(XPS,ESCALAB 250,美國Thermo公司)分析材料元素組成;使用電感耦合等離子發射光譜(ICP-OES,ICAP7200,美國Thermo公司)檢測錳離子的釋放;使用傅里葉變換紅外光譜儀(FTIR,iS10,美國Nicolet公司)檢測有機共價鍵;使用酶聯免疫檢測儀(MQX200,美國Bio-tek公司)檢測吸光度。
1.3 材料合成取0.5 g NaOH、0.1 g的GSH、1.0 g的PAA置于100 ml錐形瓶中,向其中加入10 ml無水乙醇和40 ml的超純水,在N2的保護下60 ℃反應20 min;隨后向其中加入1 ml 100 mg/ml的 MnSO4,繼續反應5 h,反應結束后以12 000 r/min的轉速離心5 min,收集離心產物,使用超純水洗滌3~5次后獲取氧化錳納米顆粒樣品。
1.4 MnO-NPs的表征取適量MnO-NPs分散于超純水中,使用超聲波震蕩形成懸浮液,將懸液滴于附有支持膜的銅網上,待液體揮發后將其置于透射電子顯微鏡下以觀察樣品的大小、形態、表面特性等。采用XRD、XPS、TGA、FTIR分別檢測該樣品。
1.5 弛豫效能檢測取0.5 g瓊脂糖粉末置于100 ml錐形瓶中,磁力攪拌下加熱到100 ℃,澄清透明后,降溫到80 ℃待用。取等量且適量納米材料,分別置于pH為7.4、5.5、4.5的PBS緩沖液中,37 ℃下震蕩24 h,分別用相應的PBS緩沖液稀釋到相等的合適濃度,分別取100、50、25、12.5、6.25、0 μl溶液置于200 μl離心管中,分別加入100、150、175、187.5、193.75、200 μl瓊脂糖凝膠。用移液槍吹打混勻后,置于4 ℃冰箱冷藏凝固,使用7.0 T磁共振掃描儀,檢測不同離心管的T1弛豫時間。使用ICP-OES測定Mn2+濃度。通過縱向馳豫值的倒數/Mn2+濃度的線性擬合,來計算縱向弛豫率。
1.6 Mn2+釋放研究取9只50 ml離心管,分編號為1~9,每組3只離心管,分成3組,分別加入39.5 ml pH為7.4、5.5和4.5的PBS緩沖液。取0.5 ml濃度為10 mg/ml納米材料分別分散于離心管中,置于37 ℃恒溫震蕩箱中,在5、15、30、60、90、180、360、720、1 440 min時各取1 ml液體分別置于9個2 ml離心管中,轉速為15 000 r/min,離心5 min,吸取0.5 ml上清液于5 ml離心管中,加入1.5 ml超純水和1 ml濃硝酸,震蕩搖勻后,靜置6 h,過0.45 μm的濾膜,濾液注入2 ml離心管中,靜置12 h后,使用ICP-OES檢測Mn2+的含量。
1.7 氧化錳的生物相容性研究將人牙齦成纖維細胞(human gingival fibroblasts,HGF)按照1×104個/孔接種于96孔板中,使用含有10%胎牛血清的DMEM高糖培養基培養。接種24 h后,使用PBS緩沖液洗滌細胞2遍,向其中加入不同濃度的MnO-NPs,共培養24、48 h之后使用CCK-8試劑盒檢測。
2 結果
2.1 MnO-NPs結構的表征透射電子顯微鏡觀察可見制得的氧化錳呈片形花瓣狀,尺度較為均一,合成的產物具有晶體結構,直徑約為5 nm;粒徑分布比較窄,其直徑約為100 nm(圖1A),其表面可見有一定數量的孔道(圖1C、D)。 該氧化錳顆粒的比表面積達到了231.01 cm3/g(圖2A),在孔直徑為1.6和12 nm時孔容積最大(圖2B)。粒度分析儀結果顯示,該納米顆粒具有較窄的粒徑,其水合粒徑約為400 nm(圖3A)。X射線衍射儀結果顯示所獲取的納米顆粒與Mn3O4的PDF卡片吻合,由此可知所獲取的氧化錳為Mn3O4(圖3B)。傅里葉變換紅外光譜儀結果顯示該納米粒子在波數為521.6和629.2 cm-1處具有明顯的吸收峰,這是分屬八面體Mn-O伸縮振動和四面體Mn-O伸縮振動(圖3C)。熱重分析從室溫(20 ℃)開始,以20 ℃/min的速度升溫,直至820 ℃,其結果顯示合成的氧化錳重量在20~150 ℃之間損失了3.33%,這部分主要是由于水分子的損失,在150~400 ℃之間損失了6.38%,這部分是由于有機物GSH以及PAA的損失。400 ℃ 以后重量趨于平穩,說明此時有機物已被完全去除(圖3D)。
X射線光電子能譜分析儀的結果如圖4所示,采用C1s結合能作為內標準,結果顯示該納米粒子中含有錳和氧元素。

圖1 氧化錳納米顆粒在不同倍數下的透射電鏡圖 A:×8 000;B:×40 000;C:×160 000;D:×160 000
2.2 不同pH下氧化錳納米顆粒的弛豫率在場強為7.0 T的磁共振掃描器中,測得在pH為7.4時,其縱向弛豫率為2.3 mmol-1·s-1,當pH為5.5時,其縱向弛豫率為6.3 mmol-1·s-1,而當pH為4.5時,則達到了13.0 mmol-1·s-1。氧化錳納米顆粒的縱向弛豫率與pH有著明顯的關聯,即pH越低,其縱向弛豫率越高(圖5A)。
2.3 Mn2+釋放研究在pH為7.4的PBS溶液中,Mn2+幾乎不泄露,此時的氧化錳納米顆粒是相對穩定的,當pH偏向酸性,在pH為5.5和4.5時,Mn2+釋放速度加快,但是其24 h釋放量也不足0.5%,說明該材料非常穩定(圖5B)。

圖2 孔隙率分析儀檢測 A:MnO-NPs的比表面積;B:MnO-NPs的孔直徑分布
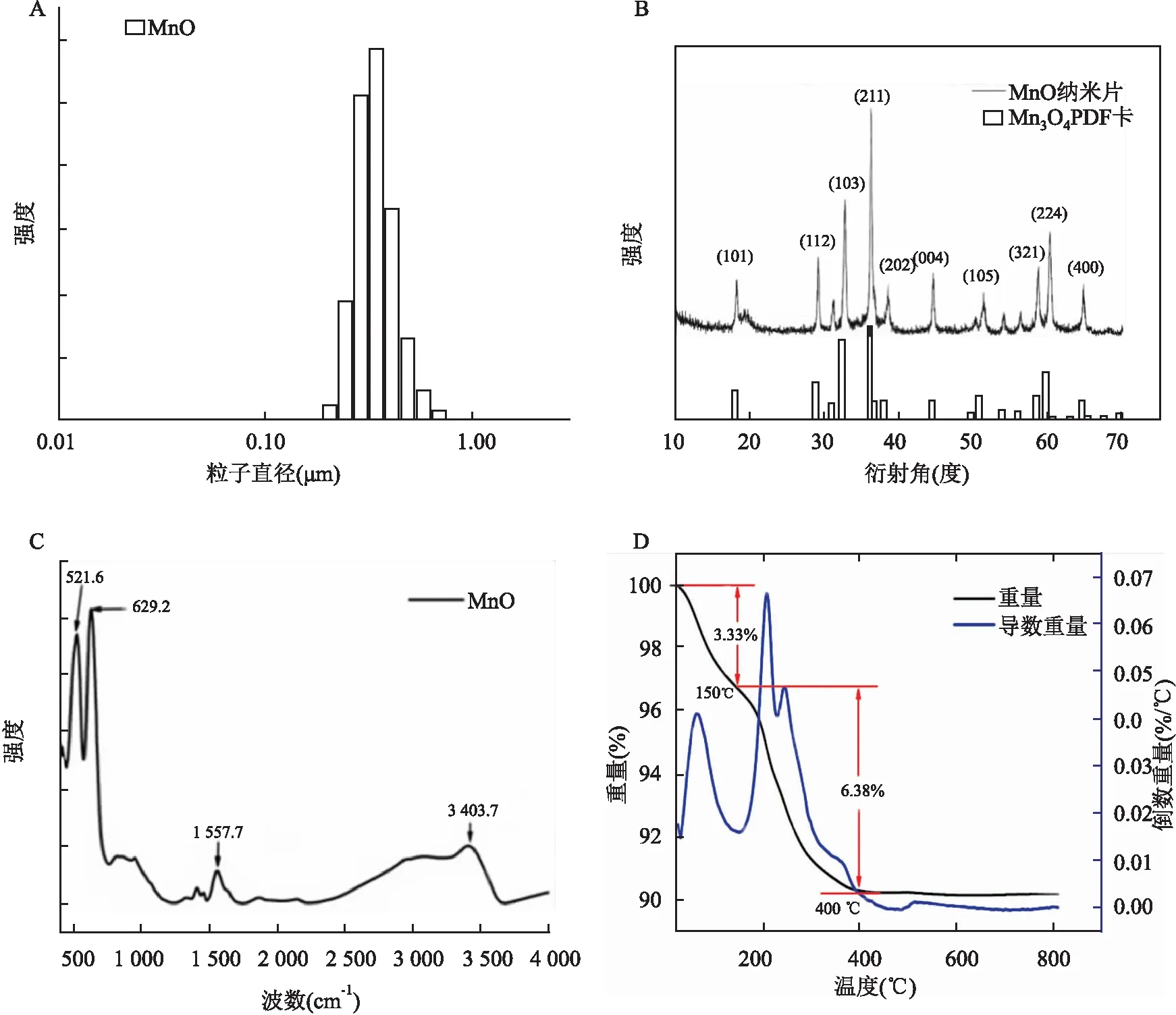
圖3 MnO-NPs的表征
2.4 氧化錳納米顆粒的細胞生物相容性研究為了驗證所合成的氧化錳納米顆粒是否具有細胞毒性,采用了CCK-8來對其進行檢測。使用不同濃度的氧化錳納米顆粒與HGF共同培養24、48 h,與對照組(氧化錳濃度為0 μg/ml)進行比較,所得結果進行單因素方差分析。結果可見,共同培養24 h情況下,與對照組相進行單因素比較,所有組別存活率差異無統計學意義(F=0.924,P>0.05);在共同培養48 h后,與對照組進行單因素比較,當濃度為16 μg/ml時,其存活率差異有統計學意義(P=0.038),但此時細胞存活率高于對照組細胞存活率,與對照組比較,其他濃度組結果差異無統計學差異(F=2.496,P>0.05);見表1、圖6。
3 討論
分子成像領域最熱點的話題就是要求非電離、非侵入性以及能夠實時監測細胞中所發生的分子事件[7]。而MRI則恰好具備有這些優點,因而它在臨床中擁有著非常廣泛的應用[8]。而MRI之所以可以成功,很大程度上是由于造影劑的使用,造影劑通過加速組織環境中質子的弛豫率從而增強MRI圖像中的信號[9]。

圖4 氧化錳顆粒的XPS結果

圖5 MnO-NPs的造影效能和穩定性檢測

表1 HGF與MnO-NPs共培養24 h和48 h細胞存活率

圖6 HGF與MnO-NPs共培養24 h和48 h細胞存活率
錳基化合物應用于造影劑已有了非常多的研究,例如二乙烯三胺五乙酸錳,錳的氧化物,Mn(Ⅱ)/Mn(Ⅲ)的雜化結構等[6,10-11]。通常情況下可以將錳基造影劑分為兩大類,即錳的氧化物以及Mn2+螯合物,但是由于Mn2+螯合物血液循環時間短并且容易在腦部堆積從而產生毒性,因此研究者們更多的將精力放在了錳氧化物上[12]。本研究所合成的納米粒子結合XPS和XRD的結果可證實為Mn3O4,其中錳的價態分別為二價和三價。低價態的錳離子相比較于Mn4+來說具有更高的造影效能,尤其是Mn2+。這是由于Mn2+的3D軌道上排列有5個未成對的電子,這可以產生較大的磁矩,并引起附近原子核的磁弛豫[13],因此成分為Mn3O4的MnO-NPs理論上就擁有更高的造影效能。PAA具有非常良好的生物相容性以及親水性[14];可以將它用作為pH響應聚合物來修飾納米顆粒。腫瘤微環境具有微酸的特點,本研究使用了pH響應聚合物PAA作為MnO-NPs的修飾劑,因此該納米粒子可能會具有pH敏感性,從而可以對腫瘤微環境響應,為了驗證其是否具有這一性能,在不同的pH條件下測定了它的弛豫效能。當pH為4.5時,該納米顆粒弛豫效能最高,其弛豫率達到了13.0 mmol-1·s-1,顯著地高于pH為5.5及7.4時的弛豫率,并且酸性條件下可見Mn2+釋放速率更快,因此MnO-NPs可以對pH響應。而另一方面,腫瘤的微環境除了微酸以外,還有著高濃度的GSH,有研究表明,高含量的GSH可以破壞Mn-O鍵,并且弱酸的環境可以促進Mn2+的釋放[15],從而該納米造影劑有望在腫瘤部位具有更高的造影效能。當納米造影劑注射入血管內之后其穩定性和生物毒性就成為了一個不可忽視的問題。與HGF共培養后,MnO-NPs并未對HGF產生明顯的生物毒性;同時這一氧化錳納米顆粒即便在pH達到4.5時,其24 h Mn2+釋放量也不足0.5%,這說明該材料穩定性和安全性較好,具有應用于人體的潛能。結合以上幾點,本研究所合成的這一新型氧化錳納米材料,有望作為一種酸敏造影劑應用于腫瘤的MRI檢測中。
具有靶向腫瘤藥物輸送功能的納米平臺可以增強抗癌藥的特異性,并且改善腫瘤部位的藥物濃度。本研究中,盡管未將這一新型氧化錳納米顆粒與抗癌藥負載,但是通過透射電子顯微鏡觀察可以發現其表面具有一定的孔道,同時孔隙率分析儀的結果也印證了孔道的存在,并且其水合粒徑約為200 nm,比較適合作為納米給藥平臺,將來也可以將其改良后與抗癌藥負載應用于此,從而成為一種具有診斷及給藥作用的全新納米探針。
在這項研究中,首先提出了一種新型花瓣狀氧化錳納米顆粒。通過透射電子顯微鏡直徑約為100 nm,隨后的X射線衍射儀檢測確定了所合成的材料為Mn3O4;弛豫效能檢測以及錳離子釋放研究表明了它具有酸敏造影劑應用的潛能;生物相容性檢測則說明了它幾乎無生物毒性,可以安全地應用于人體。本研究表明該氧化錳納米粒子結構穩定,生物相容性佳,對pH敏感,酸性條件下擁有著較高的弛豫效能。因而這一納米顆粒將可能作為一種新的納米造影劑應用于臨床,改良后甚至可以成為一個診療一體化的納米平臺從而擁有著更加廣泛的應用前景。

