透視溶液配制問題解題思路
沙林祥
配制一定溶質質量分數的溶液是溶液部分的重點實驗,也是初中化學中一個非常重要的定量實驗,而且該實驗在生產、生活中都有著廣泛的應用。現將溶液配制問題的解題思路歸納如下。
一、溶液配制的實驗步驟
找真題 就這么考!
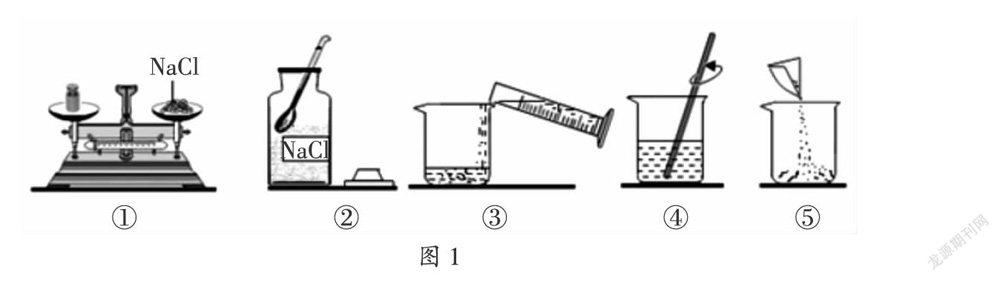
例1(2019·湖南·衡陽)某同學欲配制25 g 3%的NaCl溶液,整個操作過程如圖1所示。請回答下列問題:
(1)配制溶液的正確操作順序為 (填序號),其中操作錯誤的是 (填序號);
(2)用量筒量取液體時,讀數時視線要與量筒內 保持水平。
找思路 就這么想!
(1)配制25 g 3%的NaCl溶液,首先應計算配制溶液所需氯化鈉和水的質量,再稱量所需質量的氯化鈉、量取所需質量的水,最后進行溶解,故配制溶液的正確操作順序為:②①⑤③④,其中操作錯誤的是①,因為托盤天平的使用要遵循“左物右碼”的原則,步驟①中所示操作砝碼與藥品位置放反了;(2)用量筒量取液體時,讀數時視線要與量筒內凹液面的最低處保持水平。
答案:(1)②①⑤③④ ① (2)凹液面的最低處
找考點 必須得背!
找總結 就這么做!
此類試題主要考查溶液配制的全過程——計算、稱量、溶解、裝瓶,還考查了實驗的基本操作。解題時要將實驗的全過程、基本操作及注意事項牢記于心。
找變形 就這么活!
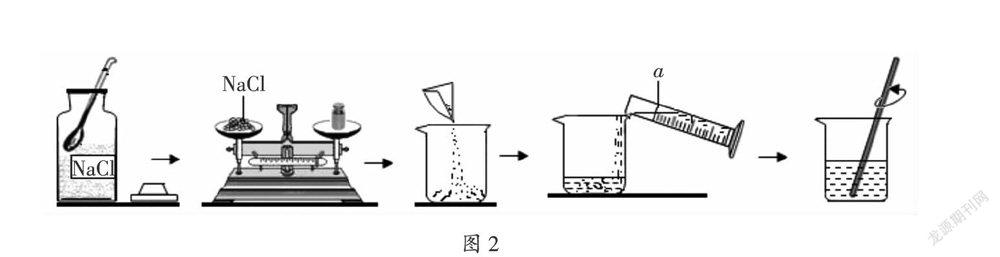
(2019·湖南·郴州)配制一定溶質質量分數的氯化鈉溶液的過程如圖2所示,回答下列問題:
(1)寫出圖中標號a儀器的名稱: ;
(2)配制50 g質量分數為15%的氯化鈉溶液,所需氯化鈉和水的質量分別為:氯化鈉 g,水 g;
(3)稱量氯化鈉時,氯化鈉應放在托盤天平的 (填“左”或“右”)盤;
(4)溶解過程中玻璃棒的作用是 ;
(5)把50 g 質量分數為15%的氯化鈉溶液稀釋成5%的氯化鈉溶液,需要水的質量是 g。
解析:(1)由圖示可知,標號a儀器的名稱是量筒;
(2)配制50 g質量分數為15%的氯化鈉溶液,需要氯化鈉的質量為:50 g×15% = 7.5 g,需要水的質量為:50 g - 7.5 g = 42.5 g;
(3)稱量氯化鈉時,氯化鈉應放在托盤天平的左盤;
(4)溶解過程中玻璃棒的作用是:攪拌,加快氯化鈉溶解的速率;
(5)設需要水的質量為x,則可列方程:50 g×15% = (50 g + x)×5%,解得:x = 100 g。
答案:(1)量筒 (2)7.5 42.5 (3)左 (4)攪拌,加快氯化鈉溶解的速率 (5)100
二、溶液配制的誤差分析
找真題 就這么考!
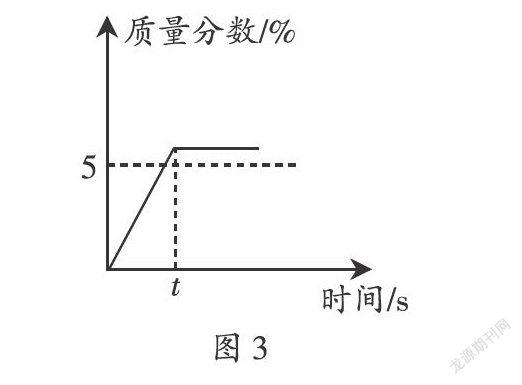
例2(2019·山西)某同學欲配制50 g質量分數5% 的KNO3溶液作為無土栽培所需的營養液,溶解過程中KNO3的質量分數隨時間變化關系如圖3所示,觀察圖象,分析形成這種結果的原因是( )。
A. 所用KNO3固體中含有水分
B. 用量筒量水時俯視刻度線
C. KNO3固體溶解前所用燒杯內有水
D. 配好的溶液裝瓶時部分液體灑落在試劑瓶外
找思路 就這么想!
由圖象可知,所配溶液的質量分數大于5%,即結果偏大。若所用KNO3固體中含有水分,會造成實際所取的溶質的質量偏小,則使溶質質量分數偏小;若量筒量水時俯視刻度線會造成實際量取的水的體積偏小,則使溶質質量分數偏大;若KNO3固體溶解前所用燒杯內有水,會導致溶劑質量偏大,則使溶質質量分數偏小;配好的溶液裝瓶時部分液體灑落在試劑瓶外,不會影響溶液的溶質質量分數。故本題答案為B選項。
找考點 必須得背!
1. 所配制溶液的溶質質量分數偏高的情況:所用的砝碼已生銹或沾有油污;用量筒量水時俯視量筒刻度線;量筒內的水傾倒時部分灑落等。
2. 所配制溶液的溶質質量分數偏低的情況:砝碼有殘缺;藥品和砝碼的位置顛倒(使用游碼);用量筒量水時仰視量筒刻度線;固體溶質不純;固體溶質在操作過程中有撒落;燒杯中原來有水等。
3. 無影響情況:將配制好的溶液倒入試劑瓶時不慎灑出瓶外等。
找總結 就這么做!
溶液的溶質質量分數與溶質和溶劑的質量有關,所以同學們在解答此類試題時要分析錯誤操作對溶質、溶劑的影響,進而判斷出溶液的溶質質量分數是偏大還是偏小。
找變形 就這么活!
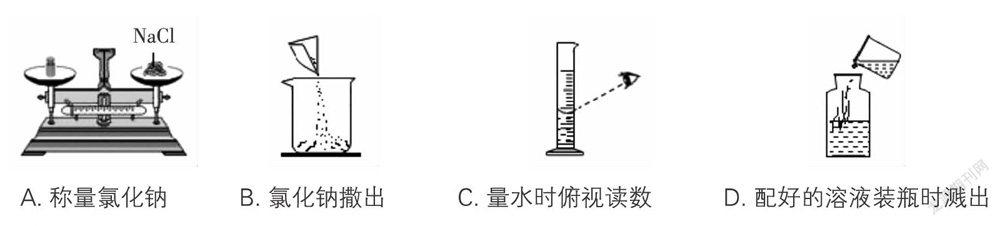
(2019·河南·新野三模)實驗室配制100 g溶質質量分數為12%的氯化鈉溶液的過程中出現以下錯誤操作(10 g以下用游碼),其中會造成所配溶液溶質質量分數偏大的是( )。
A. 稱量氯化鈉 B. 氯化鈉撒出 C. 量水時俯視讀數 D. 配好的溶液裝瓶時濺出
答案:C

