榴蓮瓤皮/果核提取物對銅在硫酸溶液中的緩蝕機理
胡毓哲,樊保民,劉 浩,范貴鋒,郝 華,楊 彪
(1.北京工商大學 材料與機械工程學院,北京100048;2.中國科學院 化學研究所,北京100190)
銅及其合金具有良好的熱/電傳導性、可加工性和較高的機械強度,被廣泛用于熱交換器、水/汽管網、制冷裝置等工業核心設備[1]。服役過程中,腐蝕產物與污垢易隨工作介質在設備表面沉積,形成銹/垢層,在影響生產效率的同時,還可能會造成嚴重的事故[2]。因此,需要定期使用特定的礦物酸(如硫酸)清洗工業設備以去除表面銹/垢沉積層;另一方面,若不采取必要的防護措施,用于清洗的酸溶液也會對設備基體產生強烈的電化學腐蝕。
使用緩蝕劑具有操作簡便、成本低且效率高等諸多優點,已經成為減緩金屬在各類介質中腐蝕的最常用方法之一[3-4]。有機緩蝕劑的分子結構中具有N、S、P和O等雜原子,不飽和鍵與共軛體系,易在金屬表面吸附并組裝形成保護層,具有較好的緩蝕效果,是近年來緩蝕劑研究的熱點。咪唑衍生物[5]、喹啉衍生物[6]、曼尼希堿[7]等常用作酸洗緩蝕劑,在有效清除銹、垢的同時,可使基材表面鈍化,有效保護金屬。然而,隨著環保理念的日益普及,開發環境友好型緩蝕劑已成為一個重要發展方向。提取植物組織內的有效成分,并以其為緩蝕劑減緩金屬腐蝕具有資源豐富、成本低且可生物降解等優勢,備受研究人員關注[8]。近年來,一些植物提取物相繼被開發用作金屬在腐蝕介質中的緩蝕劑,例如,銀杏葉[9]、散沫花[10]、冬青樹葉[11]、薄荷葉[12]。此外,從植物廢棄物,如核桃青皮[13]、荔枝皮/果核[14]、豆粕[15]、醋栗殼[16]中提取緩蝕劑對助推我國垃圾分類回收與資源高值利用具有顯著意義,而目前,關于從榴蓮瓤皮及果核中提取緩蝕劑以減緩銅在硫酸溶液中腐蝕的研究還鮮見報道。
計算化學的發展為從電子或原子尺度解釋緩蝕劑的緩蝕機理奠定了基礎。多數情況下,腐蝕介質中有機緩蝕劑可通過靜電作用、van der Waals力、電子轉移等形式吸附于金屬表面。借助基于密度泛函理論的量子化學計算可闡釋緩蝕劑分子的電子結構與前線軌道分布,明確其與金屬表面原子的可能作用位點。另一方面,使用分子動力學模擬可以明晰緩蝕劑分子在特定金屬表面的吸附構型與能量特征。因此,通過理論計算以深入探討腐蝕介質中緩蝕劑對金屬的緩蝕機理逐漸被研究人員重視。
本工作以榴蓮廢棄物(瓤皮與果核)為原料,使用乙醇浸提法提取有效成分,并以此為緩蝕劑,通過電化學測試研究其對純銅在0.5 mol/L H2SO4溶液中的緩蝕作用;結合表面分析技術,明確榴蓮瓤皮/果核提取物(DPSE)在銅表面的吸附規律;借助量子化學計算與分子動力學模擬,闡明DPSE對銅在0.5 mol/L H2SO4溶液中的緩蝕機理,以期為植物廢棄物的資源化利用提供有益參考。
1 試驗
1.1 試樣與溶液
榴蓮白色內瓤皮與果核為金枕榴蓮(原產地:泰國)剝離食用部分后的廢棄物,經去離子水洗凈、自然風干、50℃烘箱干燥3 h后浸入液氮凍干、取出、研磨得到干燥粉末(DPS,粒徑約300μm),將其置于干燥器中備用。無水乙醇、丙酮、濃硫酸(H2SO4,98%)產自北京化工廠,均為分析純。采用T3紫銅(純度:99.99%,江蘇揚州偉光機械廠)作試驗基材;使用稀釋后的H2SO4溶液(0.5 mol/L)作為腐蝕介質。
1.2 榴蓮瓤皮/果核提取物(DPSE)的制備與分析
將15 g DPS粉末置于三口瓶中,倒入450 mL體積分數為70%的無水乙醇溶液,25℃攪拌混合1 h,繼續于70℃回流提取5 h;濾去固形物,混入丙酮除去膠狀物后,70℃旋轉蒸發濃縮提取物,65℃真空干燥,得到淡黃色顆粒,即為提取物(DPSE,約1.6 g,產率10.7%)。使用i N10 MX型傅里葉變換紅外光譜儀(FTIR,美國Ther mo Nicolet公司)分別對DPS與DPSE進行分析,波數4 000~400 c m-1。
1.3 電化學測試
電化學試驗在Autolab PGSTAT302N型電化學工作站(瑞士Metrohm公司)上完成,采用三電極體系:有效面積1 c m2的純銅為工作電極,Ag/Ag Cl電極為參比電極,鉑網為輔助電極。試驗溶液為含不同 量DPSE(0,150,300,450,600 mg/L)的0.5 mol/L H2SO4溶液,試驗溫度為25℃。電化學測試前,采用耐水砂紙(400~2 000號)逐級打磨工作電極表面至鏡面,無水乙醇超聲清洗,丙酮擦拭后氮氣吹干,置于干燥器中備用。動電位極化測試掃描電位為-150~250 mV(相對開路電位),掃描速率為1 mV/s,根據腐蝕電流密度(Jcorr)計算緩蝕率(ηp),見式(1):
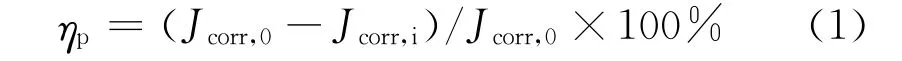
式中:Jcorr,0與Jcorr,i分別為試樣在未添加和添加緩蝕劑的硫酸溶液中的腐蝕電流密度,μA/c m2。
在開路電位下進行電化學阻抗譜(EIS)測試,頻率范圍為10 mHz~100 k Hz,交流振幅為10 mV,根據等效電路擬合得出電荷轉移電阻(Rct,Ω·c m2),并計算緩蝕率(ηe,%),見式(2):
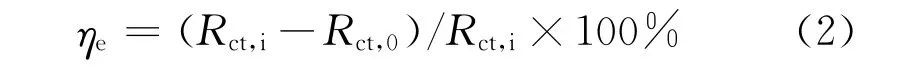
式中:Rct,0與Rct,i分別為未添加和添加緩蝕劑的H2SO4溶液的電荷轉移電阻,Ω·c m2。每個水平試驗設置三組平行試樣。
1.4 表面分析
將尺寸為1 c m×1 c m×1 c m的銅片按1.3節所述方法打磨至鏡面,分別浸泡在未添加與添加600 mg/L DPSE的0.5 mol/L H2SO4溶液中24 h,取出后采用無水乙醇超聲清洗,氮氣吹干后使用Quanta FEG 250型掃描電子顯微鏡(美國FEI公司)進行表面形貌觀察,加速電壓10 k V。
1.5 理論計算
利用Materials Studio 8.0軟件(美國BIOVIA公司)理論分析DPSE對銅的緩蝕機理。基于密度泛函理論,在Dmol3模塊下采用廣義梯度近似(GGA)的Perdew-Burke-Ernzerhof(PBE)泛 函DNP基組,引入隱性水溶劑模型(COSMO),對DPSE主要組分進行結構優化與能量分析,獲取最優構型、分子偶極矩(μ,Debye)、最高占據軌道(HOMO)、最低未占軌道(LUMO)分布及對應能量(EHOMO與ELUMO,e V)。基于Lukovits理論,根據式(3)~(5)計算得到能隙(ΔE,e V)、全局硬度(γ,e V)與絕對電負性(χ,e V)等量子化學描述符。
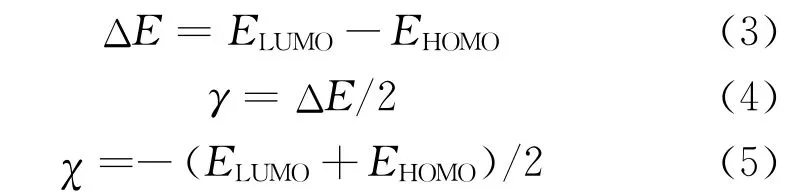
借助分子動力學模擬研究DPSE主要組分在銅表面的吸附機理。選取并切割Cu(111)面為吸附表面,包含5層Cu原子(模擬過程中“冷凍”),構建12×12超晶胞,拓展模擬空間為2.86×2.86×3.84 n m3,具有周期邊界條件,包含618個水分子(密度:1 g/c m3)、3個H3O+、3個SO42-與1個緩蝕劑分子;在Forcite模塊下,選擇NVT正則系統完成時長1 000 ps的動力學模擬,模擬時間步長1 fs,溫度設置為298 K(Nose恒溫器控制)。觀察最后100 ps的結果,輸出吸附平衡構型,并根據式(6)計算不同組分在Cu(111)面的相互作用能(Einter,kJ/mol)與結合能(Ebind,kJ/mol)。
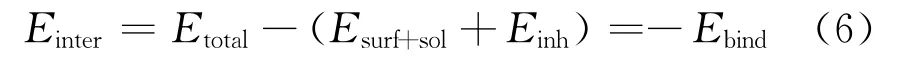
式中:Etotal為系統總能量,kJ/mol;Esurf+sol為Cu表面及溶劑的總能量,kJ/mol;Einh為緩蝕劑分子的能量,kJ/mol。
2 結果與討論
2.1 榴蓮瓤皮與果核提取物的表征
DPSE的主要成分為咪唑衍生物、有機酸與多元醇,其中具有顯著含量的化合物結構如圖1所示,即1-甲基-4-硝基-1 H-咪唑(AIC)、3,5-二羥基苯甲酸(DBA)與3-(芐 氧 基)丁 烷-1,2,4-三 醇(BBT)[17]。由2圖可見:3 402 c m-1處的寬吸收峰歸屬于醇羥基及伯氨基的伸縮振動;3 192 c m-1處的峰歸屬于羧酸基團上羥基的伸縮振動,同時對應羰基的伸縮振動峰出現在1 681 c m-1處;2 923 c m-1處的峰為-CH2-的伸縮振動峰,其彎曲振動峰位于1 455 c m-1處[16];1 650 c m-1處的峰為酰胺基團上羰基的伸縮振動峰;位于1 550 c m-1左右的吸收帶為苯環分子骨架的振動吸收帶[18];1 323 c m-1處的峰歸屬于C-N伸縮振動;1 035 c m-1處的峰為C-O的伸縮振動峰[13]。據此,從DPSE的FTIR譜圖中獲取的特征價鍵信息與圖1所列化學結構具有良好的對應關系。對比圖2中DPS與DPSE的譜圖發現,干燥粉末的譜圖缺少部分特征價鍵吸收峰。這是由于較多揮發性黃酮類化合物存在于DPS中,因這些化合物較強的“籠蔽效應”,在其FTIR譜圖中未能充分體現特定基團的吸收峰。
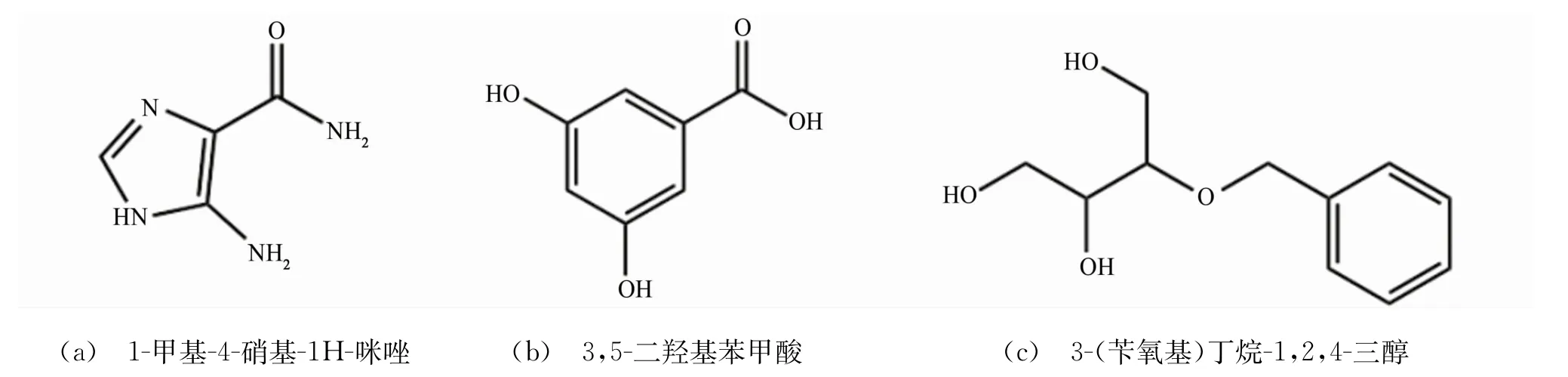
圖1 DPSE主要成分的結構式Fig.1 Chemical structures of main components of DPSE:(a)5-amino-1 H-imidazole-4-carboxamide(AIC);(b)3,5-dihydroxybenzoic acid(DBA);(c)3-(benzyloxy)butane-1,2,4-triol(BBT)
2.2 電化學行為
2.2.1動電位極化曲線
由圖3可見:加入DPSE后,銅在0.5 mol/L H2SO4溶液中腐蝕過程的陰、陽極反應均向低電流方向移動;同時表1也顯示Jcorr值隨DPSE量的增加而減小:當DPSE加入量為600 mg/L時,Jcorr降至0.62μA/c m2,緩蝕率達92.6%。這說明DPSE可有效吸附于銅表面,形成保護層,隔離腐蝕性離子與溶解氧,進而減緩腐蝕[19]。Ecorr值隨DPSE量的增加而略微負移,最大改變幅值僅為20.5 mV(小于85 mV),說明DPSE屬于陰極抑制為主的混合型緩蝕劑[20]。進一步觀察圖3與表1發現,所有極化曲線陰極線性部分近似平行且bc隨DPSE量的增加改變并不明顯,說明添加DPSE不改變腐蝕反應的陰極過程。然而,添加DPSE后,ba逐漸增大,說明陽極反應活性因緩蝕劑吸附而被顯著抑制。當DPSE加入量為450,600 mg/L時,陽極高電位區域出現斜率突然改變,這說明DPSE在銅表面吸附趨于飽和,部分緩蝕劑分子在高電位誘導下發生脫附。同時,當DPSE加入量高于600 mg/L時,Jcorr改變不顯著,也說明DPSE在金屬表面的吸附已趨于飽和。據此,600 mg/L可視為25℃下DPSE對銅在0.5 mol/L H2SO4溶液中的最佳緩蝕濃度。
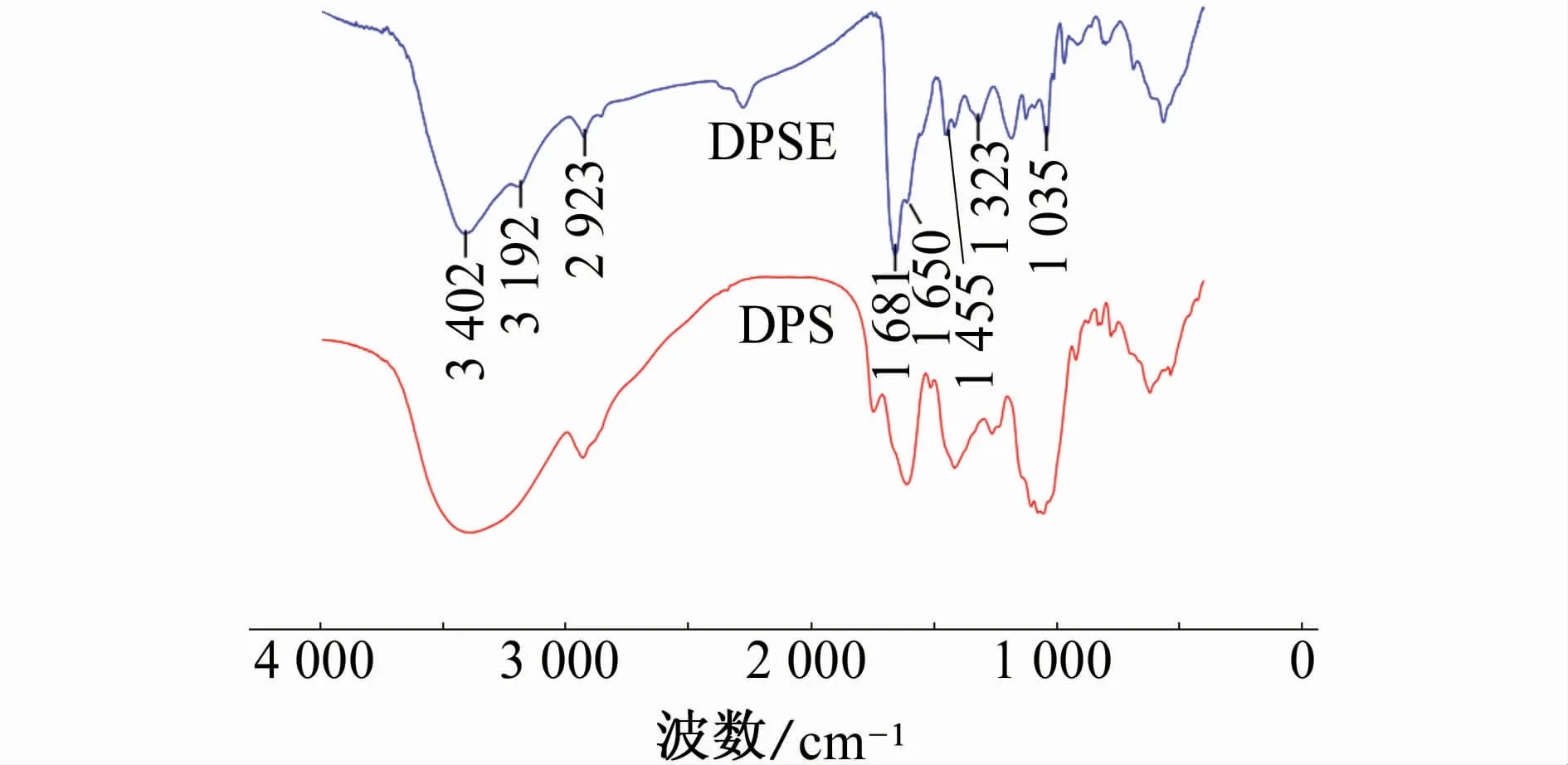
圖2 DPS與DPSE的紅外光譜Fig.2 Fourier transfor minfrared spectra of DPS and DPSE
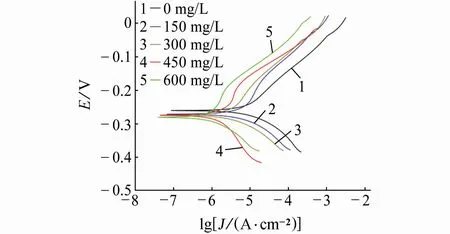
圖3 25℃下銅在含不同量DPSE的0.5 mol/L H2SO4溶液中的動電位極化曲線Fig.3 Potentiodynamic polarization curves of copper in 0.5 mol/L H 2SO4 solution containing different concentrations of DPSEat 25℃
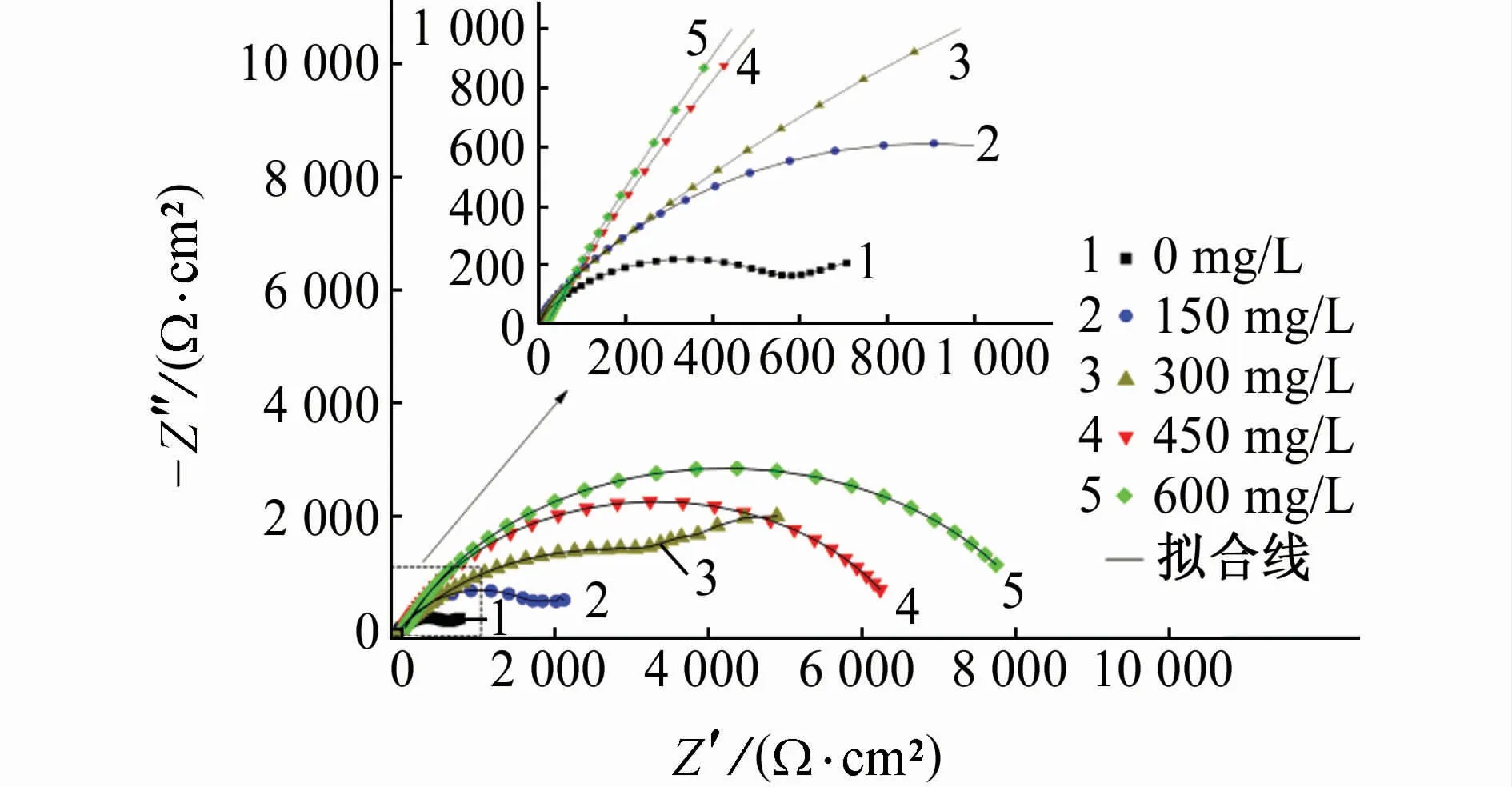
圖4 25℃下銅在含不同量DPSE的0.5 mol/L H2SO4溶液中的電化學阻抗譜Fig.4 EISof copper in 0.5 mol/L H2SO4 solution containing different concentrations of DPSEat 25℃
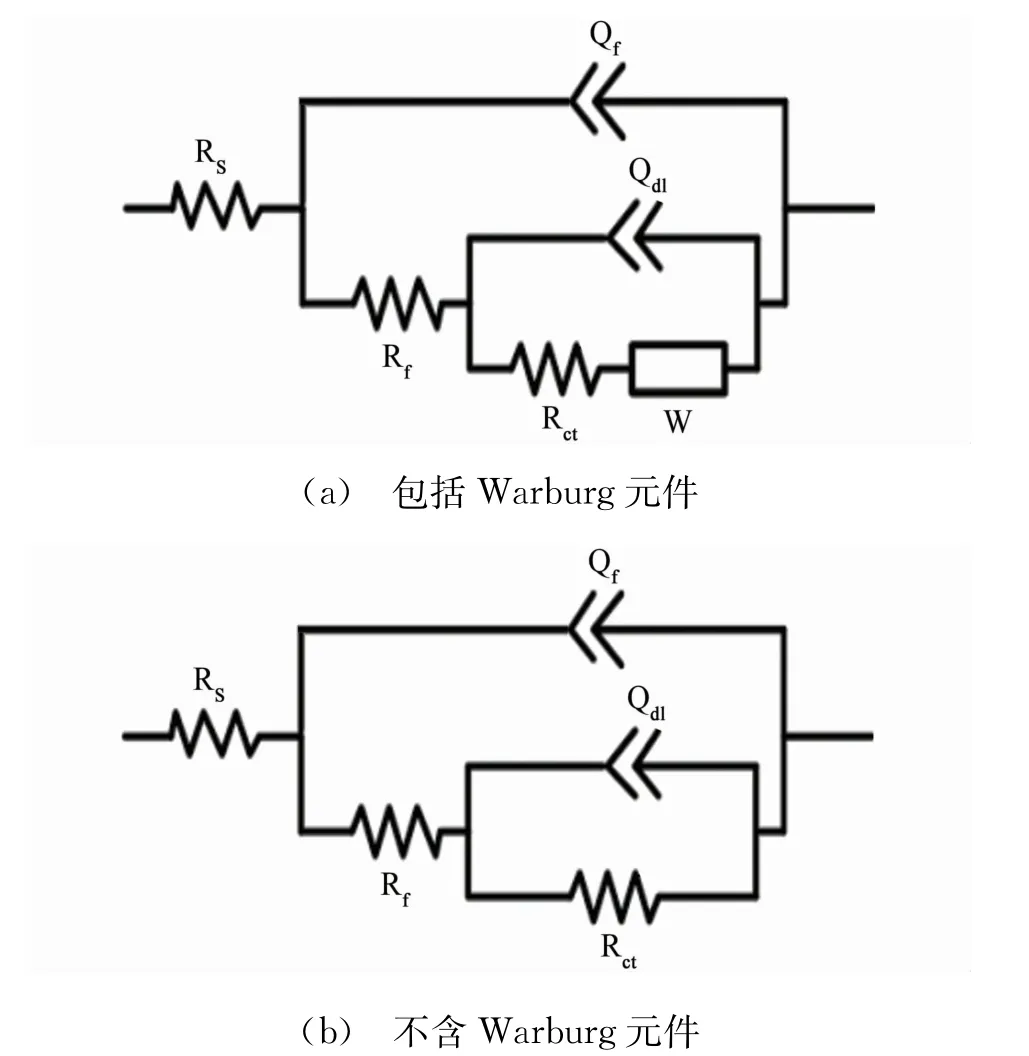
圖5 電化學阻抗譜擬合等效電路Fig.5 Equivalent circuits for the obtained impedance spectra:(a)with Warburg element;(b)withoutWarburg element
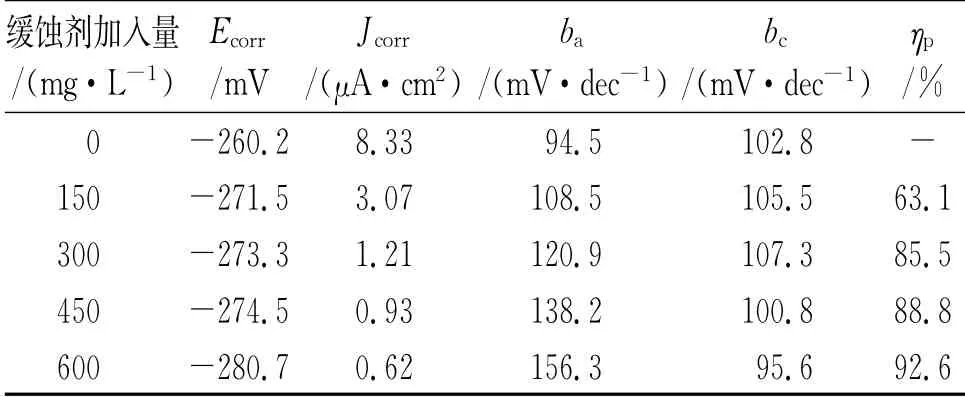
表1 極化曲線擬合結果Tab.1 Fitting results of polarization curves
2.2.2電化學阻抗譜
圖4所示為25℃下銅在含不同量DPSE的0.5 mol/L硫酸溶液中的電化學阻抗譜,采用圖5所示等效電路擬合得到溶液電阻(Rs)、膜電阻(Rf)、電荷轉移電阻(Rct)與War burg阻抗(W)等參數。此外,鑒于銅電極表面的固有粗糙度與不均一性,擬合過程中使用常相位角元件(Q)替代純電容(C),并通過式(7)計算得到膜電容(Cf)與雙電層電容(Cdl):
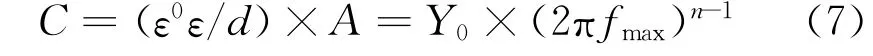
式中:ε0與ε分別為真空與吸附層介電常數,F/c m;d為吸附層厚度,c m;A為電極有效面積,c m2;Y0為比例系數,sn/Ω;fmax為最大頻率,Hz;n為相移指數。所有阻抗參數列于表2。
由圖4可見:加入DPSE后,所有Nyquist曲線在高頻區均呈現不規則容抗弧,說明DPSE僅抑制銅在腐蝕介質中的反應活性,不改變腐蝕反應機理[21]。銅在未添加與添加150,300 mg/L DPSE時的曲線于低頻區出現Warburg阻抗,說明在銅/溶液界面存在離子或溶解氧的擴散過程[22]。高頻區容抗弧的曲率半徑隨DPSE添加量的升高而逐漸增大,表明DPSE吸附于銅表面并逐漸形成均一防護層,致使發生電化學反應的電荷轉移電阻逐漸升高。值得注意的是,當DPSE質量濃度達到450 mg/L以上時,低頻區未出現Warburg阻抗,充分證明緩蝕劑分子在銅表面的吸附已趨于致密飽和,有效隔離金屬表面與腐蝕介質接觸,進而減緩陽極溶解過程。由表2可見:隨DPSE量的增加,Rf由10.2Ω·cm2(空白)升至202.1Ω·cm2(600 mg/L DPSE);同時,Rct由0.65 kΩ·cm2(空白)顯著提升至8.02 kΩ·c m2(600 mg/L DPSE),表明DPSE的吸附增加了銅在H2SO4溶液中發生電化學腐蝕的動力學電阻。另一方面,Cdl隨DPSE量的增加逐漸下降;由式(7)可知,DPSE在銅表面的吸附驅替了預先吸附的水分子及等離子,增加雙電層厚度的同時,降低其介電常數并減少電極活性面積,進而Cdl降低。
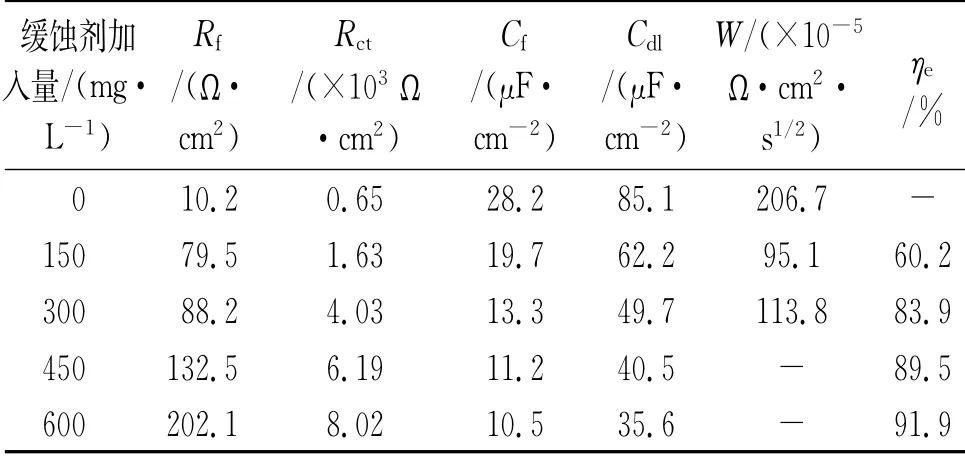
表2 電化學阻抗譜擬合結果Tab.2 Fitting results of EIS
綜合電化學分析的結果可得出推論:DPSE可有效減緩銅在0.5 mol/L硫酸溶液中的腐蝕,緩蝕率達92.6%;DPSE吸附于銅表面,同時抑制腐蝕反應的陰、陽極過程并顯著提升界面電荷轉移電阻。
2.3 吸附等溫式
通過吸附等溫式可以明確硫酸溶液中DPSE在銅表面的吸附機理。基于動電位極化所得緩蝕率,計算DPSE在銅表面的吸附覆蓋率(θ=ηp/100),并使用多種吸附等溫式進行擬合;本工作采用式(8)所示Langmuir等溫式進行擬合(R2=0.992),結果如圖6所示。擬合線斜率接近于1,說明DPSE以單分子層的形式在銅表面形成保護層,且吸附層內不同緩蝕劑分子間的相互作用可忽略。由式(9)可計算得到DPSE在銅表面的吸附自由能(ΔGads)為-33.5 kJ/mol。ΔGads為負值,說明DPSE在硫酸溶液中可自發吸附于銅表面。另一方面,若ΔGads大于-20 kJ/mol,認為吸附過程為物理吸附;若ΔGads小于-40 kJ/mol,則認為吸附過程為化學吸附[23]。H2SO4溶液中DPSE在銅表面吸附的ΔGads接近-40 kJ/mol,表明DPSE在銅表面的吸附是以化學吸附為主的混合型吸附[24]。
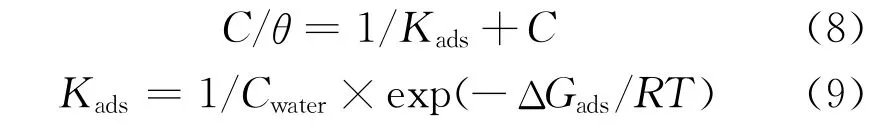
式中:C為緩蝕劑質量濃度,mg/L;Kads為吸附平衡常數;Cwater為水的質量濃度,1 000 g/L;R為普適氣體常數,8.314 J/(K·mol);T為熱力學溫度,K。

圖6 DPSE在銅表面的吸附等溫式Fig.6 Adsorption isother mof DPSE on copper surface

圖7 25℃下銅在不含和含600 mg/L DPSE的0.5 mol/L H2SO4溶液中浸泡24 h后的表面形貌Fig.7 Surface morphology of copper after immersion in 0.5 mol/L H2SO4 solution without(a)and with 600 mg/L DPSE(b)at 25℃for 24 h
2.4 表面形貌
由圖7可見:在不含緩蝕劑的25℃0.5 mol/L硫酸溶液中浸泡24 h后,銅表面出現大量坑與裂縫等嚴重的均勻腐蝕;在含600 mg/L DPSE的25℃0.5 mol/L H2SO4溶液中浸泡24 h后,銅表面較平整,未現明顯腐蝕跡象,且表面還可觀察到因機械拋光出現的劃痕。這表明DPSE可有效減緩銅在0.5 mol/L硫酸溶液中的腐蝕。
2.5 理論模擬
2.5.1量子化學計算
基于密度泛函的量子化學計算,在隱性溶劑模型(COSMO)下獲取DPSE主要成分AIC、DBA與BBT的最優分子構型、HOMO與LUMO軌道分布,從原子尺度解釋DPSE對銅在硫酸溶液中的緩蝕機理,結果如圖8所示。由圖8可見:AIC、DBA與BBT的最優分子構型均呈現平面結構,這有利于以平行取向吸附于金屬表面。由前線軌道理論可知[25],分子內HOMO區域具有較強供電子傾向,可向金屬原子空置d軌道提供電子形成化學鍵;而LUMO區域則具有較強的接收電子能力,可接收因界面電化學反應從金屬表面逸出的自由電子形成反饋鍵。
觀察圖8發現,AIC分子的HOMO與LUMO軌道貫穿于整個分子;DBA分子的HOMO軌道集中于羧基以外的部分,而LUMO則遍布分子整體;BBT分子的HOMO分布于端羥基以外的部分,而LUMO集中在具有缺電子效應的苯環部分。
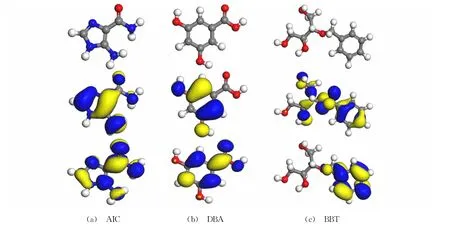
圖8 榴蓮瓤皮/果核提取物主要成分的最優空間構型(上)、HOMO(中)與LUMO(下)軌道分布Fig.8 Optimized structures(upper),HOMO(middle)and LUMO(lower)distributions of identified components in durian peel and stone
表3列出了AIC、DBA與BBT分子的全局量子化學描述符。一般認為緩蝕劑分子的EHOMO越高,其供電子能力越強;ELUMO越低,越易接收外界電子;能隙(ΔE)越小,緩蝕劑分子越易在金屬表面吸附形成保護層[26]。由表3可見:AIC分子的EHOMO最高(-5.16 e V),其向銅表面提供電子的能力最強;DBA分子的ELUMO最低(-2.56 e V),其接收銅表面自由電子的能力最強;同時,DBA分子的能隙最小(3.15 e V),且絕對電負性(4.14 e V)與偶極矩(8.21 Debye)最高,表明其傾向于在銅表面提供電子并產生分子極化以牢固吸附于金屬表面。根據軟硬酸堿理論,金屬被是軟酸,易與軟堿發生反應[27]。三種化合物的硬度(γ)均較小,同時具有得電子能力,可認作軟堿;因此,它們均可與銅表面原子發生反應,形成吸附層。
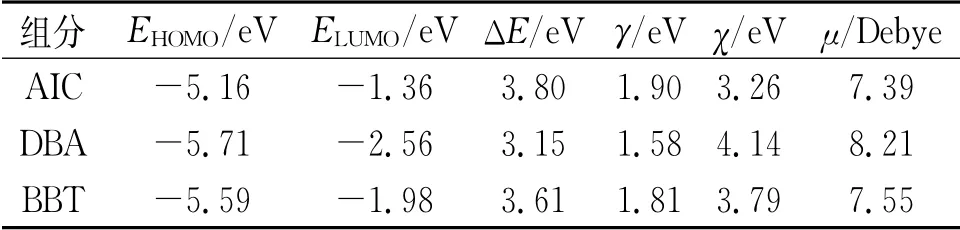
表3 榴蓮瓤皮/果核提取物主要成分的量子化學描述符Tab.3 Quantumchemical descriptors of the identified components in durian peel and stone
2.5.2分子動力學模擬
298 K條件下DPSE的三種主要成分在Cu(111)面吸附過程的動力學模擬結果如圖9所示。由圖9可知,溶液環境中AIC、DBA與BBT均以平行的分子構象吸附于銅表面,這與上述基于量子化學計算結果得出的推論保持一致。同時,三種化合物分子平行吸附于金屬表面有利于最大限度地覆蓋活性反應位點,進而有效抑制腐蝕反應[28]。緩蝕劑在金屬表面的吸附強度可用相互作用能(Einter)與結合能(Ebind)評價,三種化合物在Cu(111)面吸附的相關能量列于表4。由表4可知,AIC、DBA與BBT在Cu(111)面吸附的Einter值均為負數,表明三種分子在銅表面的吸附均屬于熱力學有利過程[29];同時,吸附過程的Ebind均較高,說明三種分子均可牢固吸附于Cu(111)面。對比不同分子的Ebind值發現,DBA分子的最高,其在銅表面的吸附最穩定,這與基于量子化學描述符得出的結論相互吻合。
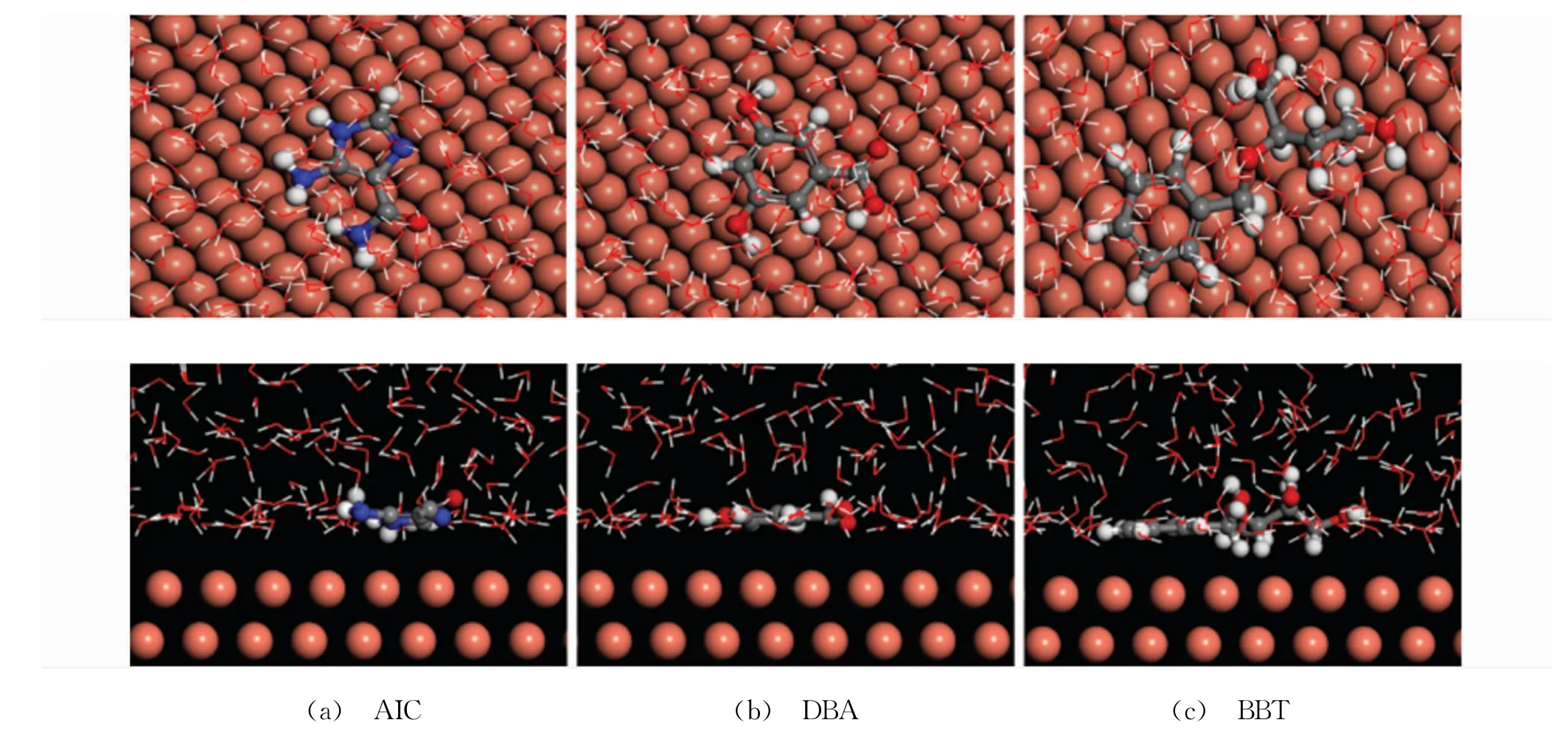
圖9 298 K下DPSE的三種主要成分在Cu(111)面的平衡吸附構型的頂(上)、側(下)視圖Fig.9 Equilibriumadsorption configuration for different components of durian peel and stone extract on Cu(111)plane at 298 K

表4 DPSE的三種主要成分在Cu(111)面的相互作用能與結合能Tab.4 Interaction energy and binding energy for different components of DPSEon Cu(111)plane
3 結論
(1)榴蓮瓤皮/果核提取物(DPSE)含有較豐富的端羥基、氨基、羧酸與酰胺基團,主要組分對純銅在0.5 mol/L H2SO4溶液中具有顯著的緩蝕作用;緩蝕效果隨DPSE量的增加而增強,當DPSE加入量為600 mg/L時,緩蝕率可達92.6%。
(2)DPSE主要以化學吸附的形式組裝于銅表面,符合Langmuir吸附等溫式,可同時抑制銅在H2SO4溶液中腐蝕的陰、陽極過程,減小腐蝕電流密度并顯著增強界面電荷轉移電阻,屬于陰極抑制為主的混合型緩蝕劑。
(3)DPSE的三種主要組分的最優構型與前線軌道分布利于它們以平行取向吸附于銅表面,其中以3,5-二羥基苯甲酸的吸附最穩定(Ebind=393.23 kJ/mol)。

