多環咪唑啉緩蝕劑的合成及其緩蝕作用
張晨峰,扈俊穎,鐘顯康
(西南石油大學 石油與天然氣工程學院,成都610500)
在油氣田開采過程中,地層水礦化度高、p H低等因素會對井筒、管道等造成較為嚴重的腐蝕[1]。為抑制管道腐蝕,最常用的方法是加入緩蝕劑。目前的研究主要針對咪唑啉緩蝕劑、酰胺類緩蝕劑、喹啉類緩蝕劑和季銨鹽類緩蝕劑等,這些緩蝕劑多為有機緩蝕劑[2-4]。大多數有機物緩蝕劑含有O、N、P、S等元素,起到吸附在金屬表面的作用。基于目前的研究進展,發現咪唑啉衍生物在CO2環境中具有良好的緩蝕作用,普遍認為咪唑啉環上N原子可以與鐵軌道上的空d軌道結合,增強緩蝕劑分子在鋼表面的吸附,從而提高緩蝕率。咪唑啉緩蝕劑作為綠色緩蝕劑,經濟高效,安全低毒,在管道防腐蝕方面應用廣泛[5-6]。
本工作主要通過引入多個咪唑啉環增強吸附性能,改善緩蝕劑的緩蝕性。首先合成雙子咪唑啉和具有四個環的咪唑啉緩蝕劑,采用失重法、電化學法,形貌觀察等評價了自制緩蝕劑的性能,以期為其推廣應用提供理論基礎。
1 試驗
1.1 緩蝕劑的合成與表征
將0.1 mol月桂酸和50 mL二甲苯加入四口燒瓶中,采用加熱套加熱至90℃時,用恒壓分液漏斗滴入0.06 mol四乙烯五胺,繼續升溫至140℃,直至分水器中沒有明顯的水產生,表明酰胺化反應完成,再采用梯度升溫法升溫至240℃進行環化反應,反應6~8 h,合成雙環月桂酸咪唑啉緩蝕劑(SAI),SAI呈深棕色粘稠狀液體,易溶于有機溶劑。
將0.05 mol癸二酸,0.06 mol四乙烯五胺和50 mL二甲苯加入四口燒瓶中,升溫至140℃至分水器中沒有明顯的水產生,停止加熱后加入0.1 mol月桂酸至燒瓶中,重新升溫至140℃,反應時間為2~4 h,采用梯度升溫法升溫至240℃,反應時間為6~8 h,合成四環月桂酸咪唑啉緩蝕劑(LAI)。LAI為深黃色粘稠狀液體,易溶于有機溶劑。2種緩蝕劑的結構式見圖1。
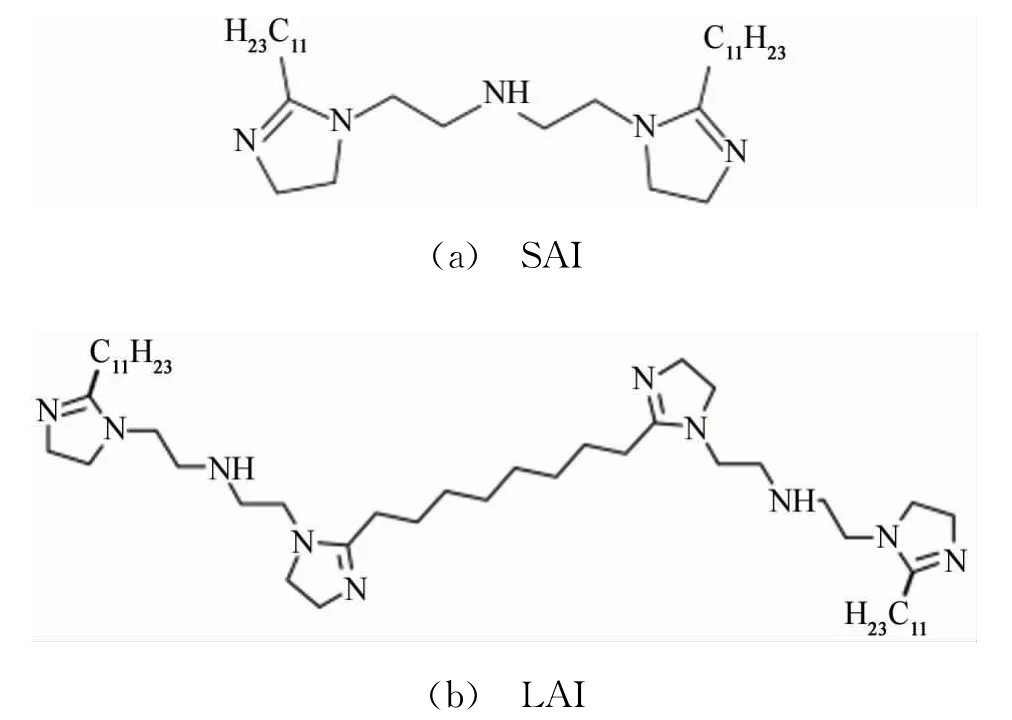
圖1 SAI和LAI的結構式Fig.1 Structural for mula of SAI(a)and LAI(b)
采用紅外光譜對SAI和LAI這2種緩蝕劑進行表征,結果見圖2。由圖2(a)可見,3 286 c m-1處為N-H伸縮振動峰;2 925 c m-1和2 852 c m-1處分別為CH3-和CH2-的伸縮振動峰;1 647 c m-1處為C=N雙鍵伸縮振動吸收峰;1 544 c m-1處為CN單鍵伸縮振動峰。由圖2(b)可見,3 303 c m-1處為N-H伸縮振動峰;2 925 c m-1和2 852 c m-1處分別為CH3-和CH2-的伸縮振動峰;1 647 c m-1處為C=N雙鍵伸縮振動吸收峰;1 550 c m-1處為C-N單鍵伸縮振動峰,這與之前的文獻報道一致[17],證明本工作合成的是咪唑啉衍生物SAI和LAI。

圖2 SAI(a)和LAI(b)的紅外光譜圖Fig.2 Infrared spectrums of SAI(a)and LAI(b)
1.2 緩蝕劑的性能評價
1.2.1失重法
試驗材料為L360鋼(下同),將其加工成40 mm×13 mm×2.5 mm的試片,試驗前用丙酮和乙醇去除試片表面油污,用N2吹干后稱量并測量尺寸,每組試驗用3個平行試樣。試驗溶液為含不同量緩蝕劑的模擬地層水溶液,試驗溫度為60℃,試驗時間為72 h。試驗前,向試驗溶液中通入N2以去除溶液中的O2,試驗過程中,持續通入CO2。試驗結束后,使用去膜液去除試片表面腐蝕產物,用乙醇清洗干凈后,吹干稱量,并按式(1)計算腐蝕速率[7]。模擬地層水的離子含量見表1。
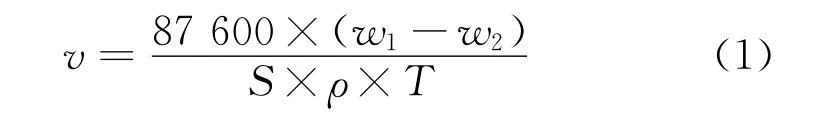
式中:w1和w2分別為試驗前后試片的質量;S為試片浸入溶液中的總表面積;ρ為試片密度;T為試驗時間。用式(2)計算緩蝕率:

式中:v0和v1分別為試片在未添加和添加緩蝕劑試驗溶液中的腐蝕速率。

表1 模擬地層水的化學成分Tab.1 Chemical composition of simulated for mation water mg/L
1.2.2電化學法
電化學試驗在CS310 H電化學工作站上完成。采用三電極體系,試樣工作面積為1 c m2,非工作面用環氧樹脂封裝,輔助電極為鉑電極,參比電極為飽和甘汞電極(SCE),試驗前試樣工作面用砂紙(600~1 200號)逐級打磨。電化學阻抗頻率為10-2~105Hz,交流幅值為10 mV,采用式(3)計算由電化學阻抗譜法測得的緩蝕率[8]。極化曲線掃描范圍為-0.15~0.2 V,掃描速率為20 mV/min,采用式(4)計算由極化曲線法測得的緩蝕率。
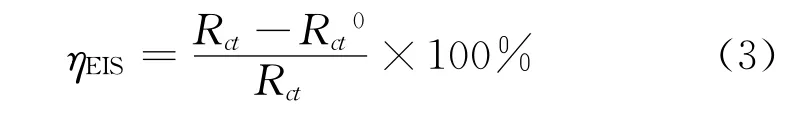
式中:Rct0和Rct分別為加入緩蝕劑前后的電荷轉移電阻。

式中:J0和J分別為加入緩蝕劑前后的腐蝕電流密度。
1.2.3形貌觀察和成分分析
利用掃描電子顯微鏡(SEM)觀察試片在不含和含緩蝕劑試驗溶液中腐蝕后的表面形貌,以判斷不同的腐蝕類型。通過EDS分析腐蝕產物組成和緩蝕劑的吸附情況。
2 結果與討論
2.1 失重法
由表2可見:在不含緩蝕劑的試驗溶液中,試片腐蝕速率高達0.473 mm/a,試片出現嚴重腐蝕。隨著緩蝕劑的加入,試片的腐蝕速率明顯降低,基本控制在0.1 mm/a以內,這說明SAI和LAI都具有良好的緩蝕效果。當緩蝕劑的加入量為400 mg/L時,SAI與LAI達到最高緩蝕率,分別為88.58%和93.87%。在加注量相同的條件下,相比SAI緩蝕劑,LAI緩蝕劑的抑制腐蝕效果更好。

表2 試樣在含不同量緩蝕劑的CO2模擬地層水環境中的腐蝕速率及SAI和LAI的緩蝕率Tab.2 Corrosion rates of samples in simulated for mation water containing different content of inhibitor under saturated CO2 condition and the inhibition rates of SAI and LAI
2.2 電化學阻抗譜
由圖3可見,Nyquist圖譜中,容抗弧呈現扁平的半圓形,這主要是因為電極表面的不均勻性和電極表面活性位點分布。試驗結果顯示,在未加緩蝕劑的試驗溶液中,容抗弧半徑最小,電極受CO2腐蝕嚴重。根據相關文獻報道,容抗弧半徑越大,緩蝕劑的緩蝕作用越好[9-10]。加入SAI和LAI后,容抗弧半徑隨緩蝕劑量的增加而增大,且都在緩蝕劑加入量為400 mg/L時達到最大。
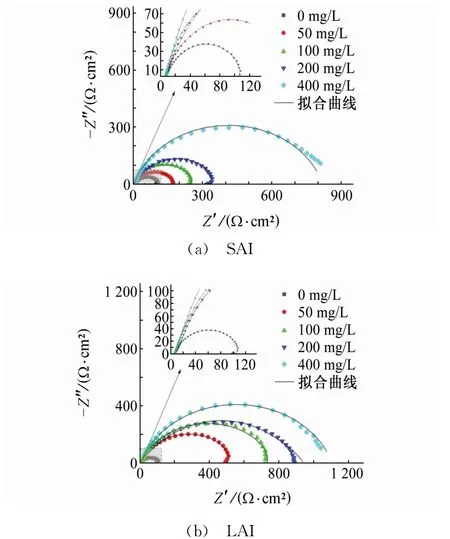
圖3 試樣在含不同量緩蝕劑試驗溶液中的電化學阻抗譜Fig.3 EISof samples in simulated for mation water containing different content of SAI(a)and LAI(b)
圖4為電化學阻抗譜的等效擬合電路,其中圖4(a)為不含和含高濃度緩蝕劑條件下的阻抗譜擬合電路,圖4(b)為含低濃度緩蝕劑條件下的阻抗譜擬合電路。圖4中,Rs為溶液電阻,Rct為電荷轉移電阻,CPE為常相位角元件,RL為電阻,L為電感元件。由于彌散效應的存在,常用CPE代替理想電容[11]。
由表3可見:隨著SAI和LAI量的增加,電荷轉移電阻增大,說明緩蝕劑主要通過控制電荷轉移電阻的方式來抑制金屬腐蝕,緩蝕劑分子取代水分子在鋼表面形成了一層吸附膜。當緩蝕劑加入量為4 00 mg/L時,SAI和LAI的緩蝕率達到最大,分別為86.32%和89.94%,LAI的緩蝕性能比SAI的更好。

圖4 不同條件下電化學阻抗譜的等效電路圖Fig.4 Equivalent circuit diagrams of EISunder different conditions:(a)without or containing high concentrations of inhibitor;(b)containing low concentrations of inhibitor

表3 電化學阻抗譜的擬合結果Tab.3 Fitting results of EIS
2.3 極化曲線
由圖5和表4可見:相比于不含緩蝕劑的空白溶液,加入緩蝕劑后,陽極和陰極塔菲爾斜率ba和bc明顯減小,這表明緩蝕劑同時抑制了電極表面的陽極和陰極反應,腐蝕電流密度也相應降低。此外,加入緩蝕劑后,自腐蝕電位有所上升,但電位變化小于±85 mV,說明這兩種緩蝕劑都為混合型緩蝕劑,且以抑制陽極反應為主[12]。
加入緩蝕劑后,SAI和LAI在試樣表面形成了膜,隨著緩蝕劑量的增加,膜層變得更加致密,使試樣的腐蝕速率下降,緩蝕率上升,且在緩蝕劑加入量為400 mg/L時達到最大值。LAI與SAI的主要區別為咪唑啉環數不同,可以推測隨咪唑啉環數的增加,緩蝕劑的吸附性增大。同時較長的碳鏈起到疏水基的作用,綜合影響下,膜的致密性和吸附性得到增強。
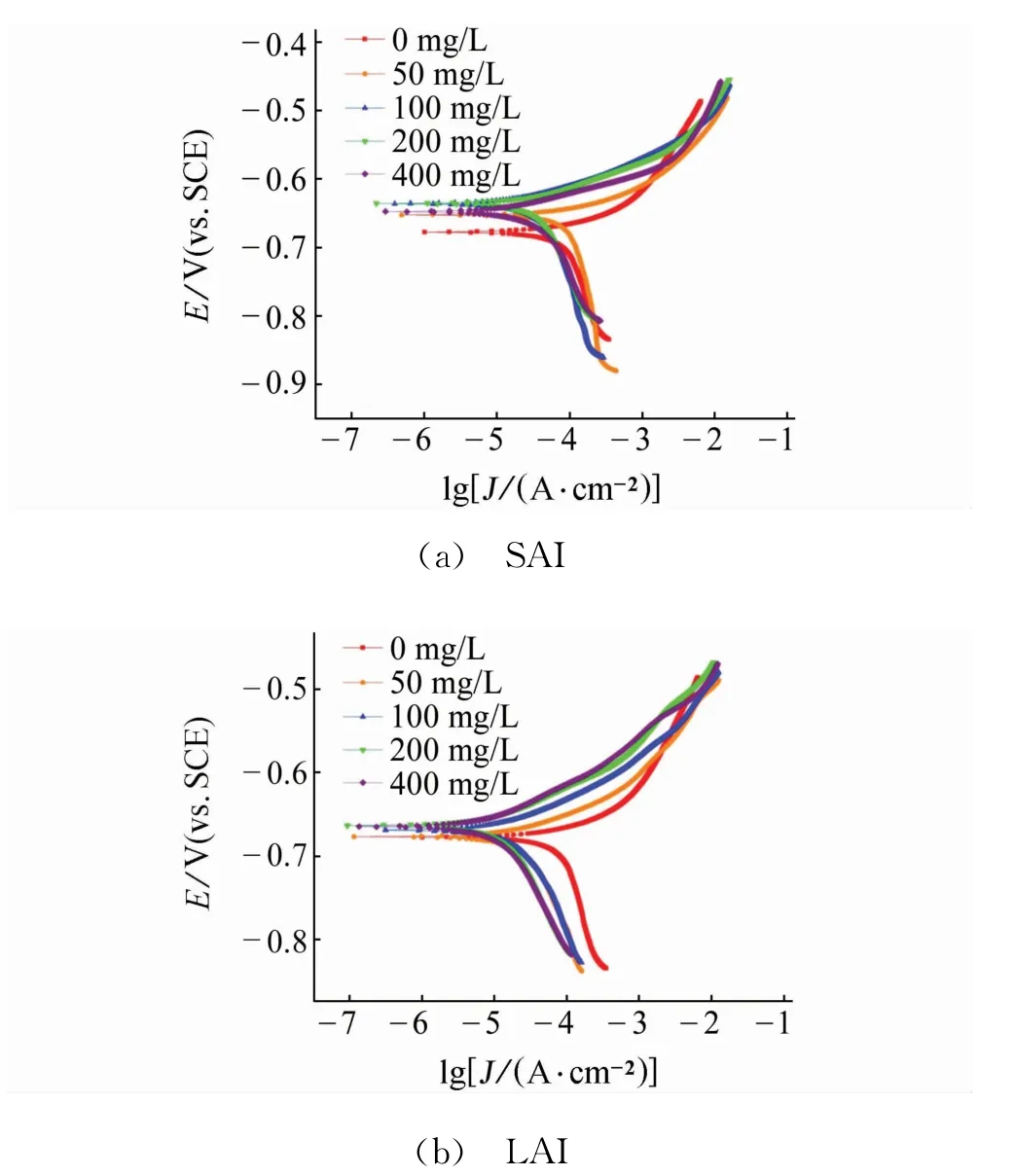
圖5 試樣在含不同量緩蝕劑試驗溶液中的極化曲線Fig.5 Polarization curves of samples in simulated for mation water containing different content of SAI(a)and LAI(b)
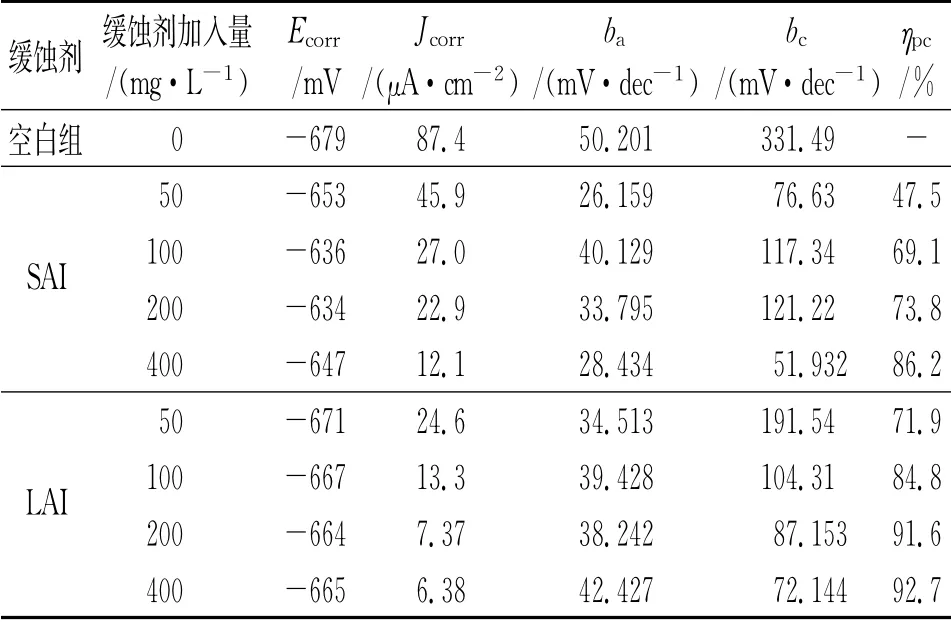
表4 極化曲線擬合結果Tab.4 Fitting results of polarization curves
2.4 吸附等溫曲線
大部分有機緩蝕劑都是吸附型緩蝕劑,主要的吸附類型有物理吸附、化學吸附和兩者共同作用。利用吸附等溫模型,可以研究緩蝕劑的吸附方式,Freundlich,Langmuir和sips isother m都是常見的吸附模型[13]。
通過對兩種緩蝕劑的試驗數據進行等溫吸附曲線擬合,發現Langmuir吸附等溫模型的擬合結果較好,見圖6。Langmuir等溫吸附公式為[14]
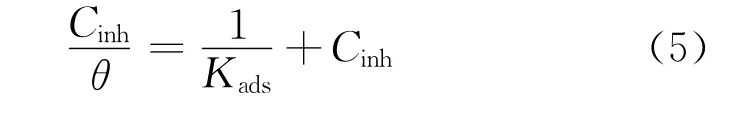
式中:Cinh為緩蝕劑濃度,mol·L-1;θ為覆蓋率,%;Kads為吸附平衡常數。由上式可以計算出吸附平衡常數Kads,再通過公式(6)可以計算得到吉布斯自由能ΔGads。
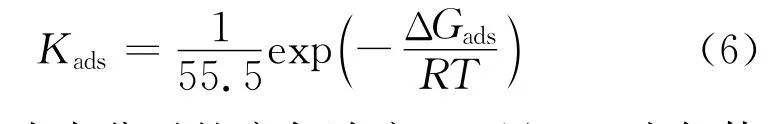
式中:55.5為水分子的摩爾濃度,mol/L;R為氣體常數,8.314 J/(mol·K);T為溫度,K。
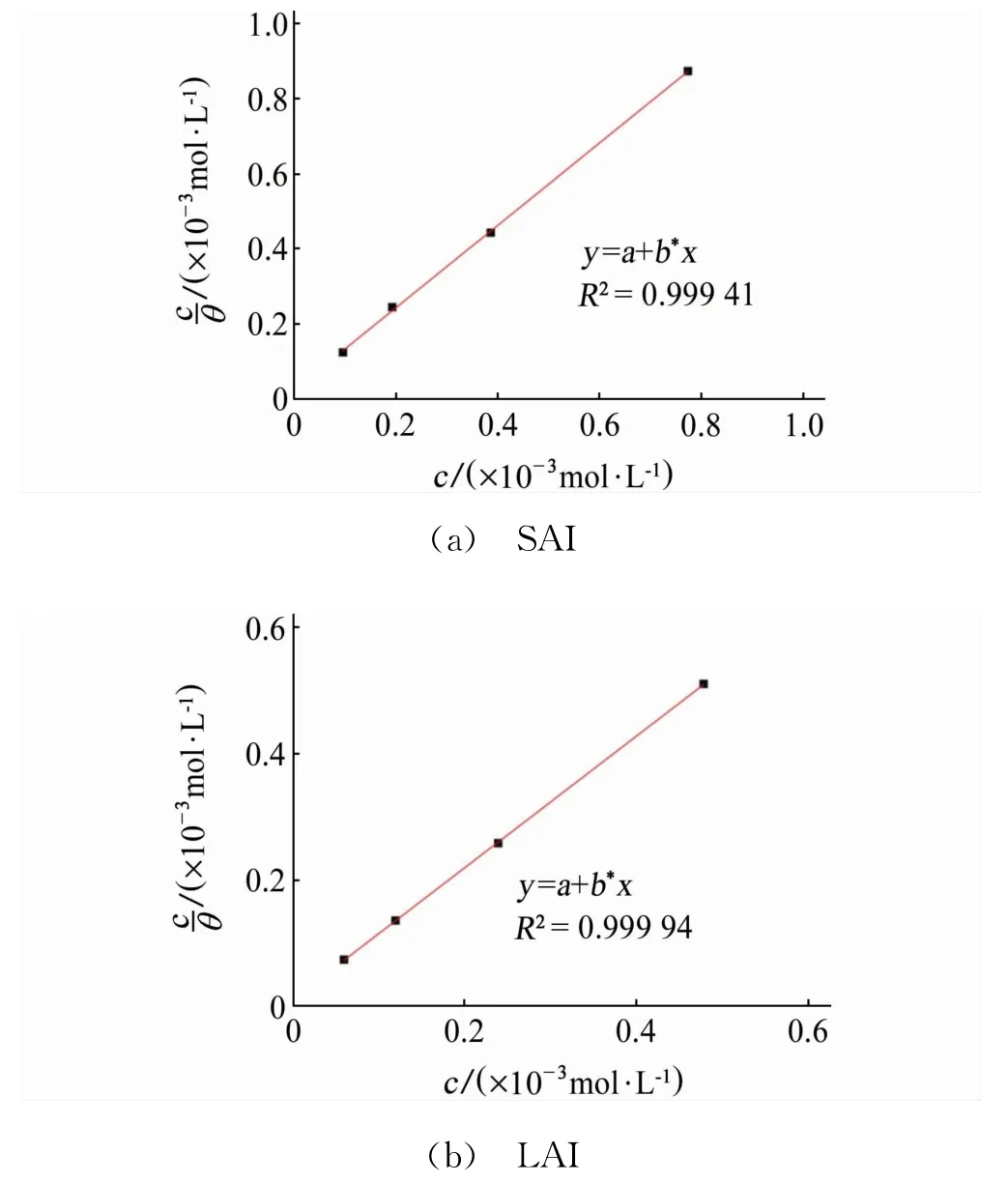
圖6 SAI和LAI的Langmuir等溫吸附擬合結果Fig.6 Langmuir isother mal adsorption fitting results of SAI(a)and LAI(b)

圖7 試樣在不含和含緩蝕劑的飽和CO2模擬地層水中腐蝕后的表面SEM形貌Fig.7 Surface SEM morphology of samples after corrosion in saturated CO2 si mulated for mation water without(a)and with(b,c)inhibitors
由表5可見:SAI和LAI的ΔGads都為負值,表明SAI和LAI都能自發吸附在試樣表面。一般來說,當ΔGads<-40 kJ·mol-1時,吸附方式以化學吸附為主;當ΔGads>-20 kJ·mol-1時,吸附方式以物理吸附為主;當-20 kJ·mol-1<ΔGads<-40 kJ·mol-1時,緩蝕劑在鋼的表面吸附既有物理 吸 附 也 有 化 學 吸 附[15-16]。SAI的ΔGads為-53.53 kJ·mol-1,LAI的ΔGads為-55.46 kJ·mol-1,所以都是以化學吸附作用為主且吸附作用較強。另外,LAI的吉布斯自由能比SAI的更負,說明LAI緩蝕劑的吸附作用更強,這與之前的試驗結果相符。
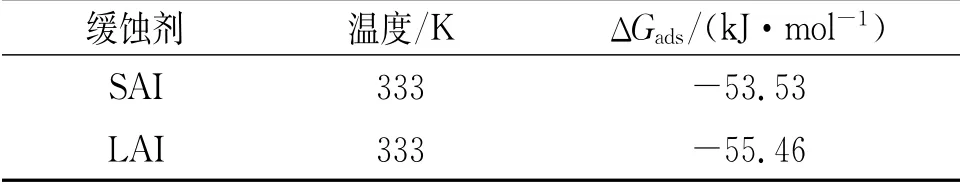
表5 SAI和LAI的ΔG ads計算結果Tab.5 ΔG ads calculation results of SAI and LAI
2.5 SEM和EDS分析
由圖7可見:在不含緩蝕劑的試驗溶液中腐蝕后,試樣表面沉積物裂痕明顯較多,腐蝕非常嚴重,而加入400 mg/L緩蝕劑后,試樣表面沉積物裂痕減少,說明緩蝕劑已經吸附在試樣表面形成一層吸附膜。由圖7還可見:相比于SAI,加入LAI后,試樣表面沉積物更加致密。
CO2腐蝕環境復雜,形成的腐蝕產物多樣,結合能譜圖分析結果,發現空白組試樣表面的C和Fe含量較高,當沒有緩蝕劑保護時,試樣表面腐蝕的反應加劇。加入緩蝕劑后,N含量增多,說明緩蝕劑已經吸附在鋼的表面,阻礙腐蝕產物的生成,起到保護金屬的作用,見表6。
LAI和SAI具有相同碳鏈長度的疏水基團,可以有效阻隔水與鋼表面的接觸,減緩金屬表面的腐蝕。另一方面,根據文獻報道[4,6],咪唑啉環可以增強緩蝕劑在鋼表面的吸附能力,主要依靠咪唑啉上的N原子和C=N雙鍵為Fe的空d軌道提供電子。LAI擁有四個咪唑啉環,吸附的活性位點更多,使其吸附能力比SAI的更強。
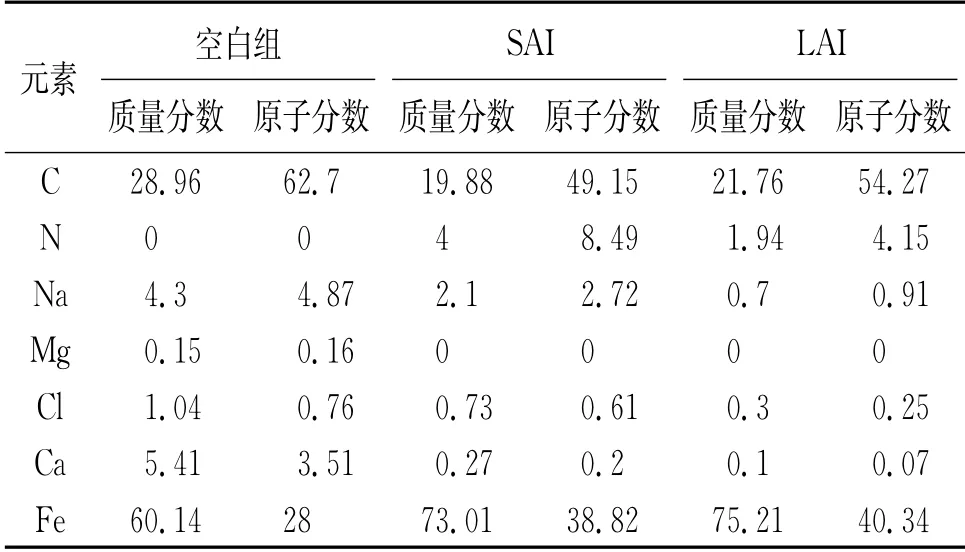
表6 試樣在不含和含緩蝕劑的飽和CO2模擬地層水中腐蝕后的表面EDS分析結果Tab.6 EDSanalysis results of samples after corrosion in saturated CO2 simulated for mation water without and with inhibitors %
3 結論
(1)SAI和LAI緩蝕劑在飽和CO2的模擬地層水環境中對L360鋼具有良好的緩蝕作用。通過失重法和電化學方法評價了這兩種緩蝕劑,結果表明,合成的LAI具有更好的緩蝕效果,加入量為400 mg/L時,最高緩蝕率達93.87%。SAI和LAI均為混合型緩蝕劑,主要抑制陽極反應。
(2)SAI和LAI符合Langmuir吸附等溫式,吸附類型以化學吸附為主,形成一層吸附膜,抑制金屬的腐蝕。
(3)沒有緩蝕劑情況下,試樣表面腐蝕產物主要由Fe、C元素組成,加入緩蝕劑后腐蝕產物減少,表面的腐蝕減緩。

