肝細胞癌患者血清Dickopff 1水平對TACE治療后預后的影響*
魯 斌,程 敏
在(hepatocellular carcinoma,HCC)的早期診斷中,除了甲胎蛋白(alpha fetoprotein,AFP)外,還有20多種血清蛋白具有臨床意義,其中一些蛋白被認為比AFP更靈敏[1-4]。Dickopff相關蛋白1(dickopff-1)屬于分泌蛋白家族,通過wnt/β-連環蛋白(Wnt/β-catenin)信號通路促進HCC細胞β-catenin在細胞質/核積累,在HCC進展過程中發揮重要的作用[5]。研究顯示,Dickopff-1在HCC患者具有較好的診斷價值,尤其是在HCC早期血清AFP水平較低時[6]。經導管動脈化療栓塞術(transcatheter arterial chemoembolization,TACE)是不可切除的HCC患者的主要治療手段,但還缺少有效的血清學監測指標去評價其治療效果[7]。本研究采用TACE治療HCC患者,檢測了血清Dickopff-1水平變化,并分析了Dickopff-1預測TACE術后治療效果,為臨床選擇和制訂治療計劃提供幫助。
1 資料與方法
1.1 臨床資料 2016年1月~2018年1月在我院住院的HCC患者90例,男性63例,女性27例;平均年齡為(57.31±20.91)歲。HCC的診斷符合《原發性肝癌診療規范》(2017年版)的標準[8]。納入的HCC患者均經病理學檢查明確診斷,且在TACE治療前未接收過任何抗腫瘤治療。根據2010 年國際抗癌協會(International Union Against Cancer,UICC)發布的標準對HCC進行TNM 分期。排除病例標準:(1)入院時肝功能存在嚴重的障礙;(2)既往存在肝腎移植;(3)合并其他系統腫瘤或腫瘤遠處轉移;(4)合并患有艾滋病、過度飲酒或藥物濫用者。選擇同期在我院進行健康體檢者90例作為對照組,男性60例,女性30例;平均年齡為(55.72±17.61)歲;慢性乙型肝炎(chronic hepatitis B,CHB)患者86例,男性57例,女性29例;平均年齡為(39.26±24.20)歲;乙型肝炎肝硬化患者81例,男54例,女 27例;平均年齡為(53.59±14.24)歲。本研究根據《赫爾辛基宣言》的原則進行,并獲得醫院醫學倫理學委員會批準,所有研究對象對本研究知情并簽署知情同意書。
1.2 TACE治療和隨訪 采用 Seldinger 技術穿刺股動脈成功后,置入5F導管鞘,經導絲引入導管,在DSA血管造影機監視下,選擇腹主動脈、腹腔干、肝動脈和腸系膜上動脈等造影探查腫瘤供血動脈,根據腫瘤大小、數目及患者全身情況,行腫瘤化療栓塞,常用的化療藥包括:5-FU 750~1 000 mg、順鉑 50~60 mg、奧沙利鉑100~150 mg、吉西他濱15~20 mg、阿霉素或表阿霉素20~60 mg,栓塞劑用超液化碘油5~20 ml與阿霉素或表阿霉素混合乳劑。對所有HCC患者行 TACE 治療,平均每例患者接受介入治療 3.1 次,采用電話或門診進行隨訪,以是否死亡為隨訪截點,每例HCC患者進行為期24個月的隨訪。
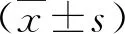
2 結果
2.1 各組研究對象血清Dickopff-1和AFP水平的比較 HCC組患者血清Dickopff-1和AFP水平顯著高于肝硬化組和CHB組(P<0.05),也顯著高于健康人(P<0.05);肝硬化組和CHB組患者血清Dickopff-1水平與健康人比無顯著差異(P>0.05),但肝硬化患者血清AFP水平顯著高于CHB組和健康人(P<0.05,表1)。

表1 各組人群血清Dickopff-1和AFP水平的比較
2.2 不同臨床和病理學特征HCC 患者血清Dickopff-1水平比較 見表2。

表2 不同臨床和病理學特征HCC 患者血清的比較
2.3 血清Dickopff-1和AFP診斷HCC的效能比較 血清Dickopff-1和AFP單獨診斷HCC患者的AUC分別為0.860和0.618,對診斷HCC都有一定的價值( Z=6.297,P<0.05) 。血清Dickopff-1和AFP聯合應用能提高診斷效能(AUC=0.892),其診斷的靈敏度、特異度和準確度均最高(表3、圖1)。

圖1 血清Dickopff-1和AFP診斷HCC的ROC曲線
2.4 血清Dickopff-1水平對HCC患者TACE治療后預后的預測價值 以血清Dickopff-1水平>2.37 ng/ml作為高血清Dickopff-1水平(n=43),血清Dickopff-1水平≤2.37 ng/ml作為低血清Dickopff-1水平(n=47),比較兩組預后的差異。Kaplan-Meier生存分析顯示,高血清Dickopff-1水平患者總體生存率顯著低于低血清水平組(x2=8.418,P<0.05,圖2)。

表3 血清Dickopff-1和AFP診斷HCC的效能(%)比較

圖2 高低血清Dickopff-1水平HCC患者Kaplan-Meier生存曲線
3 討論
腫瘤轉化研究表明,細胞表面蛋白糖基化改變在癌癥進展過程中至關重要,尤其是糖蛋白的終末表位,糖蛋白在細胞間相互作用、細胞黏附、惡性轉化和轉移過程中發揮重要的作用[9-12]。腫瘤細胞通過增加糖基化水平來調節其表面以逃避識別,導致了腫瘤細胞的幾個異常特征,如黏附功能降低和腫瘤生長失控[13,14]。Dickopff蛋白家族有4個成員,分別是Dickopff-1、Dickopff-2、Dickopff-3和Dickopff-4,均為分泌性糖蛋白[15]。研究表明,Dickopff-1和Dickopff-3在HCC組織中呈高表達,肝癌肝移植術后血清Dickopff-1活性降至正常水平,并隨腫瘤復發而升高[16]。無效的細胞毒性化療也與血清Dickopff-1活性的逐漸升高有關[17]。同時,血清Dickopff-1水平可以區分慢性HBV感染、肝硬化與HCC,在HCC患者中檢測到血清Dickopff-1水平與肝硬化患者之間存在顯著性差異,而肝硬化患者和非肝硬化患者之間未發現血清Dickopff-1水平有任何顯著性差異[18]。對HCC患者在行肝切除后其血清Dickopff-1水平降低[19]。本研究結果顯示,HCC組與肝硬化組或對照組相比,血清Dickopff-1和AFP水平顯著升高,肝硬化組患者血清AFP水平顯著高于CHB組和健康人,而非HCC組血清Dickopff-1水平無顯著性差異,與上述研究相符。同時,血清Dickopff-1水平只與是否有癌栓和患者生存有關,在接受TACE治療后可以降低HCC患者血清Dickopff-1水平,而與其他病理學特征不相關,提示血清Dickopff-1水平受到其他干擾因素的影響較少,高血清Dickopff-1水平可能是腫瘤細胞過度產生的結果。
研究指出,血清Dickopff-1水平可以作為補充檢測手段用于診斷HCC[20]。血清Dickopff-1診斷的截斷點為2.01 ng / mL(AUC = 0.829、靈敏度為90.7%、特異性為62.0%)。在本研究中,血清Dickopff-1水平診斷HCC的AUC為0.860,其截斷點設定為2.37 ng/ml,診斷的靈敏度為81.2%,特異性為66.3%,均顯著高于AFP診斷,表明應用血清Dickopff-1在診斷HCC方面比AFP更優越。同時,我們將血清Dickopff-1聯合AFP進行診斷,可提高診斷HCC的準確性。Dickopff-1被認為是接受局部治療的HCC患者隨訪的有希望的預后標志物。高血清Dickopff-1水平與低血清Dickopff-1水平組患者相比,其總體生存率和無復發生存率較差。本研究結果顯示,高血清Dickopff-1水平患者總體生存率較低水平患者低,提示預后好的HCC患者血清Dickopff-1水平也亦降低。

