肉雞成肌細胞的分離培養與鑒定
陳凱凱 張 成 趙 菲 王 馳 王孝成 耿照玉 姜潤深
(安徽農業大學動物科技學院,合肥 230036)
成肌細胞(Myoblast)來源于中胚層干細胞,是胞漿中含有肌絲的肌組織前體細胞,具有自我更新、促進肌纖維再生以及多向分化等能力。成肌細胞大量增殖后融合為多核肌管,最終分化為成熟的多核肌纖維[1-2],對骨骼肌發育、修復和再生起著重要作用[3]。成肌細胞作為一種多能干細胞,未退出細胞周期,具有增殖分化潛能大、易于培養等優點,因而受到廣泛關注,被作為肌肉發育[4]、肌肉疾病[5]及營養調控[6]等研究的理想體外模型。
成肌細胞的體外分離培養可追溯至1961年,Mauro[7]利用電鏡技術首次從青蛙骨骼肌中發現并分離獲得骨骼肌衛星細胞,是成體內未激活的成肌細胞。Spencer等[8]利用大鼠成肌細胞研究生長抑素對胰島素刺激的細胞氨基酸攝取功能的影響;Yang等[9]以豬成肌細胞為試驗材料研究Wnt/b-catenin信號通路對肌源性分化的影響。以上研究充分體現了成肌細胞在肌肉發育及營養調控信號通路等研究中的重要作用。目前,包括人[10]在內的多種哺乳動物,如大鼠[8]、小鼠[11]、豬[9]、綿羊[12]以及山羊[13]等均已建立了成熟的原代成肌細胞體外分離培養方法。但禽類生理特征不同于哺乳動物,如成年雞的體溫達到41.5 ℃[14],遠高于哺乳動物,導致肉雞骨骼肌成肌細胞體外分離培養比較困難,進而限制了家禽肌肉發育及其營養調控機制的相關研究。因此,亟需建立一種肉雞成肌細胞體外分離培養的方法。本研究擬以肉雞雞胚為研究材料,旨在建立一種以肉雞雞胚為來源的成肌細胞體外分離培養及鑒定體系,為進一步研究肉雞肌肉生長發育及其營養調控機制提供研究模型。
1 材料與方法
1.1 試驗材料
新鮮淮南麻黃雞受精蛋,購于安徽某孵化場。
膠原酶Ⅰ型(Sigma)、DMEM高糖培養基(Sigma)、PBS緩沖液(Hyclone)、胎牛血清(Clark)、青霉素-鏈霉素溶液(100×,Biosharp)、胰蛋白酶溶液(0.25%,Hyclone)、馬血清(Hyclone)、細胞培養板/瓶(Costar)、CCK-8試劑(Biosharp)、DMSO(Sigma)、RNAiso Plus(TaKaRa)、cDNA第一鏈合成試劑盒(ABclonal)、2X SYBR Green 快速qPCR混合液(ABclonal)、一抗Desmin(Servicebio)、一抗MyHC(Santa Cruz)、FITC標記二抗(山羊抗小鼠,Servicebio)和CY3標記二抗(山羊抗兔,Servicebio)等。
1.2 試驗方法
1.2.1主要培養基配制
增殖培養基:DMEM高糖培養基中添加20%胎牛血清,1%青-鏈霉素混合液;
分化培養基:DMEM高糖培養基中添加2%馬血清,1%青-鏈霉素混合液。
1.2.2成肌細胞的分離
取11 d胚蛋,于75%酒精中浸泡殺菌5 min,移入超凈工作臺自然干燥后取出雞胚,用含雙抗的PBS洗2次后分離胸部肌肉,肌肉組織經PBS洗2次后剪成1 mm3不規則碎片,PBS清洗1次后轉移至50 mL離心管中,1 000 r/min離心6 min,棄上清,采用0.1% Ⅰ型膠原酶重懸沉淀,于37 ℃水浴消化,每隔5 min搖勻1次,當消化液中出現一團松散白色絮狀物時,加入增殖培養基終止消化,吹打至單細胞懸液,靜置1 min后取上清液,200目篩網過濾至新離心管中,1 000 r/min離心6 min,去除上清,收集沉淀,重懸于PBS中,吹打混勻,400目篩網重復上一步驟后,重懸于增殖培養基中。
1.2.3成肌細胞的純化培養
細胞懸液轉移至6孔板(左側2孔)中,十字搖勻法使細胞分布均勻,標記時間后置于37 ℃、5%CO2培養箱培養30 min,吸取未貼壁細胞至第2排孔,重復3次差速貼壁后進行增殖培養。當細胞密度增殖至70%時,及時進行傳代處理,吸棄培養基,PBS洗2次,每孔(六孔板)加入0.25%胰酶0.5 mL,20 s后吸去胰酶,置于CO2培養箱中3 min,隨后用增殖培養基終止消化,吹打懸液使未漂浮細胞脫落。為保證成肌細胞純度,每次傳代后進行一次差速貼壁,通過觀察30 min貼壁的成纖維細胞數判斷成肌細胞純度。經觀察,純化至第3代,在30 min內無細胞貼壁。因此,后續試驗采用第3代成肌細胞。
1.2.4成肌細胞適宜培養溫度的確定
取第3代成肌細胞按相同密度接種至兩塊96孔板中,分別隨機選取5孔添加CCK-8試劑10 μL/孔,置于37.0 ℃ 1 h后,于450 nm波長測定吸光度,隨后2板分別置于37.0 ℃與39.5 ℃的CO2培養箱中,每天以相同方法測定吸光度,用OD值表示繪制細胞增殖曲線,比較2培養溫度下細胞增殖狀態,用細胞活力表示細胞增殖狀態。
第n天細胞活力=[OD(第n天)-OD(空白)]/ [OD(第0天)-OD(空白)]×100%
1.2.5成肌細胞的成肌誘導分化
當細胞密度增殖至80%時,棄去增殖培養基,PBS洗2次,換成含2%馬血清的分化培養基誘導成肌分化,每天換液,觀察成肌細胞及肌管生長分化情況。
1.2.6成肌細胞增殖及分化階段特異性表達基因鑒定
細胞增殖至80%時及誘導分化3 d后,棄去培養基,采用Trizol法提取細胞總RNA,檢測合格后采用兩步法反轉錄成cDNA。利用NCBI primer-BLAST設計目標基因的引物,委托通用生物系統(安徽)有限公司合成,引物序列見表1。采用ABI7500定量PCR儀進行RT-qPCR,反應條件如下:95 ℃預變性10 s;95 ℃變性5 s,60 ℃退火30 s,72 ℃延伸15 s,循環40次。

表1 RT-qPCR 引物信息Table 1 Primer information for RT-qPCR
1.2.7成肌細胞Desmin與成肌誘導分化后MyHC免疫熒光鑒定
取純化至第3代的成肌細胞接種至含細胞爬片的6孔板中,39.5 ℃、5%CO2培養箱培養至適宜密度,取出細胞爬片至平皿中,PBS洗3次;4%多聚甲醛室溫固定15 min,PBS洗3次,每次5 min(后續PBS洗滌均為3次,5 min/次);加入1 ml 0.1%Triton X-100,室溫孵育15 min,PBS洗滌;加入1% BSA(牛血清白蛋白)溶液,室溫封閉1 h;吸去BSA,直接加入一抗Desmin(1% BSA,1∶500稀釋),4 ℃孵育過夜,PBS洗滌;加入CY3標記的二抗,避光室溫孵育1 h,PBS洗滌;DAPI染核5 min,PBS洗滌;取出細胞爬片,將其倒扣在滴加抗熒光猝滅封片劑的載玻片上,熒光顯微鏡觀察并拍照。取成肌分化誘導5 d后的爬片進行MyHC免疫熒光鑒定,一抗為MyHC,二抗為FITC標記,其他步驟同上。
1.3 數據統計與分析
試驗數據采用SPSS 19.0進行獨立樣本t檢驗,結果以平均值±標準誤(Mean±SE)表示,P<0.05為差異顯著。
2 結果與分析
2.1 成肌細胞的分離純化及形態特征
使用Ⅰ型膠原酶消化雞胚胸肌,并經過3次差速貼壁方法去除大部分的成纖維細胞,傳至第3代培養30 min后未見成纖維細胞貼壁。因此,經3代純化,成肌細胞純度即可滿足試驗需要。第3代純化得到的成肌細胞培養24 h后觀察,大部分細胞已貼壁,呈現紡錘形或細長梭形(圖1(a)),之后細胞迅速增殖,培養至細胞密度達90%左右時,細胞呈螺旋或平行排列(圖1(b))。
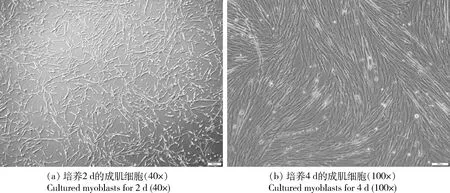
圖1 成肌細胞培養形態Fig.1 Myoblast morphology
2.2 成肌細胞在不同溫度培養條件下的增殖曲線

圖2 不同培養溫度下肉雞成肌細胞的增殖曲線(n=5)Fig.2 Proliferation curves of broiler myoblasts at different culture temperature (n=5)
由圖2可知,肉雞成肌細胞在37.0 ℃及39.5 ℃均能生長,但39.5 ℃的增殖速率高于37.0 ℃。相同接種密度,39.5 ℃培養條件下,細胞增殖至平臺期(部分成肌細胞已分化成肌管)需要4 d,而37.0 ℃需要6~7 d;同時在換液時發現37.0 ℃培養條件下漂浮的死細胞數多于39.5 ℃,因此,后續試驗選擇 39.5 ℃ 作為肉雞成肌細胞的培養溫度。
2.3 成肌細胞增殖及分化階段特異性表達基因的相對表達量分析
經RT-qPCR分析,增殖期與分化期均有成肌細胞的特異性標志基因Myf5與MyoD的表達,初步證明該細胞為成肌細胞;與增殖期相比,分化期細胞MyoG與MRF4基因表達量顯著升高(P<0.05)(圖3),表明成肌細胞誘導分化效果顯著。
2.4 成肌細胞標志蛋白Desmin的表達檢測
經免疫熒光分析,Desmin蛋白經CY3標記在綠色熒光激發后呈紅色(圖4(a)),細胞核經DAPI染色在紫外光激發后呈藍色(圖4(b)),Desmin陽性率在95%以上(圖4(c))。此結果充分表明此方法分離純化的細胞為成肌細胞,且純度高,可進行后續試驗。
2.5 成肌細胞的誘導分化后標志蛋白MyHC的表達檢測
當細胞換成含2%馬血清的分化培養基誘導成肌分化1 d后,細胞形態較分化前體積增大,界限開始模糊,部分細胞發生融合,細胞方向性排列更加明顯;誘導分化3 d后,形成具有多核的肌小管,部分肌管發生無規則搏動;誘導分化5 d后,肌管進一步融合,形成方向性更加明顯的長肌管(未在結果中顯示)。肌球蛋白重鏈(MyHC)是肌肉的主要結構和收縮蛋白之一,可作為鑒定成肌細胞分化標志。取誘導分化5 d的細胞進行免疫熒光染色檢測MyHC的表達情況,MyHC經FITC標記在藍色熒光激發后呈綠色,由圖5可知,MyHC在細胞質內呈陽性表達。此結果表明此方法分離的成肌細胞有較好的成肌分化潛能,且2%的馬血清分化培養基適合肉雞成肌細胞的分化。
3 討 論
3.1 成肌細胞的分離方法
成肌細胞作為一種多能干細胞,其數量和功能會隨著發育的完善逐漸降低。因此,分離時間的選擇十分重要[15]。很多學者在分離豬及羊等哺乳動物的成肌細胞時,常選的時期是出生后[11,13]。雞作為卵生動物,8~12 d的雞胚已形成了雞的雛形,能分辨出皮膚、肌肉及軟骨等組織,且該時期為成肌細胞快速增殖期,成肌細胞含量較高,雞胚肌肉發育主要集中在胸部和腿部,但腿部組織結構復雜,血管豐富,分離時容易混入血管上皮細胞、血細胞等雜細胞,而胸部肌肉較腿部更為發達[16],且組織結構更為單一。綜合組織分離難度以及肌肉組織量等多方面因素,本研究選取了11 d雞胚的胸部肌肉,作為肉雞成肌細胞的細胞來源。

*表示存在差異性顯著(P<0.05)。 * means significant difference (P<0.05).圖3 生肌調節因子家族(MRFs)mRNA的表達水平(n=5)Fig.3 mRNA expression levels of muscle regulatory factors (MRFs) (n=5)
成肌細胞的分離方法有多種,目前較為成熟的方法包括組織塊法、酶消化法和單根肌纖維法等[17]。酶消化法因其操作簡便、細胞分離徹底等優點受到很多學者的青睞。目前,成肌細胞分離方法主要是基于Blau等[18]建立的胰蛋白酶與膠原酶聯合分步消化法。胰酶活性強,對濃度及消化時間都有嚴格要求,容易損傷細胞膜上的功能蛋白[19],導致細胞生長狀態不佳甚至死亡;而膠原酶消化則相對溫和,對細胞的損傷較小。因雞胚發育中期,肌肉排列不緊密,本研究僅采用Ⅰ型膠原酶作為消化酶。此法步驟簡單,減少了消化酶對細胞的損傷,且分離的細胞數量以及活力可滿足試驗需求。
3.2 成肌細胞的純化方法
目前成肌細胞的純化分離方法有差速貼壁法、梯度離心法、流式細胞分選法和免疫磁珠分選法等[17],其中差速貼壁法和梯度離心法較為常用。Hindi等[20]利用差速貼壁法(差速貼壁45 min)純化從成年小鼠骨骼肌中分離的細胞后成功獲得成肌細胞;孫文娟[21]從新生仔豬骨骼肌中分離的慢速貼壁細胞(差速貼壁2 h后),經成肌誘導后形成多核肌管;王紅娜等[12]采用差速貼壁法及梯度離心法純化綿羊成肌細胞,認為此2種方法純化程度相當,但梯度離心法更為繁瑣。流式細胞分選法、免疫磁珠分選法受設備要求高、試劑價格高等原因的影響,使用不廣泛。因此,本研究采用差速貼壁法純化肉雞成肌細胞,并在每次傳代時均利用該方法去除殘余的成纖維細胞,成功獲得了純度95%以上的成肌細胞。
3.3 成肌細胞的增殖培養條件和成肌分化培養條件
肉雞屬于禽類,其生理特征有別于哺乳動物,就體溫而言,成年雞的正常體溫為41.5 ℃[14],遠高于哺乳動物。然而,對于禽類細胞的體外培養溫度,絕大部分學者選擇37.0 ℃,僅有部分學者選擇在更接近雞正常體溫的溫度條件下培養禽類細胞,如劉晴雪等[22]在39.0 ℃條件下培養了雞淋巴細胞。初生雛雞體溫較成年雞低2.0~3.0 ℃[23],本研究成肌細胞來源于雞胚,因而選取更接近雛雞正常體溫的39.5 ℃與培養細胞常選擇的37.0 ℃進行比較。研究表明,在39.5 ℃的培養溫度下,肉雞成肌細胞增殖速度顯著高于37.0 ℃,細胞狀態更好。因此,后續試驗選擇39.5 ℃作為肉雞成肌細胞的培養溫度。大多數細胞在低濃度的血清中可退出細胞周期[24],2%的馬血清可誘導成肌細胞成肌分化[25]。本試驗使用2%馬血清成功誘導了成肌細胞融合形成多核肌管。
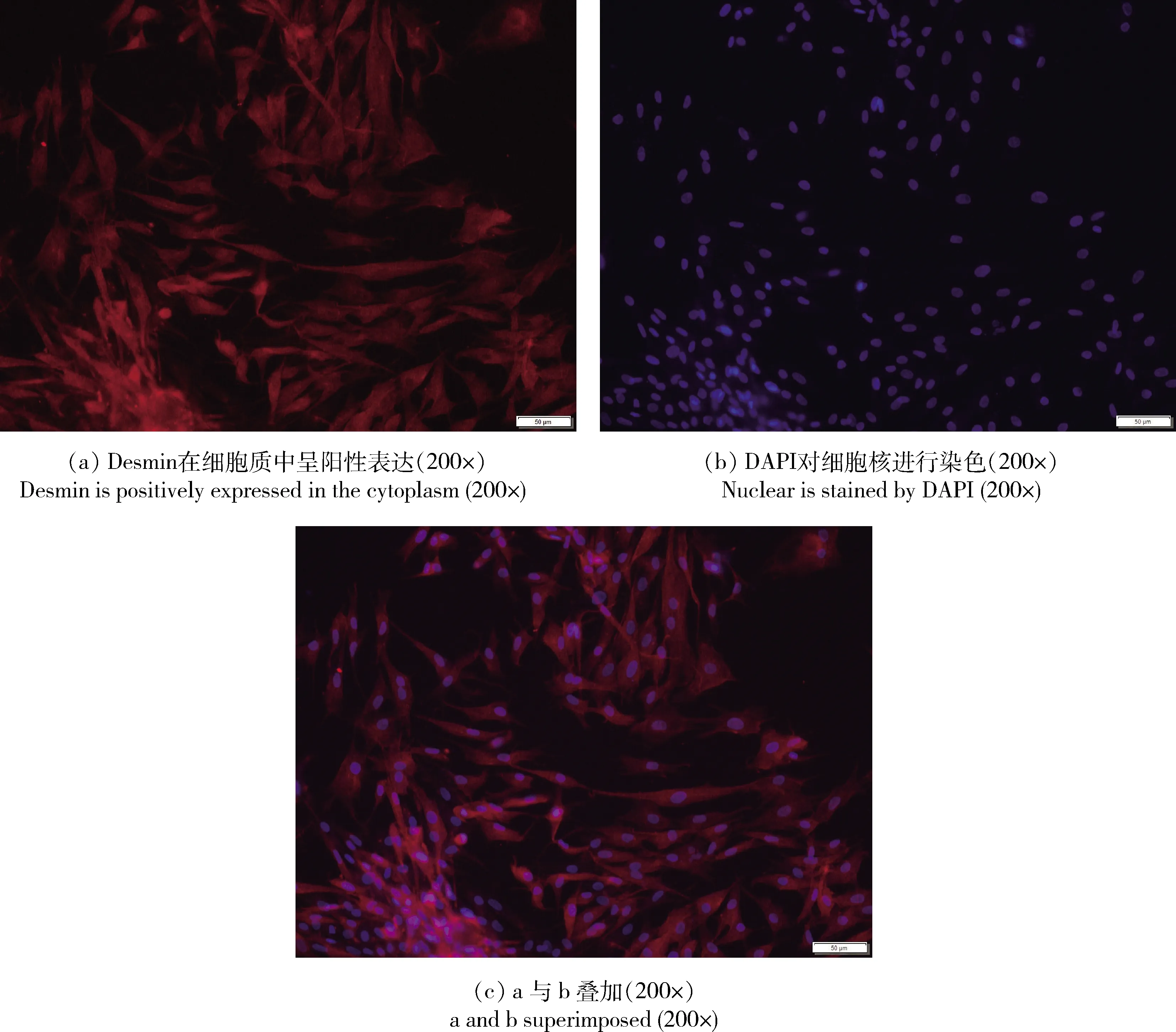
圖4 肉雞成肌細胞Desmin免疫熒光鑒定Fig.4 Immunofluorescence identification of Desmin in broiler myoblasts

圖5 肉雞成肌細胞誘導分化后標志蛋白MyHC免疫熒光鑒定Fig.5 Immunofluorescence identification of MyHC after differentiation of broiler myoblasts
3.4 成肌細胞及其誘導分化
骨骼肌的發育是一個復雜的過程,受許多基因的調控,其中生肌調節因子家族(MRFs),包括MyoD、Myf5、MyoG及MRF4在其中發揮了重要作用,是肌肉發育的特異性調控因子[26]。研究表明,MyoD和Myf5決定肌源性細胞狀態,同時具有開啟成肌細胞分化的重要功能,在成肌細胞的增殖期具有較高表達水平[27-28];MRF4和MyoG在肌細胞的融合與肌纖維的終末分化中起作用。因此,MyoD和Myf5可作為增殖期的標志蛋白,MyoG和MRF4可作為分化期的標志蛋白。本研究發現,增殖期與分化期均有成肌細胞的特異性標志蛋白Myf5與MyoD表達,且與增殖期相比,MyoD基因表達顯著下降,初步證明所分離的細胞為成肌細胞,誘導分化3 d后MyoG和MRF4基因表達與增殖期相比顯著升高,說明成肌誘導分化方法有效。
結蛋白(Desmin)是一種中間絲蛋白,是肌細胞特有的細胞骨架之一[29],而成纖維細胞則不表達此蛋白。因此,常用Desmin作為鑒定成肌細胞的標志蛋白。肌球蛋白是骨骼肌中的結構蛋白和收縮蛋白,而肌球蛋白重鏈(MyHC)是其重要的組成部分[30]。因此,常用MyHC作為鑒定成肌細胞分化的標志蛋白。經免疫熒光鑒定,本研究分離純化的成肌細胞增殖期Desmin蛋白呈陽性,而分化5 d后MyHC在細胞質內呈顯著的陽性表達,進一步證實了本研究分離的肉雞成肌細胞的純度高,且誘導分化效果好。
4 結 論
利用單一的膠原酶Ⅰ消化法及差速貼壁法從肉雞雞胚中成功分離獲得了成肌細胞,且在39.5 ℃培養條件下具有更好的增殖能力,為進一步研究肉雞肌肉生長發育及營養調控機制提供了體外細胞模型。

