靶向核殼蛋白基因的siRNA對流感病毒的預防和治療作用
史 亮 尹申慧 任 浩 高 榮 馬 壯 孫文武 曹建平
流感病毒感染是一種主要的公共健康問題,每年在世界方位內引起了數百萬的嚴重病例,290 000~650 000人死亡[1-3]。由于流感病毒的傳播方式簡單到吸入含有病毒顆粒的飛沫或接觸被污染的物品即可傳染,其傳播速度非常迅速。在人口稠密區或公共聚集區傳播速度更快,更有效,因此非常難以控制。目前,抗病毒藥物是抵抗甲型流感病毒(influenza virus A, IAV)感染的防御手段,但是已經出現藥物抵抗株[4-7]。疫苗仍然是預防IAV感染的最有效方法。然而,IAV的抗原漂移和抗原轉移對于可用疫苗是一個永遠變化的挑戰[8-9],而且生產疫苗的時間落后于在大流行時的大規模預防[10-12]。考慮到目前抗流感病毒策略的局限性,很明顯需要新的預防和治療IAV的策略[13-14]。RNA干擾(RNAi)是一個雙鏈RNA針對序列特異性降解同源mRNA的過程[15-17]。RNAi技術對于解決上述問題具有廣闊前景。Ge等[18]證實對流感病毒基因組保守區的siRNA在細胞株中可強烈地抑制流感病毒產生。它們也證實siRNAs在小鼠中可以預防和治療流感病毒感染[19]。研究結果顯示對H5N1禽流感病毒M2和NP特異的siRNA可以抑制不同亞型的甲型流感病毒(H5N1, H7N9, H1N1)的復制[20]。IAV在其基因組中由8個RNA片段組成。其中血凝素(hemagglutinin, HA)和神經氨酸酶(neuraminidase, NA)是兩個其抗原經常變化的片段。因此,不適合作為RNAi的靶標。其它六個片段對于病毒復制是必需的,在IAV各個亞型之間都是保守的。本文對IAV測序的基礎上設計了對NP保守區特異的siRNA,并觀察了在MDCK細胞中先轉染了siRNA然后以IAV感染,或先以IAV感染,然后轉染siRNA對MDCK細胞產生IAV的影響。
材料和方法
一、實驗材料
1. 病毒,細胞系及siRNA: 甲型流感病毒,A/Shanghai/N33/(2008) H1N1,由海軍軍醫大學海軍醫學系提供。所有用H1N1的實驗均在海軍軍醫大學海軍醫學系動物生物安全三級實驗室中進行。MDCK細胞購于中國科學院細胞庫,培養于含有10% FCS,2 mm L-谷氨酰胺,100單位/ml青霉素和100 μg/ml鏈霉素的DMEM,37 ℃,5% CO2。IAV的NP特異性siRNA序列為5′-GCUGGUCUGACUCACAUAAUG-3′和5′-CAUUAUGUGAGUCAGACCAGC-3′,由Obio技術(上海)有限公司根據NP片段的測序結果設計,由TaKaRa生物技術公司合成。
2. siRNA轉染: 將對數生長期的MDCK細胞以5×104/孔的密度接種到24孔培養板中。當細胞達到70%~80%融合時,使用Lipofectamine RNAiMAX試劑盒(invitrogen),按照廠家的說明書以靶向NP的siRNA轉染細胞。以劑量為20 pmol,40 pmol和80 pmol的siRNA分別轉染MDCK細胞。在轉染試劑對照中,加入相同體積的沒有siRNA轉染試劑。在IAV對照中,加入相同體積的opti-MEMTM培養基。不同劑量的siRNA組及對照組做6個復孔,培養板在37 ℃,5% CO2孵育24 h。然后以5×107TCID50的H1N1病毒感染細胞,孵育2 h。以PBS洗細胞3次后,細胞在流感病毒維持液中培養48 h。收集細胞培養上清,以RT-PCR測定病毒載量。將不同劑量的siRNA加入24孔板,每個劑量做6個復孔,培養板置于37 ℃,5% CO2孵箱中培養。
3. 病毒感染: 轉染后48 h,除去培養基,用PBS洗3次。然后,向孔中加入1 ml流感病毒維持液(DMEM 含有2 mm L-谷氨酰胺,100單位/ml青霉素和100 μg/ml鏈霉素,0.2% BSA,25 mm HEPES)含有2 μg/ml TPCK-trypsin和5×107TCID50的H1N1流感病毒。2 h后去除培養基,以PBS洗細胞,將細胞培養于流感病毒維持液中,37 ℃,5% CO2培養。48 h后收獲上清,以RT-PCR測定病毒載量。
為了測試細胞被IAV感染后siRNA是否能夠抑制IAV的產生,首先以IAV感染MDCK細胞。2 h后,吸棄培養液,以PBS洗細胞3次,細胞培養于流感病毒維持液中。使用Lipofectamine RNAiMAX試劑盒(invitrogen),按照廠家的說明書以靶向NP的siRNA轉染細胞(80 pmol/孔)。細胞于37 ℃,5% CO2培養。48 h后收獲上清,以RT-PCR測定病毒載量。
4. 總RNA提取和qRT-PCR: 收獲細胞培養上清,以TRIzol (Life Technologies)試劑按廠商的說明書提取總RNA。進行實時定量RT-PCR(qRT-PCR),所用反應成分均購于同一廠家(TaKaRa Biotechnology)。根據廠商的說明書進行標準色實驗。使用Prime ScriptTMRT Master試劑盒(Takara, Biotechnology Co., Ltd)在42 ℃,15 min然后95 ℃,5 min將總RNA反轉錄成cDNA。引物設計如下:H1N1引物F:5′TTCTAACCGAGGTCGAAACG3′和R:5′ACAAAGCGTCTACGCTGCAG3′。退火溫度60 ℃。所有反應做3個復孔。
5. 免疫熒光: 將MDCK細胞培養于孔底部帶有無菌蓋玻片的24孔板中。轉染siRNA和感染IAV的操作如上所述。轉染或感染后48 h,將蓋玻片上的細胞以4%多聚甲醛固定,室溫30 min,然后以PBS洗3次。以0.1%曲拉通-X 100室溫處理細胞30 min,然后以FBS封閉。以小鼠單克隆抗甲型流感病毒NP抗體(influenza A NP (5D8):sc-80481, Santa cruz Biotechnology, Inc)染色,4 ℃過夜。以PBS洗3次后,加入FITC交聯的結合蛋白(m-IgGκ BP-FITE: sc-516140, Santa cruz Biotechnology, Inc),室溫孵育90 min。以Hoechst 33342染色細胞核。使用熒光顯微鏡觀察細胞。以Image J software軟件分析NP蛋白的熒光強度。
六、統計學方法
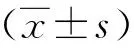
結 果
一、NP特異的siRNA以劑量依賴方式抑制IAV產生
以不同劑量的siRNA轉染MDCK細胞,然后以H1N1感染細胞。48 h后以實時定量TR-PCR測定病毒載量。結果顯示在20 pmol,40 pmol和80 pmol siRNA組,以及轉染試劑對照和IAV對照組中,IAV mRNA相對表達量分別為0.123±0.101,0.113±0.075,0.060±0.039,0.453±0.263和0.579±0.252。和IAV對照相比,在20 pmol,40 pmol和80 pmol siRNA組中IAV的產生均顯著降低(P<0.01)。和轉染試劑對照組相比,在20 pmol和40 pmol siRNA組中,IAV的產生減少(P<0.05),80 pmol siRNA組中,IAV的產生顯著減少(P<0.01),見圖1。這些結果表明靶向甲型流感病毒NP片段的siRNA以劑量依賴方式顯著抑制IAV的產生。

圖1 NP特異的siRNA對MDCK細胞中IAV的產生的影響;注:**:P<0.01, 和IAV對照相比;#:P<0.05,和轉染液對照相比;##:P<0.01,和轉染液對照相比
二、預先以IAV感染MDCK細胞,siRNA也能降低IAV的產生
在本實驗中,先以IAV感染MDCK細胞。2 h后,以siRNA轉染MDCK細胞。轉染后48 h,提取總RNA,測定病毒載量。結果顯示siRNA組,轉染劑對照組和IAV對照組的IAV mRNA相對表達量分別為0.105±0.08,0.799±0.509和0.906±0.321。siRNA組的IAV產生顯著小于IAV對照組(P<0.01)和轉染劑對照組(P<0.05),見圖2。

圖2 NP特異的siRNA對已感染IAV的MDCK細胞中IAV的產生的影響;注:**:P<0.01,和IAV對照相比;*:P<0.05,和轉染試劑對照相比
三、NP特異的siRNA在MDCK細胞中對IAV的抑制是由于干擾了NP蛋白合成
不論MDCK細胞是先轉染siRNA還是先感染IAV,轉染了靶向NP的siRNA的MDCK細胞中,NP蛋白的表達顯著低于對照組,圖3~4。

圖3 預先轉染siRNA對MDCK感染IAV后NP蛋白合成的影響;注:A:轉染了NP特異性siRNA 的MDCK細胞的免疫熒光圖像;(A)對照組細胞的熒光圖像;(B)轉染了siRNA細胞的熒光圖像; (C)對照組中以Hoechst 33342染色的細胞核; (D)轉染了siRNA 的細胞中以Hoechst 33342染色的細胞核;B:對照組和轉染了siRNA細胞的熒光強度;以Image J 軟件分析兩組細胞NP蛋白的熒光強度。**,P<0.01和對照組相比,(n=30)
討 論
小干擾RNA是進化過程中的一種保守的防御機制,憑借這種機制防御外來病毒。與轉錄產物mRNA具有同源互補序列的雙鏈RNA可以在其導入細胞后降解該mRNA,因此導致相應的功能和表型的缺失[21-22]。已經發現RNA干擾在藥物應用方面具有廣闊前景,特別是小干擾RNA在臨床應用方面更有價值。siRNAs可以治療病毒感染[23-26]。通過這種技術可以抑制病毒的復制,沉默病毒基因的表達。更精確地設計沉默序列可以抑制病毒衣殼蛋白。根據最近的報道,有學者做了一個隨機的,雙盲的,安慰劑對照的試驗,結果顯示在安慰劑和siRNA處理的受者中呼吸道合胞病毒感染的比例分別為71.4%和44.2%,代表感染數量降低38%,未感染數量增加95%。未觀察到明顯的不良事件發生[27]。這是第一次siRNA作為抗病毒制劑用于人類,結果是令人鼓舞的。



圖4 siRNA對預先感染IAV的MDCK細胞NP蛋白合成的影響;注:A:轉染了NP特異性siRNA 的MDCK細胞的免疫熒光圖像;(A)對照組細胞的熒光圖像;(B)轉染了siRNA細胞的熒光圖像;(C)對照組中以Hoechst 33342染色的細胞核;(D)轉染了siRNA 的細胞中以Hoechst 33342染色的細胞核;B:對照組和轉染了siRNA細胞的熒光強度;以Image J軟件分析兩組細胞NP蛋白的熒光強度。**,P<0.01,和對照組相比,(n=30)
本文結果顯示:靶向IAV的NP的siRNA在MDCK細胞中可以以劑量依賴的方式抑制IAV的產生。siRNA對IAV的抑制作用是由于干擾了NP蛋白的合成。IAV的NP片段在該病毒復制中起了重要作用。Ge等[18]證實NP-或PA特異性的siRNA不僅干擾NP-或PA特異性mRNA積聚,也干擾其他病毒基因的積聚,如M, NS1, PB1, PB2和PA。他們認為NP-特異性siRNA在被感染細胞中抑制所有病毒RNA的積聚是因為在NP特異性siRNA存在的情況下降解了轉錄的NP mRNA,導致了NP蛋白合成的抑制。沒有新合成的NP進一步的病毒轉錄和復制被阻斷,新的病毒粒子的產生也是如此。他們的發現表明在流感病毒RNA轉錄和復制中絕對需要新和成的NP和PA蛋白。他們認為基質蛋白(M)并不是必需的直到病毒感染的后期。但是Sui等[28]證明在穩定的細胞株中M2特異的shRNA顯示出比NP特異的shRNA更高的H1N1病毒的抑制作用,M2特異的shRNA也能抑制NP的mRNA積聚和蛋白表達。我們的結果和文獻一致[18]。
然后,本文證明了在預先感染了IAV的MDCK細胞中,轉染siRNA也可以一直IAV的產生。這表明siRNA不但可以預防,也可以治療IAV感染。該結果在臨床應用方面具有重要意義,它意味著siRNA不僅可以保護上呼吸道上皮細胞免于IAV感染,而且在細胞已經感染了IAV病毒后也可以降低IAV病毒的載量。
總之,研究表明對IAV病毒NP片段特異的siRNA可以抑制MDCK細胞中IAV病毒的產生,不論該細胞是在轉染siRNA之前還是在轉染siRNA之后感染IAV病毒。該siRNA抑制IAV產生是因為其干擾了IAV的NP蛋白的合成。本文為進一步研發和應用RNA干擾技術預防和治療流感病毒感染提供了實驗室數據。

