一例疑似重癥新冠肺炎患者救治經驗
徐 靜 胡明冬 蔣云秋 張明周 郭宇航 李 琦 王關嵩
2019年12月突然爆發新型冠狀病毒(SARS-CoV-2)肺炎[1-2]。SARS-CoV-2是一種高度傳染性且可能致命的病毒,比流感更具傳染性,更致命[3]。2020年2月11日WHO將新冠病毒引發的疾病正式命名為冠狀病毒病(corona virus disease 2019, COVID-19)。我國已將該病納入《中國人民共和國傳染病法》規定的乙類傳染病,采取甲類傳染病預防控制措施[4-6]。疫情期間,若有不確切的流行病學史,每一個有呼吸道感染證據的危重病患者,均應該考慮存在COVID-19的可能性,需要在單人間隔離治療,盡快釆集標本進行新型冠狀病毒核酸檢測,同時在確保轉運安全前提下立即將疑似病例轉運至定點醫院。若因病情嚴重存在轉運風險,則需要在單間病房暫時按照標準防護進行隔離與救治。2020年2月28我院呼吸與危重癥醫學中心收治1例疑似患者,救治成功,現報告如下。
病例資料
患者男性,43歲,因“發熱、咳嗽10余天,呼吸困難4 d”于2020年2月28日由我院發熱門診轉入我病區。患者入院前10余天因“血尿”在某醫學院附屬醫院住院,期間不明原因出現畏寒、發熱,體溫最高達38.2 ℃,熱型不規律,伴有咳嗽、咳少量白色粘痰,無其他特殊不適。先后2次行胸部CT提示雙肺多發斑片狀、網格狀高密度影,見圖1~2。當地醫院考慮新冠肺炎疑似病例,于當地疾控中心(CDC)先后行3次咽拭子新冠病毒核酸檢測均為陰性。巨細胞病毒DNA:陽性,5.36×103。遂在透析(隔日透析,每次透析濾液2 000~2 500 ml)治療基礎上,予以抗感染(更昔洛韋、莫西沙星、利奈唑胺、卡泊芬凈、甲強龍40 mg)等綜合治療,仍有發熱,體溫在37.5~37.8 ℃波動。4 d前患者出現活動后呼吸困難,吸氧不能緩解癥狀,遂來我院救治,發熱門診檢查:血常規 白細胞總數4.46×109/L,L 0.29,Hb 71 g/L,血小板92×109/L,降鈣素原 0.57 ng/ml ;胸部CT提示:雙肺胸膜下散在磨玻璃滲出影。門診留觀期間行2次鼻咽拭子新冠病毒核酸檢測均為陰性。門診予以無創呼吸機輔助通氣、“莫西沙星、頭孢哌酮-舒巴坦鈉、磺胺”抗感染及透析等治療,患者呼吸困難仍然持續加重,復查胸部CT(2020年2月27日)提示雙下肺彌漫性滲出病變加重,見圖3,遂轉我科。
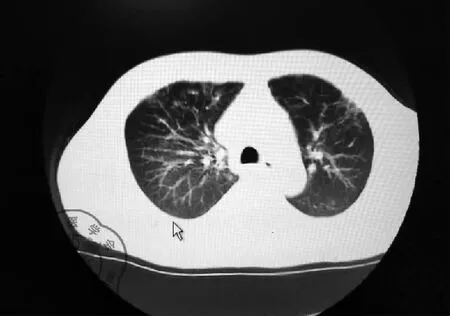
圖1 2020-2-18
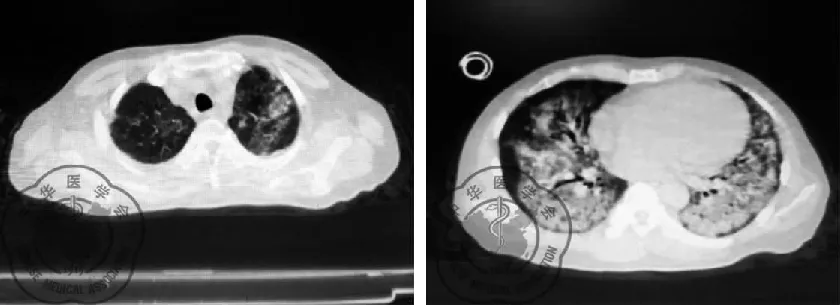
圖3 2020-2-27
既往史及流行病學史:患者罹患慢性腎炎10余年,2019年8月在“xx大學附屬醫院”行“同種異體腎移植術”, 術后長期規律使用“他克莫司+潑尼松+麥考酚酯”治療。2020年2月8日開始規律透析(隔日1次),入院前2 d停抗排異治療。否認武漢、湖北旅游、居住史。在某醫學院附屬醫院住院期間不能明確是否與醫院新冠確診患者有直接或間接接觸史。所住小區無確診及疑似病例,患者周圍無聚集性發病。
入院查體:體溫37.5 ℃,脈搏122次/min,呼吸35次/min,血壓123/79 mmHg,經皮血氧飽和度70%(轉運呼吸機,100%氧濃度)。急性面容,左前臂見一動靜脈瘺,雙上肢可見多處散在瘀斑。呼吸急促,口唇發紺。胸廓無畸形,呼吸音粗,雙肺聞及濕啰音。心率齊,未聞及病理性雜音。腹軟未見異常,雙下肢輕度凹陷性水腫。神經系統未見異常。
理化檢查:血生化:白蛋白:27.3 g/L;真菌G實驗:275 pg/ml;痰培養未查見酵母樣孢子及假菌絲;肺炎支原體IgM:陰性;血沉:116 mm/h;肝功能、凝血功能、糖化血紅蛋白基本正常;腦鈉鈦前體:2 432 pg/ml;肌酐:1 135 μmol/L,乳酸:0.5 mmol/L;D-二聚體:0.54 mg/L;TORCH: 巨細胞病毒抗體:IgM陰性,IgG 陽性,單純皰疹病毒抗體:IgM陰性、IgG 陽性。EB病毒核酸陰性;肺炎支原體IgM陰性;甲型、乙型流感病毒核酸陰性。
入院診斷:①重癥肺炎 新冠肺炎疑似患者不除外; ②急性呼吸窘迫綜合癥;③呼吸性堿中毒;④慢性腎功能衰竭;⑤高鉀血癥; ⑥低蛋白血癥; ⑦腎移植術后;⑧腎性高血壓;⑨中度貧血 。
治療經過:予以無創呼吸機輔助通氣,“美羅培南、莫西沙星、膦甲酸鈉、磺胺”抗感染治療,甲潑尼龍80 mg抗炎、降壓、糾正低蛋白血癥、床旁持續血液透析、營養支持等綜合治療。于2月29日行痰、鼻咽、口咽拭子檢查:陰性;血清抗體IgM:弱陽性;3月2日:氣道分泌物二代基因測序(NGS):未查見新冠病毒。3月3日 再次行痰、鼻咽、口咽拭子檢查:陰性;血抗體IgM:弱陽性;3月5日采用我院新試劑、同時標本送外院行新冠病毒血清抗體檢測:IgM(陰性),IgG 陰性;肛拭子新冠病毒核酸陰性,于3月6日解除隔離。經積極綜合治療,病情逐漸好轉,于3月21日轉至普通病房。
討 論
43歲男性患者,腎移植術后半年,平日抗排異治療,因移植腎出現功能不全已行規律透析治療。此次因“發熱、咳嗽10余天,呼吸困難4 d”入院,經救治成功,我們想分享下在救治過程中的一些體會。
一、明確發熱部位
對于腎移植術后患者,長期口服免疫抑制劑抗排異治療,屬于免疫功能受損人群,一旦出現發熱,首先應考慮感染性因素所致。患者雖有尿血,但化驗并沒有泌尿系感染依據,根據常規生化檢查可以排除其他系統感染。因患者伴有咳嗽、咳痰等呼吸道癥狀,呼吸頻率快,大于30次/min,結合胸部CT變化、氧合指數小于250 mmHg,需要機械通氣,故考慮感染定位在肺,臨床診斷重癥肺炎,符合內科學第8版診斷標準[7]。
二、分析可能存在的病原體
明確肺炎診斷及嚴重程度后,需進行病原學診斷。腎移植術后機體處于免疫抑制狀態,很容易引起機會性感染,如細菌、真菌、病毒、葉氏肺孢子菌(PCP)感染等。從患者起病后血象不高,淋巴細胞下降,結合影像學特征,主要考慮病毒感染可能,巨細胞病毒、腺病毒可能性大,不排除流感病毒,從影像學上看PCP不太典型,但不能完全除外。圍繞病毒檢查先后發現巨細胞病毒DNA:陽性,5.36×103,巨細胞病毒抗體IgG 陽性、單純皰疹病毒抗體IgG 陽性,未發現甲流、乙流病毒感染依據,因條件限制腺病毒無法檢測。此次患者入院期間正值新冠疫情在國內爆發流行階段,因血尿起病后住院,不明原因出現發熱,所在醫院有確診新冠病毒肺炎患者,外院雖予抗病毒、抗細菌、激素抗炎、透析等綜合治療,病情仍在持續加重,不排除該患者為新冠疑似病例。按照《新型冠狀病毒肺炎診療方案(試行第八版)》[8]內容,新冠疑似病例需結合流行病學史和臨床表現綜合分析,有流行病學史中的任何一條,同時必須符合臨床表現中任意2條。若無明確流行病學史的,則必須符合臨床表現中的3條。該患者14 d內在當地住院期間不排除與該院新冠確診患者有接觸史,故流行病學史不明確,臨床癥狀主要為發熱伴有咳嗽、進行性加重的呼吸困難,實驗室檢查提示早期白細胞總數正常,淋巴細胞計數下降至0.29,胸部CT提示:雙肺多發斑片狀、網格狀高密度影,少量條索狀高密度影,部分病灶在胸膜下。從臨床表現來看,符合第七版診療方案第1條、第3條臨床表現,影像學并非典型特征,但考慮到該患者長期口服免疫抑制劑,應考慮混合感染可能,故考慮該患者為疑似病例,從臨床分型來看,該患者此次急性起病,迅速發生呼吸衰竭,需要無創呼吸機輔助通氣,符合危重型的診斷標準。后期降鈣素原(PCT)、C反應蛋白(CRP)和血沉升高,反映機體存在混合感染可能,考慮到患者肺部病灶進展迅速,呼吸衰竭加重,病原微生物尚不能完全明確,故在不斷查找病原學依據上暫時予以廣覆蓋治療。
三、進一步明確或排除新冠肺炎
按照第七版診療方案內容,一旦發現符合病例定義的疑似病例后,應當立即進行單間隔離治療,并釆集標本進行新型冠狀病毒核酸檢測。若疑似病例連續兩次新型冠狀病毒核酸檢測陰性(釆樣時間至少間隔24 h)且發病7 d后新型冠狀病毒特異性抗體IgM 和IgG仍為陰性可排除疑似病例診斷,但因該患者2次血清抗體IgM均為弱陽性,故排除過程變得比較困難。由于患者入科后腎功能衰竭,尿少、代酸嚴重,氧合較差,通過持續透析可以改善氧合,故暫未中途轉院治療,遂將其置于隔離區的單間,醫護標準防護。同時再次完善多部位復檢,如鼻咽拭子、肛拭子、痰NGS、血清新冠病毒抗體。經過2次氣道分泌物、鼻咽拭子、口咽拭子新冠病毒核酸檢測、氣道分泌物NGS、3次新冠血清學抗體及1次肛拭子檢測,第6天排除疑似,解除隔離。那么在臨床中我們如何看待核酸假陰性和血清抗體假陽性呢?在2月9日針對新冠肺炎患者核酸檢測出現“假陰性”的情況,北京大學人民醫院呼吸與危重癥醫學科主任高占成在國務院聯防聯控機制舉行新聞發布會上指出,任何病毒核酸檢測的檢出率都不可能是100%,對新型冠狀病毒的核酸檢測也不例外,出現“假陰性”在所難免。檢出率還可能與患者病情輕重程度、病程發展階段、樣本取材和實驗室檢測條件等多種因素有關。國家衛健委發布《新冠肺炎實驗室檢測技術指南》[9]特別指出,陰性結果也不能排除新型冠狀病毒感染,需要排除可能產生假陰性的因素,包括:樣本質量差,比如口咽等部位的呼吸道樣本;樣本收集的過早或過晚;沒有正確的保存、運輸和處理樣本;技術本身存在的原因,如病毒變異、PCR抑制等。對于還沒確診的患者,會被列為疑似患者,在后續診治過程中,需要多次進行核酸檢測和鑒別診斷,最終得到明確結果。因此在這例患者院外核酸陰性,但仍不能完全排除新冠肺炎情況下,我們復查新冠病毒核酸,并持續跟進了血清抗體。入科后新冠病毒血清抗體IgM檢測結果為弱陽性,這樣的結果困擾了我們的臨床決策。在2020年3月3日國家衛健委發布的“新型冠狀病毒肺炎診療方案(試行第七版)“中,新型冠狀病毒特異IgM和IgG抗體檢測被作為臨床確診標準。但在臨床實踐中發現存在較多的假陽性。從機體對病原體的體液免疫應答來看,最早出現的抗體是IgM,然后是IgG抗體,當IgG抗體出現后,濃度會持續增高,IgM則持續降低,直至消失,IgG抗體會較長時間存在。因此,特異IgM和IgG抗體是一對出現有序,此消彼長的一個關系。因此正確地利用及觀察IgM/IgG的動態變化,有助于在病毒核酸檢測這個臨床診斷“金標準” 失效后(因病程、標本采集等所致的假陰性)的2019-nCoV感染的診斷[10]。新型冠狀病毒特異性IgM抗體多在發病 3~5 d后開始出現陽性,IgG抗體滴度恢復期較急性期有4倍及以上增高,通過動態變化來判斷IgM和IgG檢測陽性的真假,從而避免假陽性結果對臨床診斷的誤導。
四、重視原發病的治療
這是治療所有疾病的關鍵,患者移植術后半年,此次因血尿就診,分析病因應該考慮到移植腎排斥反應、移植腎腎病復發,泌尿系感染、結石、腫瘤,凝血功能障礙,自身免疫系統疾病等。該患者在當地醫院和我院均圍繞血尿進行了相關的病因排查,最后考慮主要系移植腎排斥反應所致,因考慮繼發肺部感染較重,外院已停用抗排異藥(他克莫司+潑尼松+麥考酚酯)。若持續血尿,貧血難以糾正,則需要外科干預,對移植腎動脈進行栓塞治療。近年來,關于激素治療病毒性肺炎的報道多是針對流感病毒的,尤其是幾次流行性流感大爆發,除 SARS 及流感等爆發性流行性病毒性肺炎外,激素治療其他病毒性肺炎的報道較少[11]。糖皮質激素在COVID-19中的應用由于沒有RCT研究證據,具有爭議。研究結果顯示,中低劑量的糖皮質激素可降低重癥病毒性肺炎患者的病死率和縮短住院時間,而不會導致繼發感染或其他并發癥[12]。國內回顧性研究結果顯示,中低劑量糖皮質激素對病毒清除時間未見明顯影響,重癥型患者可能有潛在受益[13]。由于初期我們未能完全排除新冠病毒感染,故我們給予患者甲潑尼龍針劑5 d 80 mg,爾后為改善腎移植術后排斥反應,甲潑尼龍片16 mg/日維持,為后續移植腎動脈進行栓塞治療提供可能。
五、加強ARDS治療
ARDS是指在多種原發疾病的發展過程中繼發的,以呼吸窘迫、頑固性低氧血癥和非心源性肺水腫為特征的一種急性進行性呼吸困難。肺部感染除創傷、休克外居于三大誘因之首。該患者氧合指數≤200 mmHg,with PEEP≥5 cmH2O,按照2012柏林定義[14],該患者病情分級為中度ARDS,需警惕發展至重度ARDS。在治療過程中,肺保護性通氣策略貫穿ARDS機械通氣治療始終[15],其目的是讓呼吸肌休息并且保持充足的氣體交換,同時減輕呼吸機相關性肺損傷(VILI)的不利影響。該患者入科后使用無創呼吸機輔助通氣,3月2日床旁胸片。發現縱膈、右側頸部皮出現少量積氣,原設置 6 ml/kg小潮氣量,平臺壓在30 cmH2O左右,仍發生了呼吸機相關肺損傷。曾有Terragni研究表明,將部分ARDS患者的潮氣量進一步降低至4 ml/kg左右、平臺壓控制在25~30 cmH2O時,肺損傷會明顯減輕。于是我們在pH、二氧化碳水平可控情況下調節呼吸機支持參數,進行更小潮氣量通氣策略,提高氧濃度,減少低氧對呼吸中樞的驅動,降低跨肺壓,從而減輕氣壓傷,并密切關注皮下氣腫消退情況,定時床旁胸片檢查,床旁胸穿閉式引流包備用,同時輔以鎮咳治療,保持大便通暢,避免引起氣胸加重的誘因。3月4日床旁胸片提示:左側(少量)氣胸。但接下來隨著病情逐漸好轉,患者呼吸頻率逐漸下降趨于平穩,氣胸逐步吸收,經過11 d的治療,縱膈、皮下,胸膜下氣體完全吸收。對該患者的恰當處理,避免發生嚴重氣胸,進一步加重呼吸衰竭。
六、其他治療
定期監測各臟器功能,維持內環境穩定,營養支持治療,關注心理健康。該患者入科前已規律透析,對于此類腎功能衰竭患者應注意水電解質平衡。在營養支持治療方面應考慮到氮平衡、熱量和微量元素等補充。該患者入科后立即透析,解決了高鉀血癥、肺水腫、水負荷過重問題,對多器官功能不全時的液體管理發揮了重要作用。該患者早期住院期間,由于新冠疑似診斷待進一步明確,患者常存在焦慮、恐懼情緒[7],也會有悲觀失落甚至自殺念頭,在對這個患者救治過程中均發現有上述情緒的變化,及時與患者加強心理疏導,最終情緒逐漸穩定下來。
新冠疫情期間,我科收治的這例腎移植術后抗排異治療患者,由于流行病學史不明確,有咳嗽伴發熱、呼吸困難癥狀,肺部影像學不能完全排除新冠感染,臨床診斷重癥肺炎,新冠肺炎疑似不除外,在新冠病毒排查階段我們將多次的新冠病毒核酸與血清抗體檢測相結合,最大程度地避免了假陽性對臨床的誤導,提高了診斷準確率,同時在救治過程中始終堅持以患者為中心,不輕言放棄,盡最大努力救治,最終逆轉病情,使患者轉危為安。

