微生物果膠酶的研究進展
楊同香 - 吳孔陽 - 白云飛 - 陳俊亮 - 萬蘇艷 - 楊如夢 -
(1. 河南科技大學食品與生物工程學院,河南 洛陽 471023;2. 洛陽師范學院生命科學學院,河南 洛陽 471934;3. 河南三劍客農業股份有限公司,河南 漯河 462000)
果膠酶是水解酶家族的成員,是一類能夠降解果膠分子的多種酶的總稱,包括聚半乳糖醛酸酶(polygalacturonase,PG)、果膠酯酶(pectin esterase,PE)和果膠酸裂解酶(pectate lyase,PL)等[1]。果膠酶在全球食品酶制劑市場中占有25%的份額,另外在紡織工業、造紙工業、醫藥工業、廢水處理、動物飼料生產及原生質體融合等諸多領域應用廣泛[2]。果膠酶廣泛存在于動物、植物及微生物體內。由于受原料、提取工藝及季節等諸多因素限制,果膠酶主要由微生物發酵制備。與許多其他工業酶一樣,果膠酶在生產中也面臨逐步提高產量、生產率等問題[3]。目前,中國對微生物果膠酶開展了廣泛的研究,但是缺乏較為系統的分析和概況。鑒于此,文章就高產果膠酶菌株的篩選、育種技術、影響產酶因素、酶的生化性質以及酶的固定化進行綜述,以期進一步推動果膠酶的理論和應用研究。
1 高產果膠酶菌株的篩選
微生物果膠酶的來源廣泛,細菌、放線菌及真菌等均能產生。由于果膠分子主要是α-1,4連接的D-半乳糖醛酸殘基組成[4],因此分離培養基中的碳源通常是果膠,且作為唯一碳源。目前報道篩選產果膠酶菌株的方法主要有剛果紅法、碘試劑法和溴酚藍法。例如,Zhou等[5]以果膠為唯一碳源,平板培養后經剛果紅染色篩選,從煙葉中分離得到一株果膠酶活力高的菌株BacillussubtilisPB1。但也有學者[6-7]使用了其他試劑進行篩選,例如,譚秀華[6]在菌落周圍加入1% CTAB,靜置15 min后,通過觀察是否有無色透明圈產生來篩選果膠酶產生菌,并得到一株枯草芽孢桿菌。另外利用釕紅也可以輔助篩選果膠酶產生菌[8-10]。當然,研究人員[11-13]也可以不借助指示劑或染料所形成的透明圈、變色圈等進行篩選,還可以通過直接測定果膠酶活性來篩選。例如,寧振興等[11]在含有廣西六堡茶的蔗糖察氏液體培養基分離純化菌株,并通過測定果膠酶和纖維素酶活性,篩選得到一株能高效降解梗絲果膠和纖維素的塔賓曲霉(Aspergillustubingensis)。對于想要獲得某一特定類群的微生物時,往往在培養基中加入抗生素來抑制其他微生物的生長。例如,Haile等[14]在分離具有果膠酶活性的酵母菌時,在YPDA培養基中加入0.01%的青霉素來抑制細菌的生長,并篩選得到多株具有果膠酶活性的酵母菌,如表1中所示。而楊斯超[15]則通過在YPD培養基中加入鏈霉素和氯霉素來抑制細菌,并篩選得到一株產果膠酶的酵母菌PPY-1。
從上述篩選的菌株以及表1中展示的微生物類型可以看出,目前報道的果膠酶產生菌主要以絲狀真菌和芽孢桿菌為主,也有學者[16-17]發現一些酵母菌和歐文氏菌產果膠酶。對于低溫果膠酶菌株的篩選,學者們[18-19]也開展了相關研究。例如,在南極海綿中發現的南極真菌Geomycessp F09-T3-2,在低溫條件下表現出較高的果膠酶活性,表明該菌株在低溫果膠酶領域具有潛在應用價值[18]。總的來說,在分離產果膠酶菌株時,要結合各種方法的特點和試驗條件進行篩選。比如剛果紅染色法,一般果膠用量少,靈敏度高,難點是要控制好染色時間,而CTAB法則是果膠用量大,使用受限。

表1 近5年報道產果膠酶的菌株
2 果膠酶菌株的育種
2.1 誘變育種
誘變育種是目前工業菌種選育常用的方法,盡管常規的物理或化學誘變方法工作量大,育種效率稍低,但仍然是果膠酶高產菌株選育的重要方式[33]。通過這些方式獲得的高產突變菌株,其酶活性較出發菌株均有較大幅度提高,其中杜國軍等[34]采用亞硝酸—紫外線對黑曲霉HY-D3進行誘變處理,突變株HY-LL3酶活力達到了3 124 U/g,提高了3.59倍。同樣黃丹梅等[35]采用紫外線對黑曲霉菌株誘變,突變株的酶活力提高了3倍。此外,微波誘變方法可以獲得高產果膠酶菌株。例如,何海燕等[36]利用微波照射誘變處理棘孢曲霉D80菌株,篩選出一株酶活力大幅度提高的正突變菌株DW75,是出發菌株D80酶活的2.47倍。
值得提出的是,近年來新發展的常壓室溫等離子體(Atmospheric and room temperature plasma,ARTP)誘變育種技術已成功應用于細菌和真菌等微生物,在生物育種領域應用上表現出十分出色的誘變效果,具有突變快、突變多樣性高、簡單易行等優勢,已成為高效快速誘變微生物基因組的有效方法之一[37-38],而目前利用該技術來選育果膠酶菌株還鮮有報道,今后可以嘗試將其作為果膠酶菌株選育的一種策略。
2.2 基因工程育種
為提高果膠酶產生菌的產酶水平,學者們嘗試利用基因工程技術開展果膠酶菌種的選育。目前應用于果膠酶工程菌構建的系統主要是大腸桿菌表達系統和酵母表達系統。其中大腸桿菌表達系統是目前表達外源蛋白的首選,例如,Yuan等[39]將多黏類芽孢桿菌KF-1果膠酸裂解酶基因PpPel9a在大腸桿菌BL21(DE3)中表達,以PGA作為底物,其最高酶活力達到(117.40±4.82) U/mg。Tang等[40]將馬賽屬細菌M.eurypsychrophila果膠酸裂解酶基因pel1克隆,在大腸桿菌BL21(DE3)中成功表達,以0.2%的PGA為底物,其比活力達到78.75 U/mg。Liu等[41]選擇大腸桿菌BL21(DE3)表達了來源于枯草芽孢桿菌JL-13果膠酸裂解酶基因,結果重組酶比活力高達(197.40±5.20) U/mg。Zhou等[42]利用大腸桿菌表達系統成功實現了來自克勞氏芽孢桿菌BacillusclausiiS10果膠酸裂解酶基因的過量表達,其比活力高達675.5 U/mg。而同樣的表達系統過量表達地衣芽孢桿菌Bacilluslicheniformis91果膠酸裂解酶,其比活力最高為320 U/mg。相比較于原核表達系統,真核表達系統的發展則較為緩慢。但隨著對其表達機制的深入研究,來源于高等生物的基因更適合于真核生物表達系統來表達。比如Aspergillusluchuensisvar.saitoi果膠酸裂解酶基因AsPelA,研究人員將其克隆并在畢赤酵母KM71H中表達,發現經過熱處理后重組酶還能達到未處理前64%的酶活力[43]。此外,研究人員還嘗試了將微生物源果膠酶基因在動物細胞中表達的研究,莫健新等[44]通過脂質體轉染法將構建的攜帶有微生物源果膠酶基因pg5a、pgI、pga3A和pgaA的真核表達載體轉入豬PK15細胞中進行異源表達,結果發現4種果膠酶基因均能在豬PK15細胞中轉錄出mRNA,但只有pg5a和pgI可以表達出有活性的果膠酶,最高酶活為0.95 U/mL。
2.3 分子定向進化育種
利用結構生物信息學、酶工程等技術對酶進行合理的改造,成為進一步提高酶活性和穩定性的重要手段,也成為獲得具有商業價值酶的潛在途徑[45]。科研人員[46]從芽孢桿菌Bacillussp. N16-5果膠酸裂解酶基因(spPelA)出發,通過易錯PCR構建隨機突變體文庫,經過兩輪易錯PCR,從上萬個突變體中篩選出10個熱穩定性增強的突變體,其中熱穩定性好的組合突變體EAET較野生型Bacillussp. N16-5果膠酸裂解酶酶活性增加了140倍。Wang等[45]采用易錯PCR對來源于Bacillussubtilis168果膠酸裂解酶基因進行隨機突變體文庫構建,利用高通量篩選方法分離出5個果膠酸裂解酶活力較高的突變體。與Bacillussubtilis168果膠酸裂解酶相比,突變體K47E的活力最高。此外,該研究還結合點飽和突變技術進一步篩選,獲得的K47D/V132F酶活力更高,其比活力是Bacillussubtilis168的3.9倍。不僅如此,通過點飽和突變和隨機突變技術處理短小芽孢桿菌Bacilluspumilus(ATCC 7061)時,也取得了滿意效果。
除上述育種方法外,DNA改組技術(DNA shuffling)也被應用于果膠酶菌株的改造。例如,Yu等[47]將出發菌株枯草芽孢桿菌ZGL14進行紫外—60Co輻射誘變處理,以獲得的5株突變株和ZGL14為親本菌株進行融合,結果發現經過兩輪DNA改組技術,得到一株酶活力達到499 U/mL的突變株FS105,其酶活力較出發菌株提高了1.6倍。
3 影響果膠酶產量的因素
在工業酶制劑生產上,主要通過固態發酵和液體深層發酵技術完成,目前所報道的果膠酶生產亦是如此。近年來,果膠酶的固態發酵和液態深層發酵均有報道。除菌株自身差異外,外部環境條件對果膠酶的發酵生產影響較大,主要包括培養基成分和發酵條件和方式等。
3.1 培養基組成
目前工業上果膠酶生產菌主要是黑曲霉,作為食品級果膠酶的生產菌株,其安全性也得到普遍認可。另外在培養基優化方法選擇上,響應面優化方法應用較為廣泛[17, 48-50]。另外在基質選擇上,廉價的麩皮往往會成為果膠酶生產的重要原料[51]。Bibi等[29]以農副廢棄物粗級提取的木聚糖和果膠、麩皮和桔皮為底物,通過響應面優化了BacilluspumilusAJK液體發酵生產木聚糖酶和果膠酶條件,結果發現在最適底物濃度下,木聚糖酶和果膠酶或性最高分別達到(415.22±18.50),(109.10±8.80) IU/mL,進一步分析得出,該菌株具有多種果膠酶活性,其中外切聚甲基半乳糖醛酸酶18.98 IU、內切聚甲基半乳糖醛酸酶0.14 IU,外切多聚半乳糖醛酸酶80 IU,內切多聚半乳糖醛酸酶0.28 IU,聚甲基半乳糖醛酸裂解酶1.42 IU,聚半乳糖醛酸裂解1.47 IU以及果膠酯酶0.15 IU。
培養基中碳源、氮源以及無機鹽等對菌株產酶的影響不同。菌體生長依賴于合適的碳源和氮源,Abdullah等[52]在優化黑曲霉ABT-5產果膠酶培養條件時,發現當果糖和尿素作為碳源時可獲得最大果膠酶活力。Amin等[53]研究發現在固態發酵工藝下,當初始pH 3.0、35 ℃、含有甘氨酸、果膠和MnSO4存在時,Penicilliumnotatum產多聚半乳糖醛酸酶活性較高,而在初始pH 5.0、30 ℃、濕度50%、含有CaCO3、(NH4)2SO4、乳糖作為營養源時,Coriolusversicolor產多聚半乳糖醛酸酶活性較高。Chen等[54]以中藥皂甙提取物為底物,利用枯草芽孢桿菌發酵生產蛋白酶和果膠酶,初步優化后果膠酶活力達到227 U/mL,而當在提取物中加入5%葡萄糖發酵后,果膠酶活力可達到1 390 U/mL。以上研究表明,在遵循微生物基本生長特性情況下,嘗試采用不同的營養成分以及進行合理組合對提高果膠酶產量起到積極的作用。
3.2 發酵條件和方式
表2展示了近年來有關微生物果膠酶發酵條件研究的報道。有關微生物果膠酶發酵條件優化方法也是以響應面優化試驗居多[55-58]。例如,Mahesh等[57]利用響應面法優化了Aspergillusibericus果膠酶發酵條件,結果發現當pH 4.0、發酵溫度40 ℃、發酵時間120 h,以2%果膠為底物的情況下,該菌株所產果膠酶活力達到69.6 U/mL。Bibi等[59]通過中心組合試驗優化Bacilluslicheniformis果膠酶發酵條件,確立了pH、溫度、接種量等參數,在最優條件下該菌所產果膠酶活力達到219 U/mL。Ortiz等[60]研究了AspergillusgiganteusRRL10產果膠酶的固態發酵工藝,通過響應面試驗設計篩選出RRL10產酶條件,確定了pH、溫度和CaCl2是影響產酶的重要因素。此外,Kaur等[61]優化了BacillussubtilisSAV-21固態發酵條件,發現在溫度35 ℃,濕度60%、pH 4.0,發酵96 h時果膠酶活力最高。
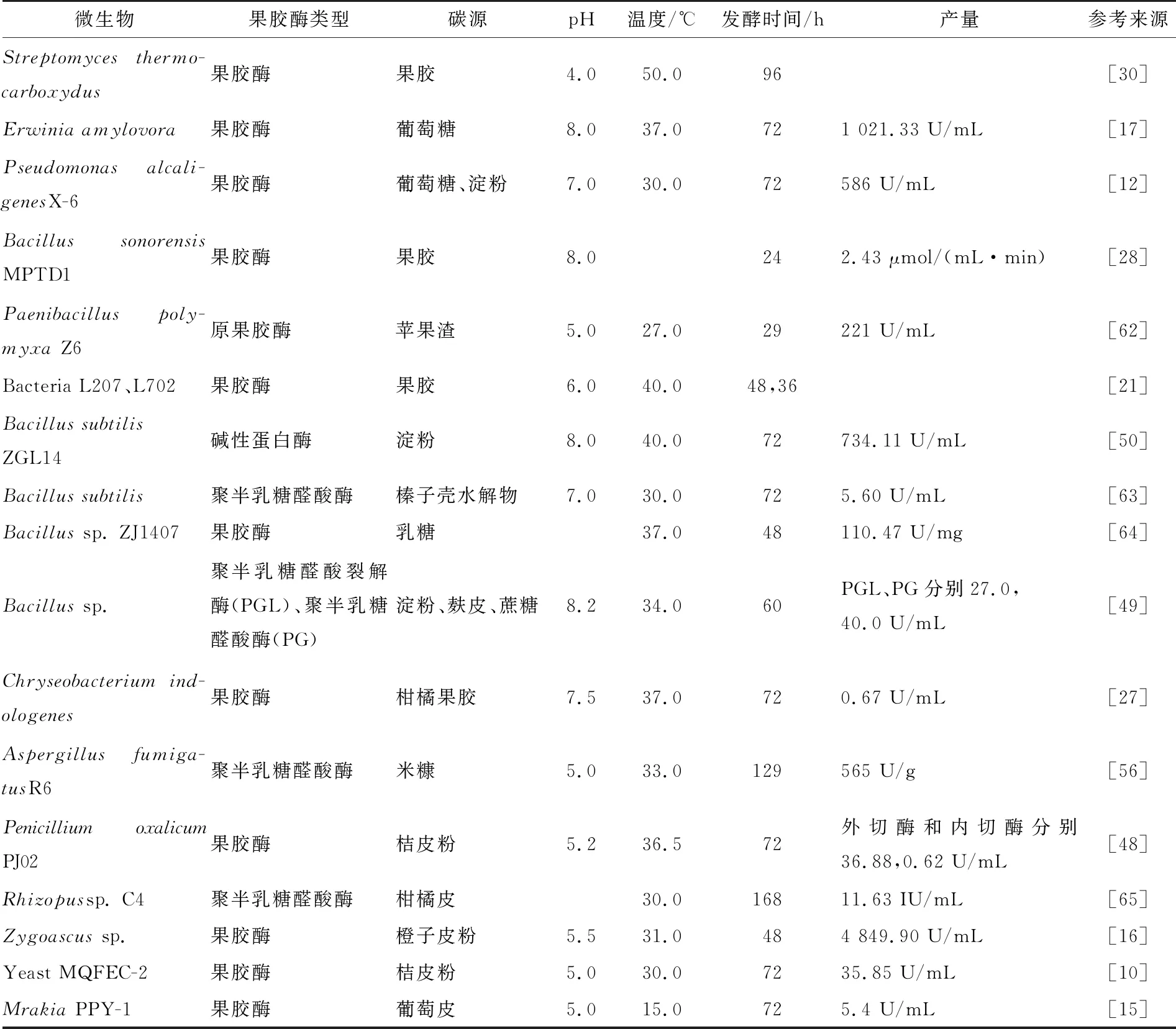
表2 不同菌株的果膠酶發酵條件及產量?
相比于培養基和發酵條件對果膠酶菌株產酶影響,細胞固定化也是影響菌株產酶的一個因素[66-67]。例如,Ejaz等[67]研究了固定化GeotrichumcandidumAA15細胞產果膠酶的參數,結果發現固定化GeotrichumcandidumAA15果膠酶酶活性為0.554 IU/mL,遠高于游離細胞0.215 IU/mL的酶活。之后,Ahmed等[66]對比了GeotrichumcandidumAA15細胞在游離狀態下和固定化狀態下對產果膠酶的影響,同樣發現經玉米芯固定化的GeotrichumcandidumAA15表現出更高的酶活性,且不表現出分解代謝物阻遏作用。
4 微生物果膠酶的生化性質
從報道的果膠酶分子量來看,多數微生物果膠酶的分子在30.0~70.0 kDa,如Kumar等[68]報道的芽孢桿菌和放線菌果膠酶的分子量分別是34.9,45.1 kDa。不同菌株之間果膠酶分子量差別較大,即使同一種果膠酶,分子量也有差異。Barma等[69]報道的黑曲霉果膠酶分子量在34.0~42.0 kDa,而Anand等[70]報道的黑曲霉MTCC478所產的外切聚半乳糖醛酸酶分子量為124.0 kDa。一般細菌果膠酶最適溫度相對于真菌果膠酶而言相對較高,能夠達到50~60 ℃,但是也要注意有些真菌外切聚半乳糖醛酸酶最適溫度能夠達到60~65 ℃[71-72],Tounsi等[73]報道的Penicilliumoccitanis聚半乳糖醛酸酶最適溫度甚至高達70 ℃。對于最適pH研究,可以發現細菌果膠酶主要集中在pH 7.5~10.0,而真菌果膠酶最適pH主要集中在pH 4.0~7.0,當然也有部分堿性果膠酶菌株存在。通過對比可以看出,微生物果膠酶可能具備在各種復雜環境條件下降解基質的特性,并具有較為廣泛的適應性。針對微生物果膠酶pH穩定性、溫度穩定性等研究,可以發現一些真菌果膠酶通常都具有良好的熱穩定性和pH穩定性,Bennamoun等[7]發現Aureobasidiumpullulans在最優培養條件下,其所產果膠酶在5~90 ℃、pH 5.0~10.0范圍內穩定,最適溫度和pH分別為60 ℃和5.0。Ma等[74]報道的黑曲霉SW06外切聚半乳糖醛酸酶在pH 3.0~5.0、溫度60 ℃以下穩定。另外研究人員[64,75]發現不同金屬離子對果膠酶活性影響顯著,其中Fe3+、Ba2+、Ca2+、Cu2+等對酶活力有提高作用,而Mn2+、Ag+對酶活力有抑制作用。不過在已有研究[76]中發現Ca2+也能夠抑制外切聚半乳糖醛酸酶活性。因此對于金屬離子對酶活性的影響,也要因菌株差異而加以確定。
此外,Bekli等[77]比較了源于解淀粉芽孢桿菌BacillusamyloliquefaciensS6果膠酸裂解酶和重組果膠酸裂解酶(PelS6)的生化性質。結果發現PelS6與枯草芽孢桿菌Bacillusamyloliquefaciens168果膠酸裂解酶的氨基酸序列同源性為100%。雖然這兩者在基因序列上非常接近,但在生化性質上卻差異顯著,相比較Bacillusamyloliquefaciens168的酶活力(12.8±0.3) U/mg,重組酶活力更高,達到(49.6±0.4) U/mg。
5 果膠酶的固定化研究
酶固定化研究已形成了相對完善的技術體系,包括固定酶的載體材料體系和無載體固定化體系。目前果膠酶固定化以及應用已有諸多研究報道[78-79],主要從固定化載體、固定化條件對酶活性影響等方面進行介紹。
用于固定化的載體材料有很多種,如無機載體、磁性納米材料、天然高分子和合成高分子載體等。其中磁性納米材料以其可控的尺寸、比表面積大以及良好的生物相容性等特性廣泛應用于果膠酶的固定化研究中[80-81]。例如,Fang等[82]開展了磁性復合材料Fe3O4@SiO2-NH2固定果膠酶的研究,結果發現固定化果膠酶在循環利用7次后仍保持64.4%的酶活性,且貯藏30 d后還能保持21.1%的酶活性。同樣Dal-Magro等[83]報道磁性殼聚糖固定果膠酶的研究,結果發現在橙汁澄清處理工藝中,固定化的果膠酶循環使用25次后,仍然能保持85%的酶活性,這與de Oliveira等[84]報道海藻酸鈉固定化Aspergillusaculeatus果膠酶處理蘋果汁所起的作用相似。從這些研究中可以看出,利用這些磁性復合材料的應用極大地提高了果膠酶的重復利用率。
由于固定化酶的活性受載體類型、粒徑、交聯劑、緩沖體系以及超聲波等諸多因素影響[85-86],因此在果膠酶固定化研究過程中也應重視。例如,Alag?z等[87]發現分別使用戊二醛和3-GPTMS將果膠酶固定在弗羅里硅土和納米二氧化硅上,用3-GPTMS參與固定的果膠酶完全失去了活性,而用戊二醛固定在弗羅里硅土和納米二氧化硅上的果膠酶分別保留了10%和75%的酶活性,而且納米二氧化硅固定化的果膠酶催化效率比固定在弗羅里硅土的果膠酶高6.3倍。Rehman等[88]研究了瓊脂包埋法固定化果膠酶的條件,結果發現當瓊脂用量增加到3%時,固定化的果膠酶活力達到最高。同時還發現與游離酶相比,固定化的果膠酶最適反應溫度和最適反應pH均發生了變化,分別由原來的45 ℃變為50 ℃,pH由10.0變為9.0。最適反應溫度變化可能與固定化果膠酶反應需要更多的活化能有關,而最適pH發生改變則與在包埋微環境下果膠酶結構和構象穩定性有關。Mahesh等[57]采用納米多孔活性炭固定化Aspergillusibericus果膠酶,同樣發現與游離酶相比,固定化果膠酶熱穩定得到提高。此外,Mahmoud等[89]比較了綠色木霉Trichodermaviride果膠酶在游離態、海藻酸鈉微膠囊以及海藻酸鈉納米膠囊固定化條件下性質變化。其中納米膠囊固定化果膠酶最適pH與游離酶相比,由原來的pH 6.0變為4.5,這與Rehman等[88]研究結果相似,同時經過固定化的果膠酶,pH穩定性和溫度穩定性也會發生變化,固定化的果膠酶對酸和溫度的耐受性進一步提高。
6 展望
果膠酶因其良好的生物催化功能而廣泛應用于各類工業催化過程中。隨著對微生物果膠酶的深入研究和應用實踐,人們期望獲得純度更高、價格更為低廉的果膠酶。與此同時,中國學術界及產業界在果膠酶菌種篩選、誘變育種、工程菌構建、發酵工藝優化以及酶的固定化等方面進行了長期的研究和探索,使得具有各種特性的微生物果膠酶進一步應用成為可能。
結合中國微生物果膠酶研究現狀,筆者認為今后在以下幾個方面仍需要加強科學研究:① 如何開發熱穩定性更高的耐高溫果膠酶以及能夠更好適應酸性或堿性環境下的果膠酶;② 如何構建過量表達的優良工程菌株;③ 如何開發先進的發酵工藝,有效提高生產效率及降低成本;④ 加強果膠酶固定化研究開發工作,進一步提高酶的穩定性以及重復利用率。另外從果膠酶的分子進化研究來看,依賴于生物信息學、蛋白質工程及分子生物學技術等,也有望獲得具有全新特性的果膠酶并應用于新的領域,這也將是微生物果膠酶研究的一個重要方向。總的來說,篩選性能更好的果膠酶產生菌、加強優良菌種選育以及上下游發酵工藝的優化是個長期過程。

