γ干擾素釋放試驗聯合IL-6檢測對活動性肺結核的診斷價值*
許敏殷,劉銀,劉麗蓉,王洪秀,楊景卉,王維萍,郎中平
(同濟大學附屬上海市肺科醫院 檢驗科,上海 200433)
由結核分枝桿菌引起的肺結核是全球公認的重大公共衛生問題,也是傳染病致死的第二大原因。據世界衛生組織(World Health Organization, WHO)估計,全世界約1/3 的人感染了結核分枝桿菌,其中約5%~10%患者為活動性肺結核[1]。由于活動性肺結核患者處于病灶活動期,傳染性強且病情進展速度快,故而及時有效地識別此類高危人群、盡早采取相應治療措施迫在眉睫。2010年,美國疾病控制與預防中心推薦使用γ 干擾素釋放試驗(interferon-γ release assay, IGRA)鑒別結核分枝桿菌感染[2]。然而有研究表明,IGRA 很難區分活動性肺結核與潛伏性結核感染患者[3],特異性較低,故而適用性受限。白細胞介素-6(Interleukin-6, IL-6)作為炎癥反應的促發因子,在免疫應答過程中扮演重要角色[4]。已有研究表明,活動性肺結核患者血清IL-6 水平升高[5]。本研究將血清IL-6 測定與IGRA 相結合,以期提高IGRA 診斷活動性肺結核的特異性。
1 資料與方法
1.1 一般資料
選取2018年6月—2019年6月同濟大學附屬上海市肺科醫院收治的700 例結核病患者作為研究對象,分為活動性肺結核患者587 例(A 組)和非活動性肺結核患者113 例(B 組)。A 組男性320 例,女性267 例;年齡18 ~75 歲,平均(42.80±15.97)歲。B 組男性64 例,女性49 例;年齡19 ~73 歲,平均(42.53±15.44)歲。另選同期本院體檢的100 例健康人群作為對照組。其中,男性60 例,女性40 例;年齡18 ~72 歲,平均(42.17±16.33)歲。納入標準: ①符合《肺結核基層診療指南(實踐版·2018)》[6]診斷標準,活動性肺結核患者痰培養為結核分枝桿菌陽性,胸片檢查呈斑片狀陰影或結核空洞;非活動性肺結核患者痰培養為結核分枝桿菌陰性,純蛋白衍生物皮試呈陽性;②無糖皮質激素類藥物及免疫調節劑使用史;③血常規檢查正常。排除標準: ①肝、腎功能嚴重異常;②嚴重精神類疾病;③合并其他肺部疾病;④合并惡性腫瘤。本研究通過醫院倫理委員會批準,患者及其家屬知情同意。
1.2 方法
1.2.1 血清IL-6 水平測定所有受試者于入院后次日清晨采集空腹狀態下肘靜脈血2 ml,血樣中加入肝素抗凝,采用化學發光法測定受試者血清IL-6 水平,試劑盒由德國西門子醫學診斷產品有限公司生產。
1.2.2 IGRA所有受試者于入院后次日清晨采集空腹狀態下肘靜脈血5 ml,血樣中加入肝素抗凝,按照每管1 ml 分裝至測定空白對照管、結合抗原管及撕裂原陽性對照管,置于37℃恒溫箱內靜置24 h。采用低溫高速離心機離心取血漿,保存于-20℃冰箱內待測;向微孔板中加入20μl樣品稀釋液及50μl培養液,向標準品孔中加入20μl 樣品稀釋液及各濃度梯度(12.5、25.0、50.0、100.0、200.0 和400.0 pg/ml) 的標準品50μl。在37℃環境中溫育處理約1 h,隨后加入50μl 酶抗體,置于37℃恒溫箱內靜置1 h。采用洗滌液洗滌,向各孔中加入A 液、B 液,每孔50μl,置于37℃恒溫箱內避光靜置15 min。加入終止液終止反應,并于10 min 內讀取酶標儀(瑞士TECAN 公司)上各孔450 nm 波長處的吸光度值。根據標準品抗原含量與吸光度繪制標準曲線,計算各管相應INF-γ水平,按照結核分枝桿菌特異性細胞免疫反應檢測試劑盒(北京萬泰生物藥業股份有限公司)說明書要求判定檢測結果。
1.3 統計學方法
數據分析采用SPSS 20.0 統計軟件。計量資料以均數±標準差(±s)表示,比較用方差分析,進一步兩兩比較用SNK-q檢驗;計數資料以率(%)表示,比較用χ2檢驗,進一步兩兩比較用χ2分割法,校正檢驗水準α=0.0125;繪制ROC 曲線,P<0.05 為差異有統計學意義。
2 結果
2.1 3 組基線資料比較
3 組年齡、性別、舒張壓、收縮壓、心率及TNF-α 水平比較,經方差分析,差異無統計學意義(P>0.05);而3 組TNF-6 水平比較,差異有統計學意義(P<0.05),A 組IL-6 水平高于B 組和對照組(P<0.05),且B 組高于對照組(P<0.05)。見表1。
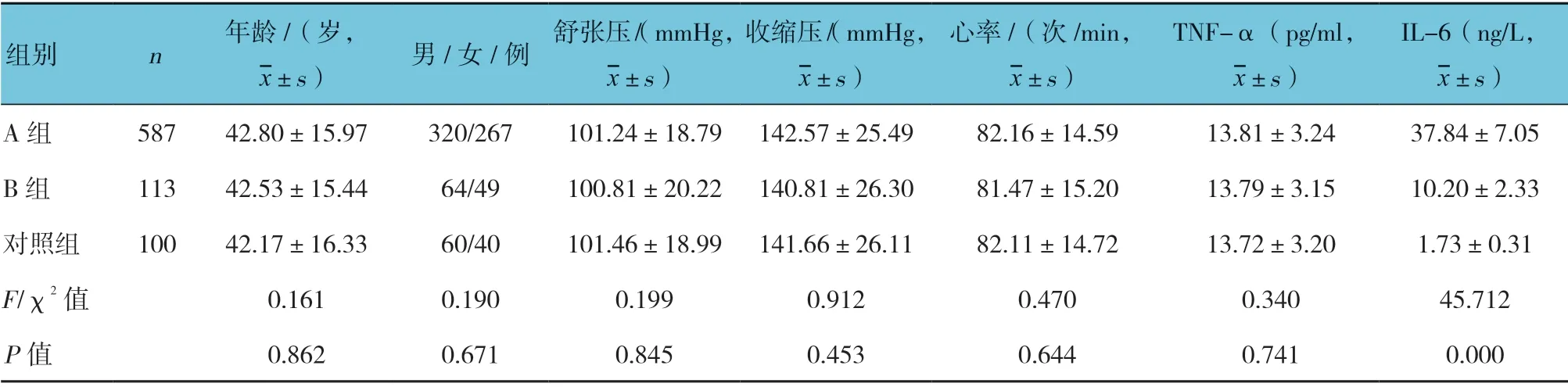
表1 3 組基線資料比較
2.2 3 組IGRA 陽性率比較
3 組IGRA 陽性率比較,經χ2檢驗,差異有統計學意義(P<0.05),A 組高于B 組及對照組,且B 組高于對照組。見表2。
2.3 IGRA、IL-6 對活動性肺結核的診斷效能
ROC 曲線分析,IGRA、IL-6 水平對活動性肺結核的診斷效能見表3。兩者聯合診斷的陰性預測值、陽性預測值、約登指數、敏感性及特異性均高于單一指標檢測。
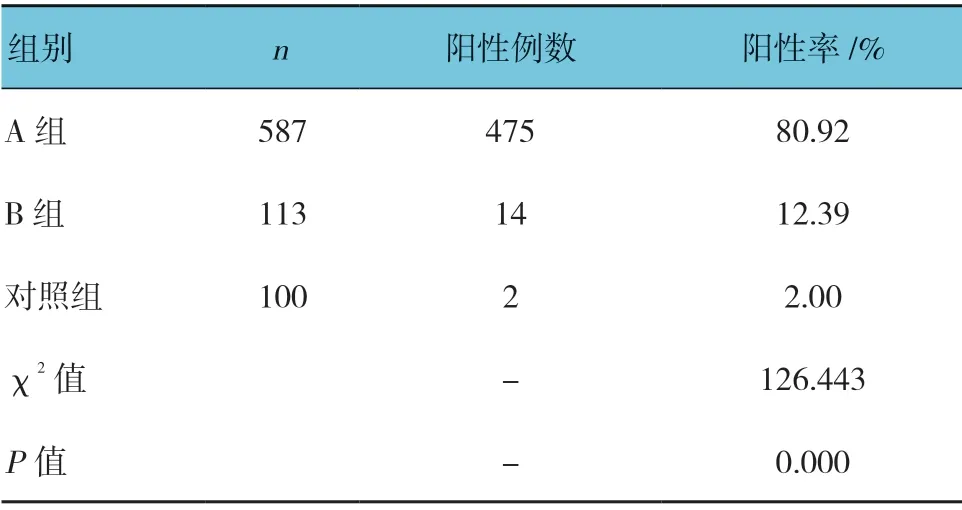
表2 3 組IGRA 陽性率比較
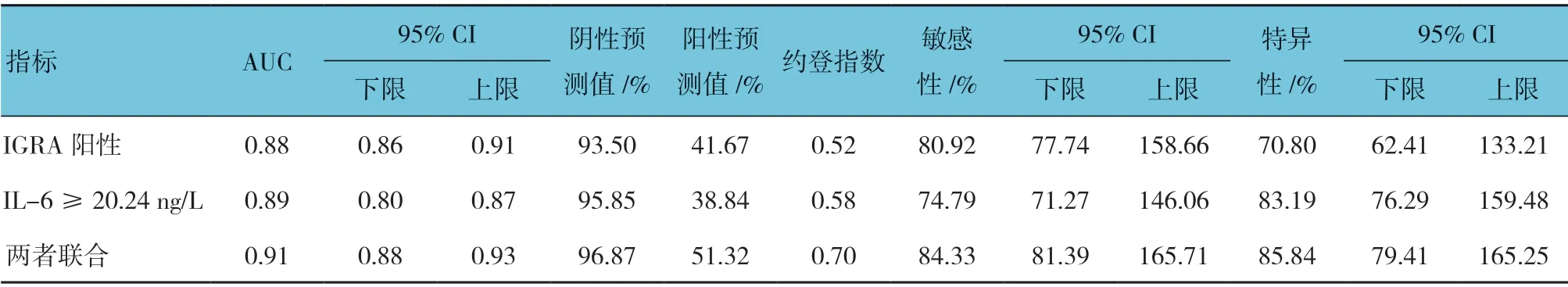
表3 IGRA、IL-6 對活動性肺結核的診斷效能
3 討論
結核病是由單一病原體引起的最致命的疾病之一,盡管1990年以來活動性肺結核患者的病死率有所下降,但是仍然被列為全球主要死因之一[7]。2016年,WHO 發起“結束結核病戰略”,旨在2035年結束全球結核病疫情[8]。早期和明確的診斷活動性肺結核有利于降低發病率、病死率和傳播率[9]。有統計數據顯示,中低收入國家用于結核病控制的資金約為800 億美元,其中8%用于發展結核病快速檢測方法和實驗室設備[10]。采用顯微鏡對臨床標本中微生物進行鑒定仍然是活動性肺結核的主要診斷方法,但其敏感性既依賴于操作者,又受到樣本中結核分枝桿菌豐度的影響[11];另一種診斷方法是結核菌素純化蛋白衍生物試驗,該試驗操作簡單,但檢測結果高度依賴于患者自身免疫功能,延遲的過敏反應及卡介苗接種史可導致假陽性結果,而免疫抑制、近期合并艾滋病病毒等感染、營養不良及高齡均可能導致假陰性結果[12]。目前我國對結核病的診斷仍然面臨挑戰。
IGRA 作為結核分枝桿菌感染的輔助診斷方法,可用于區分活動性肺結核、既往肺結核和非肺結核患者,但卻無法區分活動性肺結核和近期感染結核分枝桿菌的個體。本研究中,IGRA 診斷活動性肺結核的特異性僅為71.21%,與孫宇峰等[13]提出的IGRA 在活動性肺結核的診斷中特異性較低需要與其他標志物聯合檢測的結論基本一致。Th1 和Th2 細胞因子間的平衡反映了原始T 細胞活化的結果,并有助于闡明宿主對結核分枝桿菌的免疫保護特性[14]。IL-6 作為多效應性細胞因子之一,在抗結核過程中可促發炎癥反應[15]。本研究中,A 組IL-6 水平高于B 組及對照組,與ZENG 等[16]活動性肺結核患者體內HMGB1 相關IL-6升高結論相一致。LIU 等[17]指出,IL-6 釋放是活動性肺結核患者的潛在生物標志物。WU 等[18]研究發現,IL-6 等因子可用于鑒別活動性肺結核與潛伏性肺結核感染。為此本研究在IGRA 的基礎上聯合檢測IL-6,發現兩者聯合提升了診斷的敏感性及特異性,且此2種檢測方法只需抽取患者外周血,樣本獲取簡單,診斷時間短,不增加患者時間及經濟成本,可行性高。值得注意的是,體外血液樣本中的淋巴細胞活性快速減弱,因此取血后應盡快測定IGRA 及IL-6。
綜上所述,IGRA、IL-6 對活動性肺結核具有較高的診斷價值,且兩者聯合的敏感性、特異性更高,可用于臨床中活動性肺結核的輔助診斷。

