一氧化碳高分子遞送載體研究進展
張名揚, 程 健, 胡進明
(中國科學技術大學高分子科學與工程系,中科院軟物質化學重點實驗室,合肥 230026)
自從諾貝爾獎獲得者將一氧化氮(NO)作為心血管系統中重要的生物信號分子以來[1,2],人們對內源性氣體小分子(如一氧化碳(CO)[3]和硫化氫(H2S)[4])的潛在治療作用給予了極大關注。CO 是一種無色無味的氣體,通常由含碳化合物(如木材、煙草、煤、焦炭等)的不充分氧化而產生。過去,CO 通常被認為是一種有毒氣體,極易與血紅蛋白結合形成碳氧血紅蛋白(COHb),它與血紅蛋白的親合力比氧氣(O2)高200~300 倍[3]。人體如果吸入高濃度的CO,體內COHb 濃度會急劇上升。當COHb 占據總血紅蛋白的50%~60%時,就會使血紅蛋白喪失攜氧能力,從而出現呼吸抑制、昏迷抽搐和神經系統受損等癥狀,尤其是對大腦皮質具有較強毒性[5];當COHb 在總血紅蛋白中超過70%時,可能導致呼吸衰竭或死亡。雖然高濃度CO 對人體有害已經廣為人知;但是有趣的是,大量研究表明低濃度CO(10~500 mg/L)對正常細胞的功能可產生重要調節作用。如CO 是心血管、免疫和神經系統的信號分子[6],能調控一系列生理反應,包括腸道蠕動、血管平滑肌舒張、血小板聚集、細胞增殖與凋亡等[7,8]。在生物體內,CO 的產生途徑主要包括血紅素(Heme)的降解以及有機分子的氧化,如微粒脂質體的過氧化和有機化合物的光電氧化等[9]。Heme 是氧轉運蛋白(血紅蛋白、肌紅蛋白)和關鍵細胞過程(如呼吸、炎癥和藥物代謝)中酶的重要輔因子[10,11]。CO 是血紅素氧化酶(HOs)催化血紅素分解代謝的副產物之一(圖1(a))。在HOs 催化下,血紅素的卟啉環(鐵原卟啉IX)在煙酰胺腺嘌呤二核苷酸磷酸(NADPH)和O2共存下被氧化,生成膽綠素(Biliverdin)、Fe2+和CO,膽綠素在膽綠素還原酶催化下進一步生成膽紅素(Bilirubin)[12,13]。
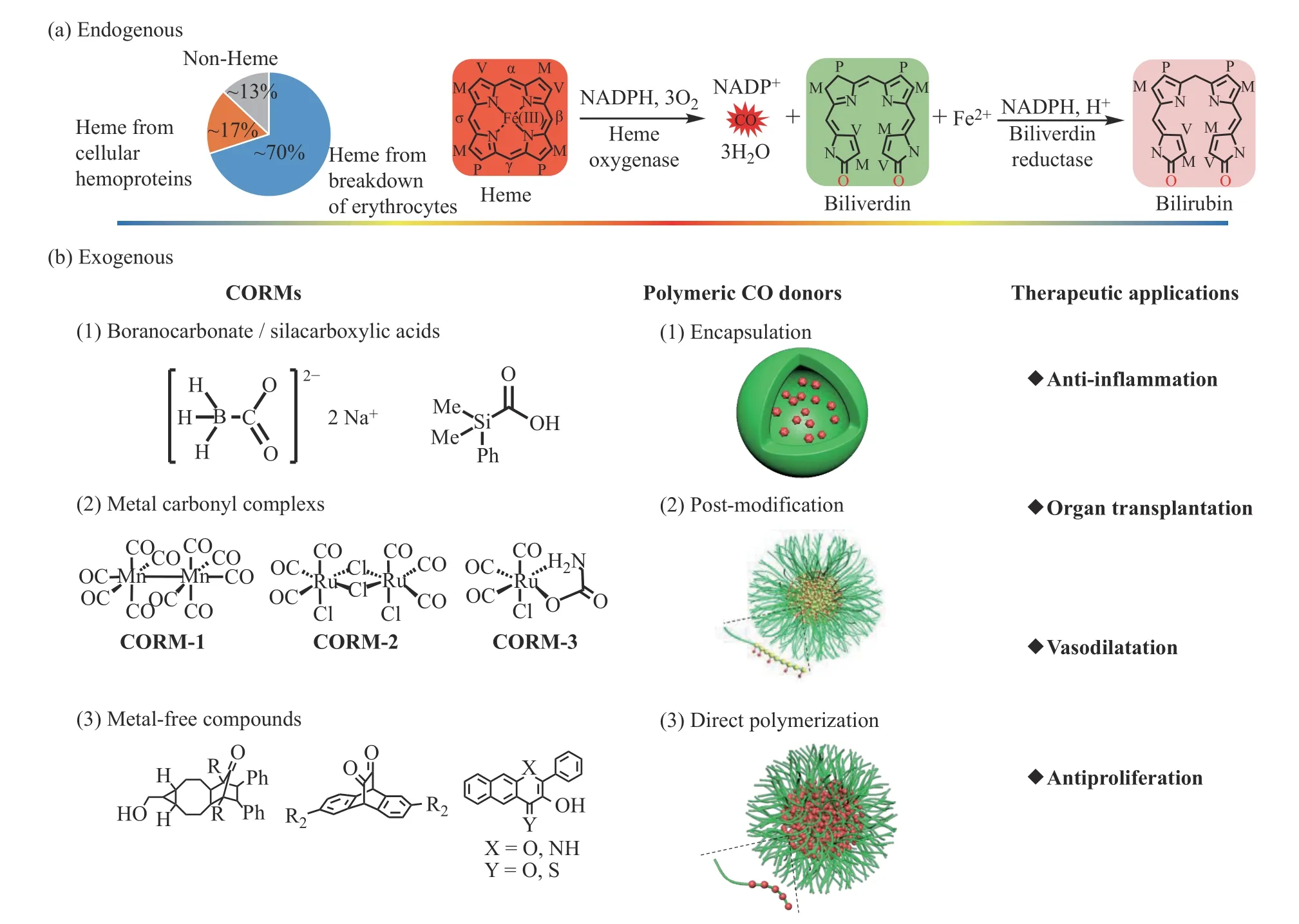
圖1 (a)內源性CO 的主要來源和血紅素氧化降解產生CO 的過程[12, 13];(b)幾種重要的外源性CO 釋放分子、大分子CO 遞送載體及CO 主要生理應用Fig.1 (a)The main sources of endogenous CO and the production of endogenous CO by heme breakdown[12, 13];(b)Typical CO-releasing molecuels(CORMs) and the fabrication of polymeric CO donors for biomedical applications
為了解決CO 在高濃度下毒性和直接使用氣體不便操作等問題,研究人員發展了多種CO 釋放分子(COreleasing molecules, CORMs)。傳統的CORMs 包括無機鹽類、過渡金屬羰基配合物類和非金屬化合物類等,這些分子可用作外源性CO 供體。然而傳統的CORMs 主要為小分子,存在半衰期短、釋放行為不可控、生物利用度低等局限性。針對上述問題,借助于高分子納米材料,通過將CORMs 基元物理負載到高分子組裝體或者化學鍵合CORMs 到高分子鏈中,研究人員成功制備了多種CO 釋放大分子。這些CO 釋放大分子能夠顯著提高CORMs 前體基元的穩定性,延長釋放時間;更為重要的是,借助于大分子自組裝形成超分子組裝體,CO 釋放大分子能夠通過增強滲透和保留效應(EPR)提高在病理組織部位的富集[14]。
本文根據CORMs 與高分子基體的結合方式將CO 釋放高分子主要分為3 類,即物理負載型高分子CO 遞送載體、高分子后修飾型CO 遞送載體和直接聚合型CO 遞送載體(圖1(b)),通過選擇性的實例討論了不同CO遞送載體的構筑方法,并對不同載體的優勢與不足進行了簡要分析,同時對這一領域的發展方向進行了展望。
1 CO 的治療作用
近年來,低濃度的CO 作為一種具有多功能的治療試劑受到了越來越多的關注,在用于炎性疾病[15](圖2(a))、器官移植[16](圖2(b))、心血管疾病[17](圖2(c))和抑制腫瘤生長[18](圖2(d))等方面均表現出顯著療效[19-22]。

圖2 CO 在(a)抗炎[15]、(b)器官移植[16]、(c)血管舒張[17]和(d)抑制腫瘤細胞增殖[18]等方面具有顯著療效Fig.2 Therapeutic applications of CO in (a)anti-inflammation[15], (b)organ transplantation[16], (c)vasodilation[17], and (d)antiproliferation[18]
在腫瘤治療方面,與化學療法、放射療法(RT)、光動力療法(PDT)、光熱療法(PTT)、超聲療法(US)等療法類似,氣體療法成為了一種應用于腫瘤診斷和治療的新興方法。通過嚴格控制氣體濃度,可以利用CO[23]、H2S[24,25]、H2[26-28]和NO[29-33]等氣體殺死腫瘤細胞,從而達到治療目的。在合適的濃度下,這些氣體可以逆轉癌細胞的Warburg 效應從而抑制腫瘤生長,且對正常細胞不會產生不利影響[34,35]。更為重要的是,氣體分子能擴散到腫瘤間質中并無需借助主動轉運機制就能穿過生物膜。氣體療法目前已成為一種“綠色”的癌癥治療方式。盡管研究人員在CO 癌癥治療和抗炎癥方面已經開展了一系列研究,獲得了驚人進展,但目前并未有系統的機理闡明CO 在各種疾病治療過程中的具體作用分子靶標和特定信號通路。受此限制,CO在癌癥治療中的潛在應用前景仍存在爭議。
CO 進入人體的最簡單給藥途徑是吸入CO/空氣混合物,已經有一些臨床試驗用來評估吸入CO 對幾種疾病的安全性和有效性[35-37]。美國食品和藥物管理局(FDA)將14%(質量分數)的血清COHb 設置為臨床試驗的上限,并且一些臨床試驗證實了低劑量吸入CO(250 mg/L,3 h/d)的安全性[38,39]。但這種給藥策略缺乏特異性,由于CO 在水中的溶解性較低,與血紅蛋白較強的親和力限制了全身性給藥,CO 在體內的分布取決于在身體各個部分的固定分配系數[40]。要獲得明顯的治療效果,CO 的濃度、擴散率、組織分布以及在腫瘤組織中的保留率等均至關重要,同時患者的呼吸功能和血紅蛋白水平也將在很大程度上干擾CO 吸入的治療效果。此外,吸入大量的CO 也存在一定的安全風險,血液中CO 濃度過高會引起全身毒性,這些因素嚴重制約了直接吸入CO 的臨床應用。理想的臨床治療劑需要滿足無毒易救護、能釋放低劑量CO、具有高度生物相容性,能夠實現在預定位置和時間以可控方式釋放CO[41]。
2 CORMs
Motterlini 等[42]在2002 年首次報道了過渡金屬羰基配合物,并且引入了CO 釋放分子的概念。CORMs作為一種前藥安全可控地釋放CO,已被廣泛用于模擬和評價CO 的治療效果。迄今已發現有多種化合物可用作CORMs,包括有機金屬化合物醛、草酸鹽和硅羧酸鹽等[23]。使用最廣泛的CO 釋放分子是含過渡金屬的[RuCl2(CO)3]2(CORM-2)[42]、[Ru(CO)3Cl(glycinate)](CORM-3)[43]、Mn(CO)4{S2CNMe(CH2CO2H)}(CORM-401)[44](圖3)和硼碳酸鹽衍生物Na2(H3BCO2)[45](圖(1))等,這些CORMs 的引用極大地促進了CO相關的生理、病理和藥理作用研究[46-48]。傳統的CORMs 在生理條件下能夠自發釋放CO,為了實現CO 釋放行為的可控,近年來研究人員還發展了響應型CORMs。根據觸發途徑差異,已經發展的響應型CORMs 包括光敏感CO 釋放分子(photo-CORMs)[49-53]、化學反應型CO 釋放分子(CT-CORMs)[54]、酶敏感型CO 釋放分子(ET-CORMs)[55]以及溫敏型[56]、氧化敏感型[57]和pH[58]敏感型CO 釋放分子等。

圖3 幾類重要的CORMs 化學結構式[42-45, 51-53]Fig.3 Chemical structures of typical CORMs[42-45, 51-53]
3 CO 高分子遞送載體
雖然CORMs 的發展為研究CO 的生理功能提供了良好的契機,但在實際應用中仍需解決許多問題。如大多數基于過渡金屬配合物的CORMs 穩定性不足、半衰期短,存在提前釋放和血液中被快速清除等問題[59],而非金屬型CORMs 雖然穩定性有極大提升,卻存在水溶性差、給藥濃度不能滿足靶組織中的最小有效濃度(MVC)等問題[47,48]。解決上述問題的一個可行辦法是將現有的CORMs 與納米載體有機結合,發展CO 遞送納米載體。納米載體的形成能夠有效提高CORMs 在生理環境下的穩定性、避免被腎臟快速清除、能夠通過EPR 效應實現病理組織的富集等[60,61]。目前,聚合物納米粒子[62](圖4(a))、無機納米粒子[56](圖4(b))、蛋白質[63](圖4(c))、金屬有機框架[64](圖4(d))和納米凝膠等已經被成功用于構筑CO 遞送納米載體。本文重點關注高分子CO 遞送載體,根據CORMs 與高分子基體的結合方式將CO 釋放高分子分為3 類。通過部分代表性實例,下文將對不同的構筑方法進行簡要評述,并對相關領域的發展趨勢進行了展望。
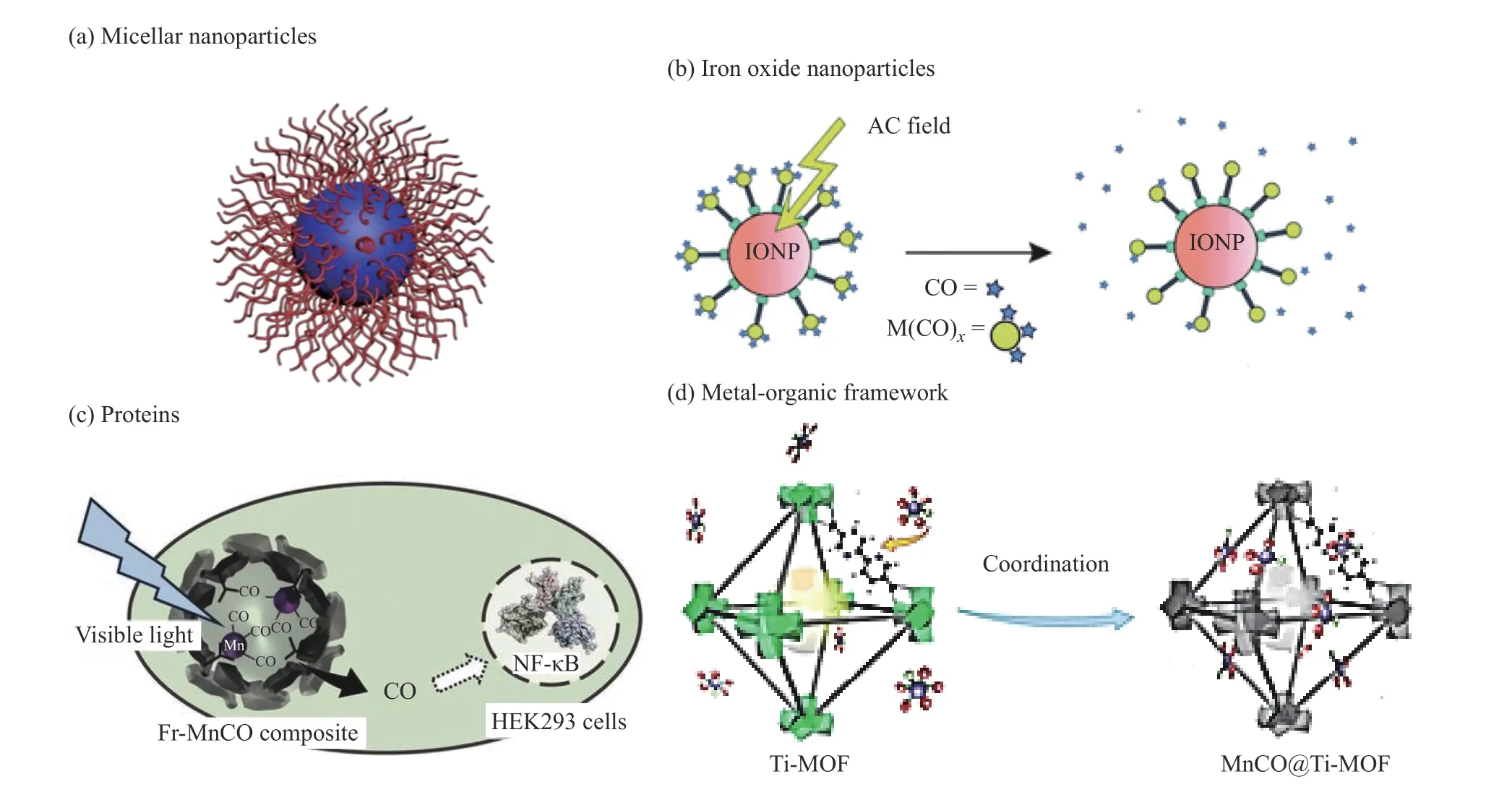
圖4 典型的CO 釋放納米載體:(a)膠束納米粒子[62],(b)氧化鐵納米顆粒[56],(c)蛋白質[63],(d)金屬有機框架[64]Fig.4 Fabrication of nanovectors for CO delivery:(a)Micellar nanoparticles[62], (b)Iron oxide nanoparticles[56], (c)Proteins[63], and(d)Metal-organic framework[64]
3.1 物理負載型高分子CO 遞送載體
使用高分子載體可以通過提高CO 釋放小分子的功效和靶向效率來增加CORMs 的生物利用度。基于生物相容的聚合物,依賴于CORMs 和聚合物基體之間的非共價相互作用,可以以非共價鍵形式將CORMs 負載到聚合物載體中,而不對CORMs 的完整性(尤其是金屬配合物的幾何結構、氧化態和立體化學結構)造成影響,并能減輕CO 釋放后金屬碎片帶來的不利影響。這種給藥系統使多作用和多靶點給藥成為可能,或使治療和診斷工具相結合成為可能。當設計聚合物作為CORMs 高效載體時,必須考慮聚合物的幾個特性,包括尺寸、電荷、結構和降解動力學[59]。
聚合物膠束(PM)系統作為一種常用的高分子載體,近年來由于其增溶、選擇性靶向以及亞細胞定位特性而受到越來越多關注[65-68]。膠束是由組裝形成的一種納米膠體顆粒,通常在水性介質中由兩親性嵌段共聚物獲得,膠束的大小和形態可以通過聚合物的分子量、嵌段長度、組成和制備方法來調節,聚合物膠束具有獨特的性能,如藥物負載量高、配制容易、毒性低等。使用膠束封裝CORMs 是一種有效的策略,可在降低細胞毒性的同時將CO 穩定運轉到活細胞中。Yin 等[69]將疏水性CORM-2 負載到苯乙烯-馬來酸共聚物(SMA/CORM-2)膠束中(圖5(a))。該膠束流體動力學直徑約160 nm,能夠分散在水溶液中并緩慢地持續釋放CO,經尾靜脈注射后在小鼠血液中的半衰期比CORM-2 小分子的長約35 倍;動物實驗結果表明該CO 釋放膠束對硫酸葡聚糖鈉鹽(DSS)誘發的炎癥性結腸炎和其他活性氧(ROS)相關的疾病(包括炎性腸病)具有一定治療效果。除物理負載自發釋放型CORMs 外,響應型CORMs 也能夠被負載到高分子納米載體中實現可控釋放。Peng 等[70]使用聚環氧乙烷和聚環氧丙烷的嵌段共聚物(Pluronic F127)負載水敏感的環狀α-二酮(DKs),該膠束能夠顯著提高DKs 的穩定性并在470 nm 可見光輻照下釋放CO,定量計算結果表明負載的DKs 釋放CO 效率達84%(圖5(b))。為了避免紫外光和可見光在生理環境下使用時穿透深度不足的問題,Pierri 等[71]將 銩(Tm)和 鐿(Yb)摻 雜 的NaGdF4上 轉 換 納 米 粒 子(upconversion nanoparticles, UCNPs)和[Mn(bpy)(CO)2(PPh3)2]+配合物同時負載到兩親性聚合物膠束中(圖5(c)),實現了近紅外光(NIR)誘導的CO 釋放。這種膠束體系具有水分散性,并且提供了一個適合裝載疏水性photo-CORMs 的微區。在膠束內核中,CORMs 與UCNPs 之間距離非常近,有利于能量轉移,從而能夠實現980 nm 近紅外光觸發CO 釋放。

圖5 通過將CORMs 物理包埋到高分子載體中構筑CO 釋放高分子:(a)負載CORM-2 的SMA 膠束載體[69];(b)負載DKs 的Pluronic F127 膠束[70];(c)將CORMs 和UCNPs 負載到膠束中,通過上轉換實現近紅外觸發釋放CO[71]Fig.5 Fabrication of macromolecular CO donors by physical encapsulation of CORMs into polymeric assemblies:(a)CORM-2-loaded SMA micelle[69]; (b)DKs-loaded micelle assembled from Pluronic F127[70], and (c)CORMs- and UCNPs-coloaded micelle for NIR-triggered CO release[71]
3.2 高分子后修飾型CO 遞送載體
通過物理負載CORMs 構筑高分子CO 遞送載體雖然實施相對簡單,能夠最大程度地保留CORMs 本身的性質,然而這些物理負載CORMs 的載體通過靜脈注射給藥后容易由于血液稀釋和血流剪切而發生解離,導致CO 提前釋放。為了提高高分子CO 遞送載體的穩定性,可將CORMs 共價修飾到高分子基體中,將小分子CORMs 轉化為大分子聚前藥,這一策略極大地避免了膠束解離過程中CORMs 的暴釋。
高分子基體與CORMs 共價結合構筑高分子CO 遞送載體首先報道于2010 年,Hasegawa 等[36]合成了聚乙二醇-b-聚鳥氨酸丙烯酰胺-b-聚正丁基丙烯酰胺(PEG-b-POrnRu-b-PnBu)三嵌段共聚物,并引入CORM-2 基元對其進行修飾(圖6(a))。這種CORM-2 修飾的三嵌段聚合物能夠自組裝為直徑30~40 nm 的膠束,該膠束在水溶液中分散性良好。研究表明,將疏水性CORM-2 共價修飾到聚合物基體中不僅能夠顯著提高聚合物的水分散性,而且能夠延長CO 釋放時間,使共聚物具有明顯的抗炎作用。Nguyen 等[72]制備了聚乙二醇甲基醚丙烯酸酯-b-聚乙烯基芐氯(POEGA-b-PVB)嵌段共聚物,通過與含有巰基的CORMs 進行反應制備了含不同取代基團(R)的POEGA-b-P(VB-R-CORM-2)水溶性兩嵌段共聚物(圖6(b))。有趣的是,CO 釋放的半衰期可以通過調整取代基團實現。相對于前體分子,這些高分子CO 釋放載體普遍具有延長的釋放時間,并在抑制細菌生長和生物膜形成方面具有潛在應用價值。此外,他們還將CORM-2 修飾到聚乙二醇甲基醚丙烯酸酯-b-聚4-乙烯基吡啶(POEGA-b-P4VP)嵌段共聚物上并通過自組裝制備了POEGA-b-P(4VP-CORM-2)膠束[73](圖6(c)),該膠束具有良好的水溶性,并且可以在水溶液中緩慢釋放CO。
Bruckmann 等[62]通過將三羰基錳(Mn(CO)3)后修飾到聚(2-羥丙基甲基丙烯酰胺)(PHPMA)上制備了Mn(CO)3-PHPMA。肌紅蛋白測定表明,該聚合物的CO 釋放量與Mn(CO)3小分子的相近。相對于Mn(CO)3小分子,Mn(CO)3-PHPMA 可將CO 被動遞送至腫瘤組織或炎癥部位并在光照下實現CO 可控釋放。Zhou 等[74]利用主客體相互作用得到了對空氣穩定的環糊精穩定的環戊二烯二羰基鐵功能化的聚苯乙烯衍生物(P(CD/FpMSt)),該聚合物在固體和溶液中相對穩定,在光照條件下能夠釋放CO,為發展含空氣敏感金屬配合物的CO 釋放高分子提供了思路。必須指出,將CORMs 共價修飾到聚合物基體中雖然能夠提高負載效率和穩定性,但是這種策略需要考慮如下問題:首先,CO 供體與高分子基體之間的共價結合會改變CORMs 的化學結構從而影響其CO 釋放行為;其次,高分子基體和CORMs 之間的共價鍵需要在遞送過程中保持穩定,在到達病理組織時能夠自發釋放或者在適當外部刺激下釋放CO[59]。

圖6 高分子后修飾制備CO 釋放高分子:(a)基于PEG-b-POrnRu-b-PnBu 三嵌段聚合物的CO 釋放高分子用于抗炎癥治療[36];(b)POEGA-b-P(VB-R-CORM-2)嵌段共聚物用于抗菌[72];(c)POEGA-b-P(4VP-CORM-2)嵌段共聚物的自組裝[73]Fig.6 Fabrication of CO-releasing macromolecules through a post-modification procedure:(a)Construction of CO-releasing micelle selfassembled from PEG-b-POrnRu-b-PnBu triblock copolymer and intracellular CO release[36]; (b)CO-releasing POEGA-b-P(VB-RCORM-2) block copolymer for bacterial killing[72]; (c)Self-assembly of CO-releasing POEGA-b-P(4VP-CORM-2) diblock copolymer[73]
3.3 直接聚合型CO 遞送載體
值得注意的是,在高分子載體中物理負載CORMs 的方法雖然不需要對CORMs 進一步改性,但高分子載體的選擇至關重要,而且物理負載的方法通常存在負載效率低和和穩定性不足等局限性[59]。后修飾法能夠有效提高負載效率和穩定性,但由于高分子鏈和反應基團之間的空間位阻效應,通常難以實現官能團完全改性[75]。針對上述問題,近期研究人員通過將CORMs 直接功能化為可以聚合的單體,并通過CORMs 單體的直接聚合成功制備了結構規整的CO 釋放高分子[76-78]。如Gandra 等[79]通過開環易位聚合(ROMP)合成了光響應型CO 釋放高分子(圖7(a~c))。該單體和聚合物在黑暗條件下均為相對穩定的狀態,但一定強度的光照(550 nm,≤28 mW)可以有效觸發CO 釋放,并且在CO 釋放過程中產生熒光和顏色變化的雙重響應。他們進一步制備了含CO 釋放高分子的聚四氟乙烯的可拉伸材料(P-PTFE),可被用作簡單、廉價和便攜的CO 儲存繃帶。Shao 等[80]近期設計了一種含二苯基環丙烯酮(DPCP)衍生物的原子轉移自由基聚合(ATRP)引發劑,通過ATRP 聚合丙烯酸甲酯單體制備了中間連接點為DPCP 衍生物的聚丙烯酸甲酯(DPCP-PMA)(圖7(d))。DPCP-PMA 可以在紫外輻射下觸發CO 釋放,該釋放過程可以通過光致發光進行跟蹤。

圖7 通過直接聚合制備CO 釋放高分子:(a)通過ROMP 合成光響應型CO 釋放材料;(b)光響應型CO 釋放高分子單體的化學結構;(c)P-PTFE 條帶在綠光輻照下的顏色變化(ⅰ, ⅱ, ⅲ分別代表純PTFE 條帶,P-PTFE 輻照前和輻照后的條帶);(d)ATRP 制備含CO 釋放基元的DPCP-PMA[79, 80]Fig.7 Fabrication of CO-releasing polymers through direct polymerization: (a) Fabrication of photoresponsive CO-releasing polymers via ROMP; (b) Chemical structure of photoresponsive CO-releasing monomer; (c) Macroscopic images of (i) PTFE strip only, (ii)P-PTFE before irradiation and (iii) after irradiation; (d) Synthesis of CO-releasing DPCP-PMA through ATRP using DPCP-based initiator[79, 80]
4 結論與展望
CO 是生命活動中重要的信號分子,對心血管疾病、炎癥、腫瘤、細菌感染和器官移植均產生重要影響,利用CO 實現相關疾病的治療近年來受到了廣泛關注。為了避免高濃度CO 產生的系統毒性,實現CO 的靶向遞送和可控釋放是該領域面臨的重要挑戰,本文總結了大分子CO 遞送載體的近期研究進展。通過物理包埋或者化學鍵合的途徑,研究人員已經成功制備了多種CO 釋放大分子,并初步探索了他們在腫瘤治療、生物膜分散和抗炎癥等方面的潛在應用價值。相對于小分子前體,大分子CO 遞送載體表現出更高的穩定性、更長的釋放時間、增強的病理組織靶向性和較低的系統毒性。
值得注意的是,雖然CO 釋放大分子取得了快速發展,不難看出大多數的CO 釋放大分子均是通過物理包埋或者高分子后修飾的策略進行制備的,而通過直接聚合的制備途徑極少被報道。可能的原因是傳統的CORMs 進一步單體化非常困難或者在進一步改性和聚合條件下穩定性不足。因此,這一領域的進一步發展極大程度上依賴于創新型CORMs 的研發。首先,大多數傳統CORMs 均為過渡貴金屬配合物,這些配合物易于發生配體交換而發生CO 泄露,且重金屬離子的生理毒性也需要進一步探討。令人欣喜的是,近期研究人員已經成功研發了幾例非金屬型CORMs。其次,目前大多數觸發CO 釋放的供體分子僅對光照等外源性刺激信號響應,能夠對生物內源性信號響應的供體分子仍然非常有限。最后,CO 釋放原位檢測的手段嚴重缺乏,而釋放過程的原位跟蹤將有利于深入理解其生理功能,發展能夠原位報告CO 釋放的供體分子將是這一領域的另一方向。毋庸置疑,新型CORMs 的發展將極大地促進高分子CO 遞送載體這一新興領域的快速發展,我們期待在不久的將來高分子CO 遞送載體能夠實際應用于臨床相關疾病的治療。

