無托槽隱形矯治器對口腔微環境影響的相關性研究
李 佩,陳 曦,林 彤,郭 莉
隨著物質生活水平的提高,人們對口腔健康的關注及美學訴求也越來越高[1-2]。近年來,隱形無托槽矯治器以其美觀、舒適、可摘戴等優點,受到廣大正畸醫師及患者的青睞[3-4]。
但是佩戴隱形矯治器可能對口腔環境產生影響。眾所周知,口腔的自潔作用是一種重要的保護機制,這與唾液的理化性質密切相關。研究表明,唾液腺功能障礙者,口腔黏膜疾病、牙周炎癥及齲壞的發生率顯著增高[5]。而隱形矯正器包裹整個牙面的特點限制了唾液的沖洗作用,使局部唾液流速降低、粘度增大,長期佩戴可能會對口腔微環境及菌群產生一定影響[6-7]。
因此,本研究納入符合標準的正畸患者,給予隱形矯治,通過待測指標的變化,客觀地分析隱形矯治器對口腔微環境的影響,為該技術的臨床應用提供理論參考。
1 資料與方法
1.1 一般資料
選擇2017年10月至2018年10月于西安市第九醫院口腔科就診的10例正畸患者為研究對象,納入標準:①牙齒健康,無活性齲、氟斑牙或四環素牙等;②口腔衛生良好,無明顯偏側咀嚼習慣,依從性高,可按時復診;排除標準:①未治愈的各類口腔黏膜病、牙周病、口腔腫瘤等患者;②存在齲病易感因素,包括影響口腔功能的系統性疾病,如舍格倫綜合征、糖尿病等及近期接受放化療患者等。研究方案通過西安市第九醫院倫理委員會審批,患者簽署知情同意書,實驗開始前由專業醫務人員進行口腔衛生健康宣教。
1.2 研究方法
受試者采用無托槽隱形矯治技術,拍攝口腔全景片和頭顱側位片,取硅橡膠印模,設計方案并制作隱形矯治器(上海正雅齒科科技股份有限公司生產),囑患者每日佩戴時間≥20 h,每2周更換1次,佩戴期間保持口腔衛生。于治療前(T0)、治療后4月(T1)、治療后8月(T2)記錄患者的PLI和GI,并采集唾液標本送檢。
1.3 評價方法
1.3.1 臨床指標的測量 待測牙位參考Ramfjord指數牙[8]即16、21、24、36、41、44。PLI的測量采用改良的Q-H菌斑指數,每顆牙檢查唇(頰)舌面,用菌斑指示劑染色,停留3 min后漱口,根據牙面染色部位的分布范圍記分。GI的測量采用Loe和Silness的診斷標準,每顆牙檢查唇(頰)面的近中乳頭、正中齦緣、遠中乳頭及舌側齦緣。由同一醫師完成全部臨床指標的測量與記錄。牙齒的得分為該牙各個位點記分的平均值,個人記分為全部待測牙位記分的平均值。計分標準如下。
菌斑指數(PLI):0=牙面無菌斑;1=牙頸部齦緣處有散在的點狀菌斑;2=牙頸部連續窄帶狀菌斑寬度不超過1 mm;3=牙頸部連續窄帶狀菌斑寬度超過1 mm,但少于牙面1/3;4=菌斑覆蓋面積至少占牙面1/3~2/3;5=菌斑覆蓋面積占牙面2/3或以上。
牙齦指數(GI):0=牙齦健康;1=牙齦輕度炎癥,顏色有輕度改變并輕度水腫,探診不出血;2=牙齦中等炎癥,色紅,水腫光亮,探診出血;3=牙齦嚴重炎癥,明顯紅腫或有潰瘍,并有自動出血傾向。
1.3.2 16S rDNA基因測序 唾液的采集:在晨起未進食或飯后3~4 h收集唾液約5 mL,轉入離心管,4 ℃下離心10 min,轉速7 000 r /min,吸取上清液分裝入EP管,-70 ℃保存。樣品總DNA提取:按照試劑盒說明書(江蘇凱基生物技術有限公司提供)提取樣品總DNA,-20 ℃保存。
細菌16S rDNA基因擴增:選擇16S rRNA基因V4區域的通用引物序列(武漢承啟醫學科技有限公司合成),引物上游:V4F-5′-GAGTGCCAGCMGCCGCGGTAA-3′,引物下游:V4R-252-5′-TTAGGAGA-CCCGGACTACHVGGGTWTCTAAT-3′。PCR反應體系25 μL:10×Buffer緩沖液5 μL,2.5 mmol/L dNTP (含4種脫氧核苷酸)2.0 μL,TaqDNA聚合酶0.2 μL(5 U/μL),引物各12.5 pmol/μL,細菌DNA提取液1 μL,三蒸水17.7 μL。PCR反應條件:95 ℃預變性5 min;95 ℃變性30 s;60 ℃退火30 s;72 ℃延伸30 s,35個循環;72 ℃延伸10 min;4 ℃保存。
Illumina Solexa測序:樣品上機測序之前進行凝膠電泳檢測,Illumina Hi Seq平臺進行測序。
1.4 數據處理和統計學分析
為了研究菌群多樣性,對所有樣品的Effective Tags進行聚類[9],利用Green Gene數據庫進行物種注釋,在門綱目科屬等水平上統計各個物種的相對豐度。用Qiime1.9.1軟件對樣品Alpha多樣性指數進行計算并繪制相應的曲線。
采用SPSS 20.0進行統計學分析,不同觀察時間點PLI和GI的組內比較采用方差分析,不同水平菌群構成比的組內比較采用卡方檢驗,當P<0.05時差別有統計學意義。
2 結 果
2.1 治療前后PLI和GI的變化
與治療前相比,治療后受試者的PLI和GI呈上升趨勢,但差別無統計學意義(P>0.05),見表1。
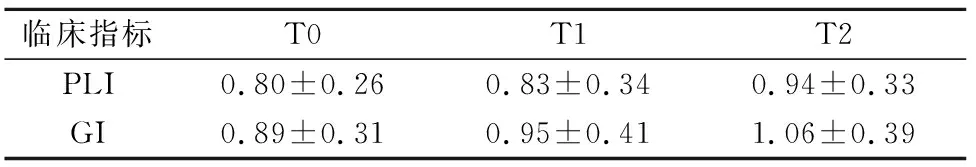
表1 患者治療前后臨床指標的比較Tab.1 Comparison of clinical index before and after treatment 分
2.2 治療前后16S rDNA測序結果分析
2.2.1 數據處理和質量控制 30個樣本共獲得980 795條原始基因序列,進行篩選優化后共獲得933 470條有效序列,以此為基礎進行后續分析。
2.2.2 Alpha多樣性分析 Alpha多樣性用于分析樣品內的群落多樣性,常用Shannon和Simpson指數表示,指數值越大,說明樣品中微生物群落多樣性越高;反之,越低。實驗結果顯示,隨著治療時間的延長,受試者口腔菌群的多樣性增高,見圖1。
2.2.3 門水平口腔菌群相對豐度的分布情況 本實驗通過基因測序共測得16個菌門,其中,相對豐度最高的5種菌門依次為:變形菌門(Proteobacteria)、厚壁菌門(Firmicutes)、擬桿菌門(Bacteroides)、放線菌門(Actinobacillus)和梭桿菌門(Fusobacterium)。
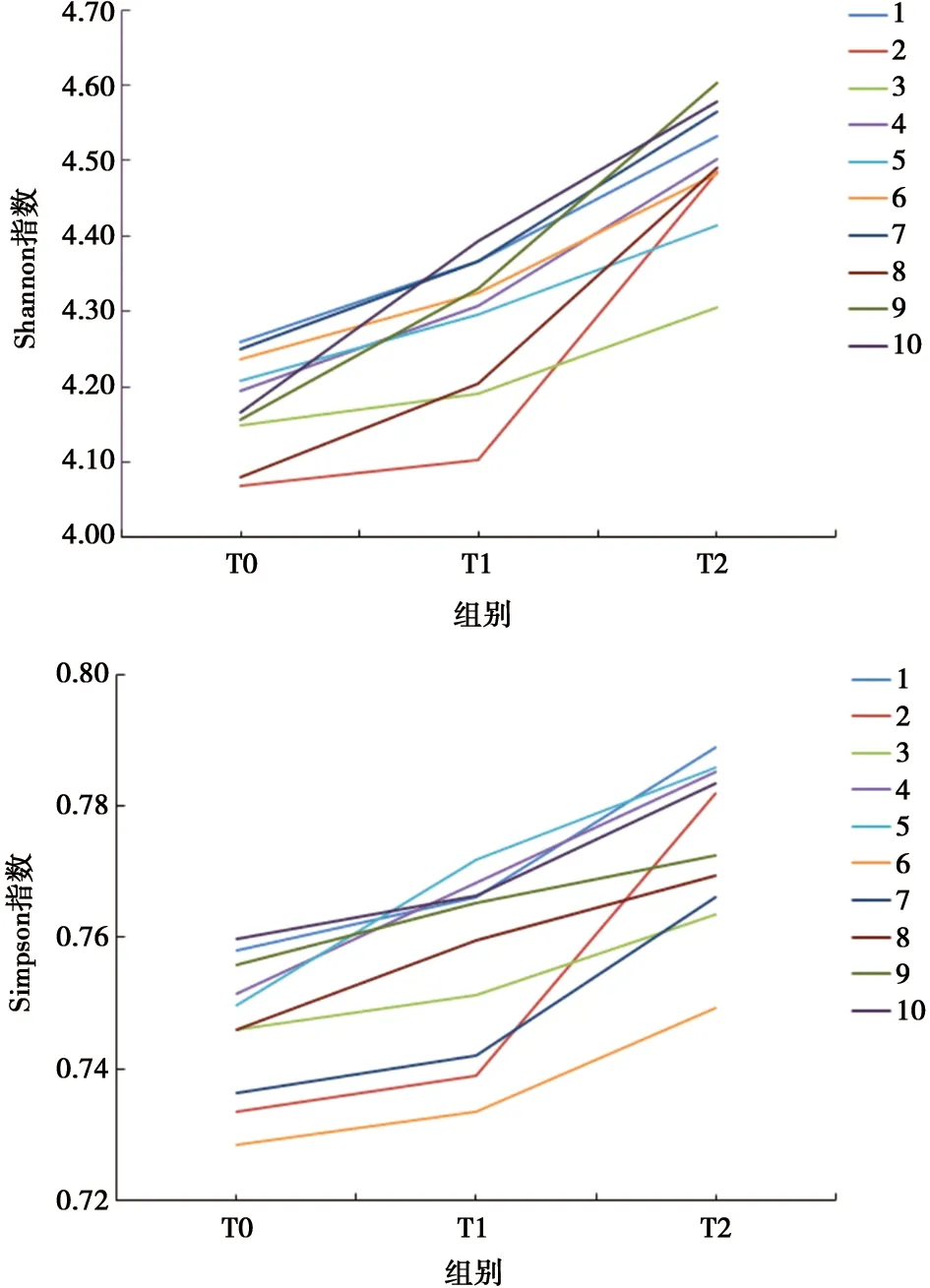
圖1 Shannon和Simpson指數
在治療前后其構成比有所改變,其中變形菌門含量呈下降趨勢,但差別無統計學意義(P>0.05);放線菌門和梭桿菌門含量呈上升趨勢,差別無統計學意義(P>0.05),見圖2。
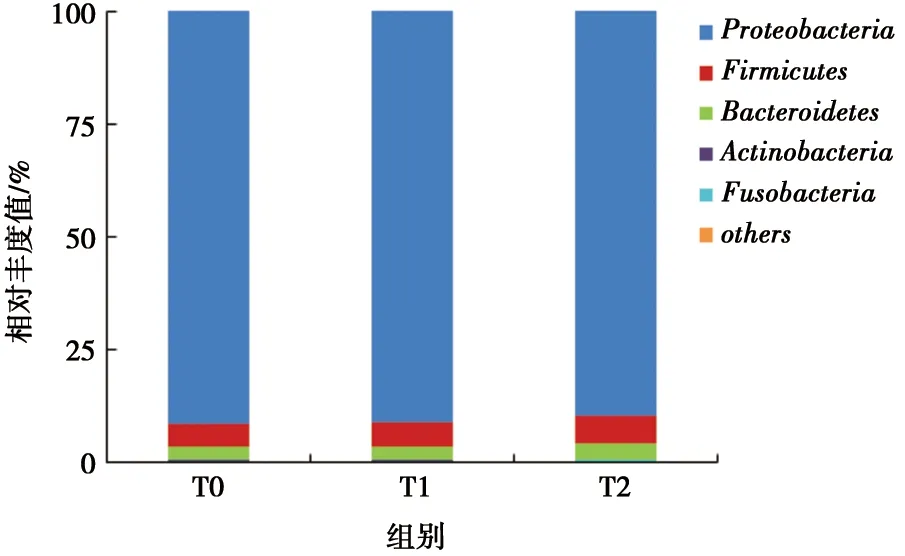
圖2 門水平相對豐度柱形圖
2.2.4 屬水平口腔菌群相對豐度的分布情況 本實驗通過基因測序共測得281個菌屬,相對豐度最高的前6種菌屬依次為:埃希氏菌屬(Escherichia)、假單胞菌屬(Pseudomonas)、擬桿菌屬(Bacteroides)、薩特氏菌屬(Sutterella)、 嗜血桿菌屬(Haemophilus)和奈瑟菌屬(Neisseria)。在治療前后其構成比發生變化,但差別無統計學意義(P>0.05)(奈瑟菌屬除外),見圖3。此外,我們分析了齲病和牙周病的優勢致病菌,包括鏈球菌屬(Streptococcus)、乳桿菌屬(Lactobacillus)、卟啉單胞菌屬(Porphyromonas)、放線菌屬(Actinobacillus)和奈瑟菌屬(Neisseria)的相對豐度變化,結果顯示:隨著治療時間的延長,其含量均呈增加趨勢。其中,鏈球菌屬、放線菌屬和奈瑟菌屬在T2的含量顯著高于T0,差別有統計學意義(P<0.05),見表2。
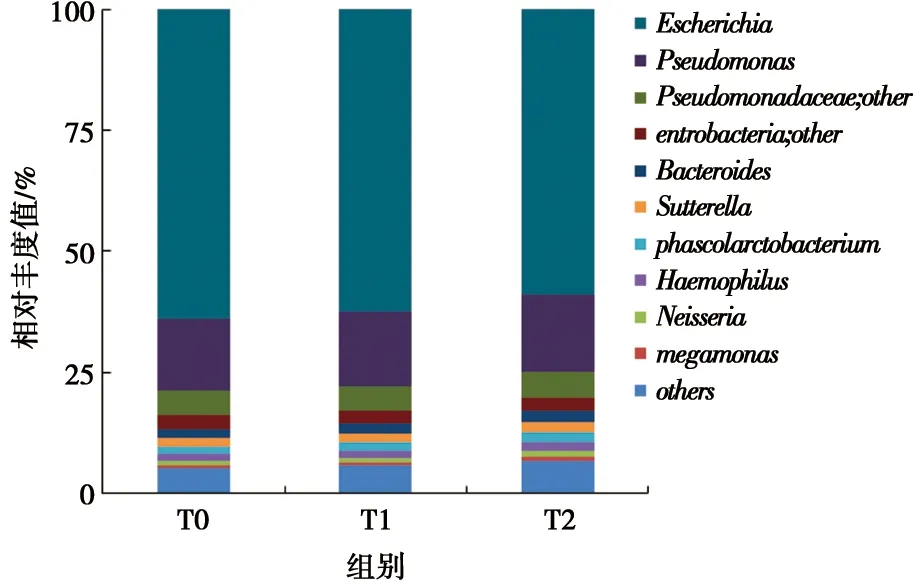
圖3 屬水平相對豐度柱形圖
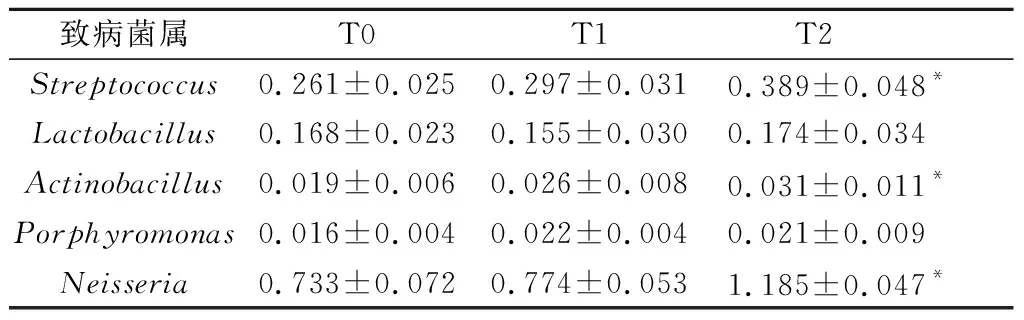
表2 相關致病菌屬含量變化Tab.2 Relative abundance change of pathogenic bacteria
3 討 論
近年來,很多學者進行了隱形矯治器與傳統托槽矯治器對口腔健康影響的比較研究,一致認為隱形矯治器在減少齲病和牙齦炎等正畸并發癥方面有顯著優勢[10-11]。壓膜保持器的佩戴可促進齲病及牙齦炎的發生發展[12]。Low等發現佩戴隱形矯治器6 h后其邊緣及表面凹陷處可觀察到菌斑的積聚[13]。此外,有研究指出,隨著矯治器佩戴時間的增加,其理化性能衰減,出現明顯的磨損及粗糙度增加,這為口腔細菌附著創造了條件,即使在清潔之后仍可見菌斑生物膜[14]。為了進一步證實隱形矯治器的佩戴對口腔微壞境的影響,我們進行相關研究。
實驗結果顯示,佩戴隱形矯治器前后受試者的PLI和GI呈上升趨勢,但差別無統計學意義(P>0.05)。這說明,在8個月的觀察期內隱形矯治器的佩戴尚未造成口腔軟硬組織的實質損害。但臨床指標僅描述了組織改變的結果,而唾液菌群結構和功能的變化可作為標記預測齲病和牙周病的發生[15-17]。
16S rDNA基因測序作為一種準確可靠的微生物研究方法,被廣泛應用于口腔細菌的鑒別和分離[18]。Alpha多樣性分析結果顯示,隨著治療時間的延長唾液中菌群多樣性增加。Camelo-Castillo等學者[19]認為菌群多樣性與牙周炎癥呈正相關,這提示我們隱形矯治器對牙周組織健康在某種意義上有一定的影響。
為了研究菌群多樣性的具體構成,我們將待測序列進行聚類和物種注釋,在門水平上測得相對豐度最高的5種菌門:其中變形菌門含量呈下降趨勢,而放線菌門和梭桿菌門含量呈上升趨勢,但差別均無統計學意義(P>0.05),這與前期學者研究結果較為一致[7]。在屬水平,齲病和牙周病相關致病菌即鏈球菌屬、放線菌屬和奈瑟菌屬,在治療后含量顯著增加,T2與T0時期相比差別有統計學意義(P<0.05)。鏈球菌屬在口腔天然菌群中占得比例很大,其不同菌種均與齲病發生有一定關系,齲病流行人群中檢出率更高,是公認的主要致齲菌。放線菌屬作為齦上、齦下菌斑的長居菌,常與根面齲和牙齦炎的發生相關。奈瑟菌屬在菌斑中具有雙向調節作用,因其降解乳酸而可能具有減少菌斑致齲性的能[20-21]。本實驗中致病菌的含量顯著增加,卻未引起臨床損害,可能的原因有兩點:①其含量的增加并未引起菌群生態平衡的破壞,而是在機體代償機制的作用下,達到了新的動態衡;②在治療初期,奈瑟菌屬降解乳酸的作用在一定程度上削弱了鏈球菌屬和放線菌屬的致病性,阻止或減慢了相關疾病的進展。
綜上所述,觀察期間隱形矯治器的佩戴會對口腔微環境產生影響,具體表現在菌群多樣性和相對豐度的改變,但并未引起菌群失調,臨床上也未觀察到口腔軟硬組織的實質性損害。然而,更長時間的佩戴是否會導致其他變化,仍需進一步探究。

