CYP2C9 VKORC1基因多態性指導對非瓣膜性心房顫動患者華法林劑量的影響
馮 俊 高 玉 羅春苗 江永進 周高亮 李 超 侯琳琳 周江榮
非瓣膜性心房顫動(nonvalvular atrial fibrillation,NVAF)是臨床上常見的心律失常之一,與瓣膜性房顫相比,其發病率隨年齡增加而上升,75歲以上人群發病率為10%[1]。NVAF易致血栓形成,常引發致命或致殘卒中發作[2]。研究[3-4]顯示,約15%的缺血性卒中由NVAF引起,其發生卒中的風險是非房顫患者的5倍。長期以來,我國NVAF抗凝治療一直處于較低水平,導致心源性卒中發生率居高不下[5]。雖然新型抗凝藥物發展較快,但綜合考慮性價比等因素,華法林仍是臨床一線抗凝藥物[6]。但華法林治療窗窄,個體服用劑量差異顯著,需反復監測國際標準化比值(international normalized ratio,INR),嚴重影響患者依從性,使臨床凈獲益受限。因此,如何有效且個體化應用華法林劑量一直被臨床所關注。研究[7]認為,與華法林個體劑量代謝差異相關的編碼藥物代謝酶細胞色素氧化酶P4502C9(CYP2C9)和編碼藥物作用位點的維生素K環氧化酶復合物亞單位1(VKORC1)基因是藥代動力學及藥效動力學的影響因素,可解釋10%~45%華法林劑量的個體差異。本研究在基因檢測指導下,探討NVAF患者 CYP2C9、VKORC1 基因多態性對應用華法林時初始劑量、達標時間、穩定劑量等方面的影響,為合理有效應用華法林提供依據。
1 對象與方法
1.1 研究對象 選擇2017年11月至2019年10月合肥市第二人民醫院心內科收治的具有抗凝治療指征的NVAF患者214例,采用隨機數字表法分為基因指導組(69例)與對照組(145例)。所有患者簽署知情同意書,并由醫院倫理委員會審查通過。
1.2 診斷標準 房顫的診斷標準是指持續時間≥30 s且與可逆性病因無關的房顫發作[1]。房顫患者心電圖表現為P波消失,代之以振幅、形態、間距絕對不規則的F波(頻率在每分鐘350~600次) 及絕對不規律的心室激動。NVAF是指符合房顫的診斷標準,經臨床和超聲心動圖排除風濕性心臟瓣膜病者[1]。入組前行CHADS2-VASc及HAS-LED評分,需滿足CHADS2 -VASc評分≥2分。
1.3 排除標準 ①年齡<18歲及>80歲者;②既往有華法林使用史者;③血液系統疾病或凝血功能異常者;④感染者;⑤肝腎功能不全者;⑥甲狀腺功能亢進(促甲狀腺激素< 0.1 mIU/L)者;⑦心功能衰竭(NYHA分級IV級)者;⑧合并腫瘤者;⑨服用影響華法林藥動學或藥效學及類似抗凝的其他藥物者;⑩依從性差或伴有精神異常及不能正確交流者。
1.4 方法
1.4.1 基因檢測方法 取患者外周靜脈抗凝血2 mL,由醫院檢驗中心初步處理后,標本送上海聯吉醫學檢驗所有限公司進行檢測。利用全血基因組提取試劑盒(天根血液基因組提取試劑盒)及Taqman探針(檢測試劑盒購自美國Life Tech)提取患者基因組DNA。CYP2C9、VKORC1基因的SNPs位點基因型檢測使用taqman探針檢測試劑盒進行分型檢測。檢測流程參照試劑盒使用說明進行。聚合酶鏈式反應(polymerase chain reaction,PCR)條件:95℃10 min,(92℃15 s, 60℃1 min)× 60個循環,72℃10 min;PCR完成后,使用7900HT型熒光定量PCR儀進行數據掃描,檢測結果使用SDS 2.3自動分析軟件基因型判讀。本研究中檢測的CYP2C9 SNPs分為*1/*1(*2CC/*3AA)型、*1/*3(*2CC/*3AC)型和*3/*3(*2CC/*3CC)型,其中*1/*1(*2CC/*3AA)型為野生型,*1/*3(*2CC/*3AC)型和*3/*3(*2CC/*3CC)型為突變型;VKORC1 SNPs分為AA 型、GA 型和GG 型,其中AA 型為野生型,GA 型和GG 型為突變型
1.4.2 華法林劑量選擇 基因指導組患者依據CYP2C9和VKORCI 基因型,根據原國家衛計委2015版《藥物代謝酶和藥物作用靶點基因檢測技術指南(試行)》中國人群華法林用藥劑量計算公式,計算華法林預測劑量(華法林規格:每片2.5 mg,國藥準字H31022123,上海信誼九福藥業有限公司)。于第1~3 天以該預測劑量(mg/d)為初始劑量,對照組按第1~3 天以2.5 mg/d 為初始劑量,從第4 天開始,兩組患者均根據INR結果調整劑量。
1.5 觀察指標 收集并記錄兩組患者身高、性別、年齡、體質量等一般資料以及心電圖、心臟功能、生化及血常規等實驗室指標。第1 天服用華法林前檢測兩組患者基線INR值,同時隨訪12周。分別在第1、4、8、14、21、35、56 和84天測INR 值,如果臨床病情需要,可有額外的INR 測量,并記錄日期、時間及INR指標。抗凝治療達標INR 值定為2~3。穩定劑量定義為同一華法林劑量連續3次(≥7 d)INR 在目標范圍內的劑量[1];記錄兩組患者INR 首次達標時間、穩定劑量時間及第14、21天達穩定劑量患者比例(%)。
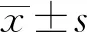
2 結果
2.1 兩組患者一般資料比較 兩組患者性別、年齡等一般資料進行比較,差異無統計學意義(P>0.05)。見表1。
2.2 基因檢測結果 CYP2C9基因,*1/*1(*2CC/*3AA)型64例(*1/*1組),*1/*3(*2CC/*3AC)型5例(*1/*3組),無*3/*3(*2CC/*3CC)型患者。VKORC1 基因,AA型60例(AA組),GA型9例(GA組),無GG 型患者。
2.3 兩組患者華法林初始劑量、穩定劑量及起效時間比較 基因指導組患者華法林應用初始劑量、穩定劑量均低于對照組,起效時間短于對照組,第14、21天達穩定劑量患者比例高于對照組,差異均具有統計學意義(P<0.05)。見表2。
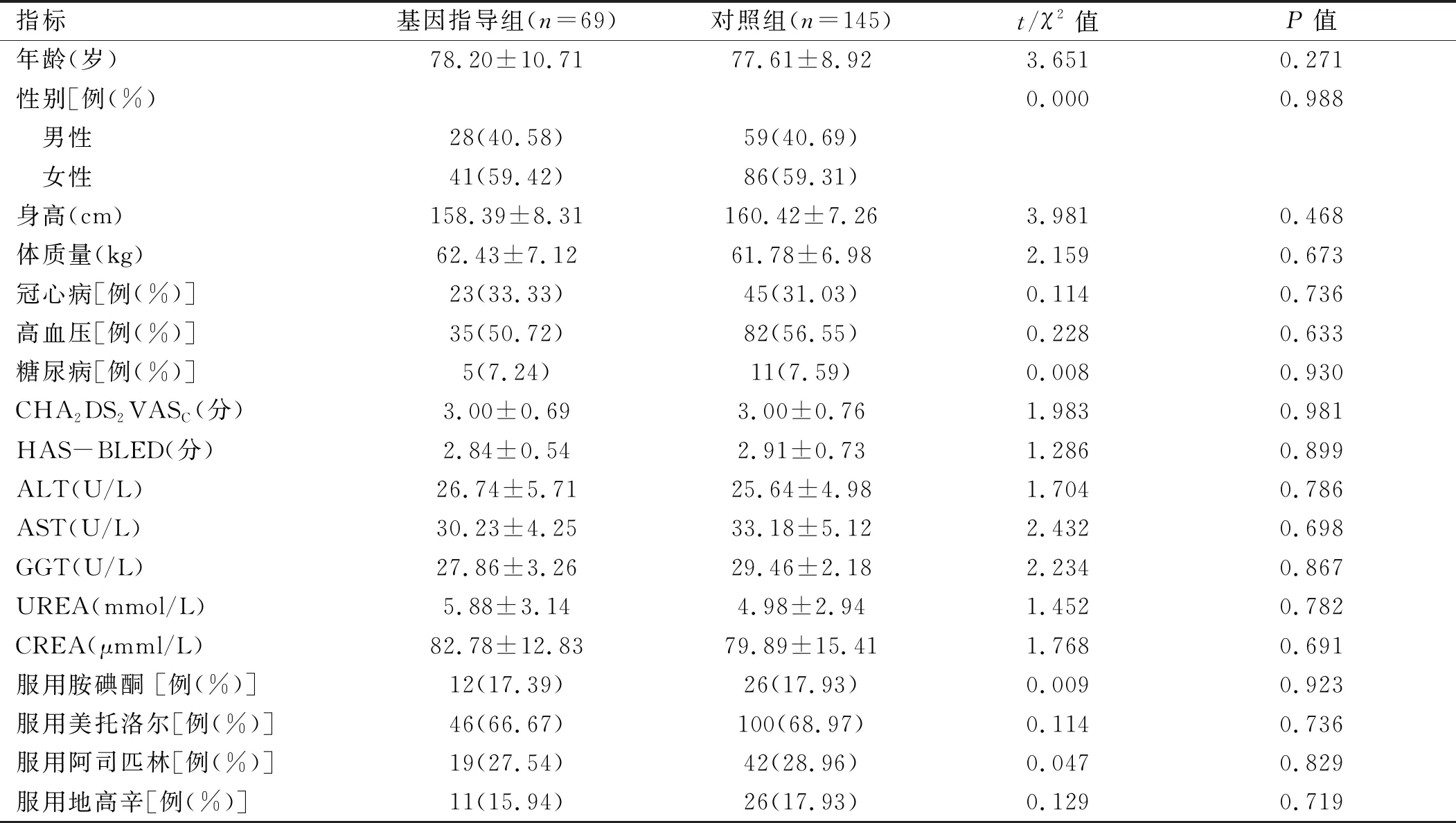
表1 兩組患者一般資料比較
2.3.1 CYP2C9組與對照組華法林初始劑量、穩定劑量、起效時間比較 CYP2C9組患者的華法林應用初始劑量、穩定劑量均低于對照組,起效時間也短于對照組,第21天達穩定劑量患者比例高于對照組,差異有統計學意義(P<0.05)。*1/*1組、*1/*3組患者的初始華法林劑量、穩定劑量均低于對照組,起效時間短于對照組,第14、21天達穩定劑量患者比例高于對照組,差異有統計學意義(P<0.05);兩組患者起效時間、第14天達穩定劑量患者比例差異無統計學意義(P>0.05),第21天達穩定劑量患者比例差異有統計學意義(P<0.05)。見表3。
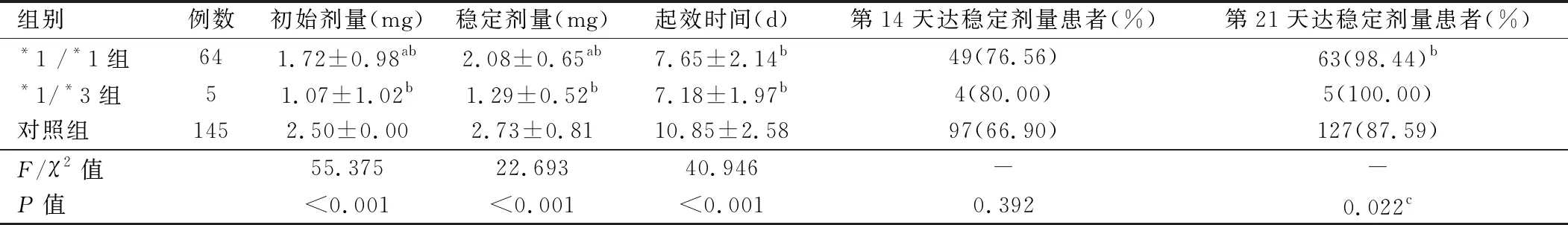
表3 CYP2C9 組與對照組華法林初始計量、穩定劑量及起效時間比較
2.3.2 VKORC1組與對照組華法林初始劑量、穩定劑量及起效時間比較 VKORC1組華法林應用初始劑量、穩定劑量均低于對照組,起效時間短于對照組,第14、21天達到穩定劑量患者比例高于對照組,差異有統計學意義(P<0.05)。AA型、GA組患者初始華法林劑量、穩定劑量均低于對照組,起效時間短于對照組,第14、21天達到穩定劑量患者比例高于對照組,差異有統計學意義(P<0.05)。GA組華法林達穩定劑量小于AA組,第14天內達穩定劑量患者的比例高于AA組,差異有統計學意義(P<0.05)。見表4。
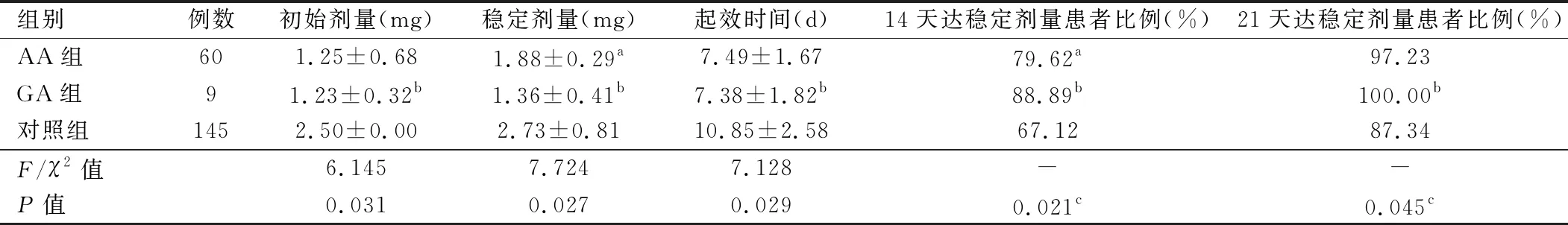
表4 VKORC1 組與對照組華法林初始劑量、穩定劑量及起效時間比較
3 討論
不同種族及地區人群對華法林劑量反應存在差異,主要是基于 CYP2C9 和 VKORC1 基因SNPs多態性不同。85%以上的 S-華法林由CYP2C9 酶代謝[8-9]。VKORC1基因編碼的維生素K環氧化酶還原酶在凝血因子激活過程中起著重要作用,是華法林作用的靶點。
CYP2C9基因目前已經命名58種SNPs,分別以CYP2C9*1-CYP2C9*58 命名,以*1/*1(*2CC/*3AA)所占比例較高[10]。位于VKORC1基因啟動子區(-1639G>A)的單核苷酸突變可以影響其表達,是導致華法林藥物劑量個體差異的主要原因之一,通常該基因AA型相對較多[11]。本研究中,CYP2C9*1/*1所占比例最高,*1/*3所占比例較少,VKORC1 基因型中AA型所占比例最高,AG型所占比例較少,與Kumar等[7]研究結果一致。
研究[10]表明,VKORC1攜帶雜合子突變基因型比野生基因型的患者需要華法林劑量相對較低。本研究結果顯示,GA型與AA型患者相比,達到穩定劑量時所需華法林的劑量更低,同時14天內達到穩定劑量患者的比例更高。在CYP2C9基因型中也有類似發現,*1/*1及*1/*3基因型患者華法林初始劑量,達到穩定劑量時華法林劑量均較低,約占常規劑量的70%;VKORC1基因型分布多為AA基因型,與對照組相比,華法林初始劑量,達到穩定劑量時所需華法林劑量也較低,約占常規劑量的50%左右。通過基因分型指導應用華法林,其初始劑量及達到穩定劑量所需的華法林劑量均較低,符合由于CYP2C9和VKORC1 基因SNPs多態性導致華法林劑量反應差異的藥理學特征,與既往研究[7]結果類似,減少起始華法林用量以及由于藥物劑量波動導致的不良事件的發生。本研究利用CYP2C9與VKORC1基因多態性結合相關指南及患者的臨床特點,指導華法林應用,初始劑量、達標劑量、達標天數等指標低于對照組,第14及21天內達穩定劑量患者比例高于對照組,對華法林劑量的個體化應用具有一定指導價值。
結合NVAF患者臨床情況,利用華法林相關基因多態性的檢測,可為華法林劑量的合理應用提供客觀的依據,達到提高療效、減少不良反應的目的,對華法林抗凝防治的管理有一定的實用性及指導意義。但本研究入選的NVAF患者局限于本地區人群,樣本量較小,尚具有一定局限性。

