枯草桿菌素Subtillicin L的純化鑒定及抑菌性質
李津津,王偉,陶樂仁,遲海*
1(上海理工大學 醫療器械與食品學院, 上海, 200093)2(中國水產科學研究院東海水產研究所, 上海, 200090)
食品致病菌的污染和繁殖是食品安全的主要問題之一[1]。傳統的食品抑菌方式主要有超高壓殺菌、輻射殺菌、熱殺菌和添加其他生物抑菌劑等[2]。然而超高壓殺菌、輻射殺菌、熱殺菌等方式對食品品質造成一定的影響。同時,食品添加劑的過量添加與潛在殘留也使得消費者對食品安全產生擔憂[3]。因此亟需尋求新型抑菌物質來抑制食品致病菌的殘存,確保食品安全。細菌素是由細菌核糖體內合成的一類抗菌肽,具有高效、安全、綠色、熱穩定性強,易被蛋白酶分解等特性。因此,細菌素被認為是有效代替傳統抑菌方式的抑菌物質之一,受到廣泛的關注[4]。
目前,乳酸鏈球菌素(Nisin)和片球菌素是被食品與藥品管理局和世界衛生組織(Food and Drug Administration/World Health Organization,FDA/WHO)允許在食品中添加的細菌素[5]。相關研究表明,片球菌素抑菌譜較窄,只對單增李斯特菌和部分乳酸菌有抑制作用[6];Nisin較片球菌素的抑菌譜廣,對大部分革蘭氏陽性菌有抑制作用。然而,Nisin對耐熱性的芽孢菌,特別是蠟樣芽孢桿菌的抑制效果不明顯[5]。這也限制了Nisin在熱加工食品中的應用。且蠟樣芽孢桿菌在溫和加工產品中易殘留,具有較大的危害性[7]。因此,篩選、鑒定對耐熱性芽孢菌有抑制作用的新型細菌素十分必要。
本研究利用細菌素對親緣細菌有高效抑制作用的特性,使用實驗室前期自牡蠣中分離的1株具有廣譜抑菌效果的枯草芽孢桿菌(B.subtillisDH8403),對其所產細菌素(Subtillicin L)開展系統分離純化研究,并利用全基因組測序數據分析其產細菌素的潛在結構基因和氨基酸信息。最后,將粗提的細菌素與Nisin的抑菌活性進行比對,探討其對蠟樣芽孢桿菌的抑菌特性,旨在為新型細菌素在抑制蠟樣芽孢桿菌的應用提供基礎數據。
1 材料與方法
1.1 實驗菌種
蠟樣芽孢桿菌LMG2805(BacilluscereusLMG2805)和產細菌素的枯草芽孢桿菌DH8043(B.subtilisDH8043),由中國水產科學院東海水產研究所提供。
1.2 試劑與儀器
腦心浸液肉湯(brain heart infusion, BHI)培養基,Oxoid 英國;磷酸鹽緩沖溶液(0.01 mol/L,pH 6.8),北京貝洛生物科技有限公司;(NH4)2SO4、三氟乙酸(Trifluoroacetic acid,TFA)、DEAE纖維素(DE-32)、葡聚糖凝膠G50(Sephadex G-50),國藥集團化學試劑有限公司;細菌DNA提取試劑盒,美國Thermo Scientific公司。
Multiskan MK3酶標儀,Thermo Scientific公司;MIR-153低溫恒溫培養箱,日本三洋(SANYO)電機公司;SEX-TJ超凈工作臺,上海整新電子設備;YXQ-LS-SLL立式壓力蒸汽滅菌器、酶標板,上海生工生物工程有限公司;恒溫振蕩器CHA-S,國華電器有限公司;CF 16RXII低溫離心機,日立(Hitachi)有限公司;Nanodrop 2 000超微量分光光度計,Thermo Scientific公司。
1.3 試驗方法
1.3.1 (NH4)2SO4粗提Subtillicin L
將B.subtilisDH8043按照1%的接種量接種到1 L的BHI液體培養基中,37 ℃在搖床中過夜培養至少12 h,將菌液在4 ℃,10 000 r/min條件下離心30 min,將上清液經過0.22 μm的濾膜后添加不同濃度的飽和(NH4)2SO4(飽和度10%~80%)至上清液中[8],充分混勻后,在4 ℃條件下靜置至少4 h。將不同濃度的飽和(NH4)2SO4溶液在10 000 r/min條件下離心30 min。將沉淀溶于2.5 mL 0.1%(體積分數)TFA中備用。
1.3.2 最小半抑菌活性的測定
采用CHI等方法[9],利用96孔板微量稀釋法測定Subtillicin L的最小半抑菌濃度(minimum inhibition concentration, MIC50)。細菌素的抑菌濃度(bacteriocin union, BU)以對照組的OD600nm為0.4~0.5時抑制50%的蠟樣芽孢桿菌的最低用量表示。
1.3.3 陰離子交換分離純化
選取5 mL最佳飽和度(NH4)2SO4沉淀的細菌素粗提物,通過DE-32陰離子交換柱進行進一步純化。以PBS緩沖溶液沖洗(流速為5 mL/min),再分別用0.5、1 mol/L的NaCl進行梯度洗脫,控制流速為5 mL/min。在OD280nm條件下檢測和收集出峰的洗脫液,利用1.3.2的方法測試收集管的抑菌活性。將有抑菌活性的溶液收集后進行冷凍干燥,收集備用。
1.3.4 Sephadex G-50層析分離純化
將1.3.3中收集的冷凍干燥樣品復溶到4 mL的0.1%TFA中,通過Sephadex G-50層析柱進行進一步分離純化。以10倍體積柱效的0.1%TFA沖洗層析柱,控制流速為1 mL/min。在OD280nm條件下檢測和收集出峰的洗脫液。
1.3.5 細菌素質量濃度確定
參考張寧等[10]的方法,采用紫外分光光度計法對細菌素的質量濃度進行測定,結果用mg/mL表示。
1.3.6 三甲基甘氨酸-十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(tricine-sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,Tricine-SDS-PAGE)
根據PERVMAL等[11]的方法,對分級純化后的Subtillicin L進行Tricine-SDS-PAGE凝膠電泳。
1.3.7 枯草芽孢桿菌DH8043的全基因組測序及分析
枯草芽孢桿菌DH8043的DNA提取方法參照試劑盒說明進行。利用納米孔測序標準方法[12-13](DNA樣品進行質量檢測、文庫構建、文庫質量檢測和文庫測序,對測序后的數據進行統計分析和基因組組裝)對枯草芽孢桿菌DH8043進行全基因組測序。
對組裝后的基因組數據通過CLC Genomics Workbench 20.0.2軟件讀取基因組數據,讀取后的基因組經RAST進行注釋后用BAGEL4進行細菌素結構基因的比對[14-16]。
1.3.8 Subtillicin L結構基因的擴增及鑒定
以枯草芽孢桿菌DH8043的基因組學DNA為模板,根據其全基因組測序結果,設計擴增其所產細菌素結構基因的上游引物(PsubF:5′-TCTTTATGCTGCCGCAGGAA-3′)和下游引物(PsubR:5′-TTACCAAGCAGCTGCGTATT-3′)。建立25 μL擴增體系,擴增條件為94 ℃預變性3 min;進入聚合酶鏈式反應(polymerase chain reaction,PCR)循環階段后,94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸20 s,共30個循環;72 ℃延伸5 min,4 ℃保存。取5 μL PCR擴增產物在10 g/L瓊脂糖凝膠下進行電泳實驗,一定時間后觀測并記錄PCR擴增產物,并將剩余的PCR擴增產物送生工(上海)生物有限公司測序。
1.3.9 Subtillicin L抑菌性質的研究
參照CHI等[9]方法,利用96孔板微量稀釋法,利用不同的最小半抑菌濃度(MIC50和4 MIC50),在一定時間間隔(8 h)內比較不同濃度枯草桿菌素Subtillicin L和Nisin對蠟樣芽孢桿菌的抑制性質,并利用Origin繪制兩者的時間-殺菌曲線。
2 結果與分析
2.1 (NH4)2SO4粗提Subtillicin L試驗
圖1是不同飽和濃度的(NH4)2SO4對細菌素Subtillicin L抑菌能力的影響。結果顯示,上清液經不同飽和度(NH4)2SO4沉淀后(10%~80%),沉淀產物復溶溶液的抑菌能力與(NH4)2SO4濃度變化相關。隨(NH4)2SO4濃度增加,抑菌效果也增加。經低飽和度(NH4)2SO4(飽和度10%~30%)沉淀的復溶物對蠟樣芽孢桿菌沒有抑制能力;添加40%飽和度(NH4)2SO4與50%、60%條件下的抑菌孔分別為3個和5個;70%和80%飽和度(NH4)2SO4沉淀下的抑菌孔均為7個。因此,最終選擇70%飽和度(NH4)2SO4對Subtillicin L進行粗提。在此條件下的Subtillicin L對蠟樣芽孢桿菌的MIC50為5 BU/mL。同時,Nisin對蠟樣芽孢桿菌的MIC50為20 μg/mL。這說明在一定時間內,單位抑菌濃度條件下的Subtillicin L對于蠟樣芽孢桿菌的抑菌能力相當于20 μg的Nisin。

圖1 不同(NH4)2SO4飽和度沉淀下的Subtillicin L對蠟樣芽孢桿菌抑菌能力的影響Fig.1 Inhibition activities of Subtillicin L at different ammonium sulfate precipitated concentration against B. cereus
2.2 Subtillicin L分級純化
經70% 飽和度的(NH4)2SO4粗提后的枯草桿菌素Subtillicin L,經陰離子交換柱分離純化后,粗提液在0.5、1 mol/L NaCl條件下洗脫后對蠟樣芽胞桿菌有抑菌活性。洗脫后的Subtillicin L抑菌活性分別為20 BU/mL和5 BU/mL。出現這種情況的原因可能是低濃度的NaCl未能完全洗脫細菌素,而高濃度條件下的NaCl將未洗脫的細菌素完全洗脫。低濃度的細菌素溶于高濃度的NaCl造成其抑菌活性的降低[17]。因此本實驗只將0.5 mol/L的NaCl洗脫液進行收集,凍干后進行后續研究。
如圖2所示,將冷凍干燥后的Subtillicin L經Sephadex G-50層析柱洗脫后得到2個蛋白峰(F1和F2)。經過抑菌活性測定后,只有F2所對應的收集液具有抑菌效果,抑菌活性為20 BU/mL。
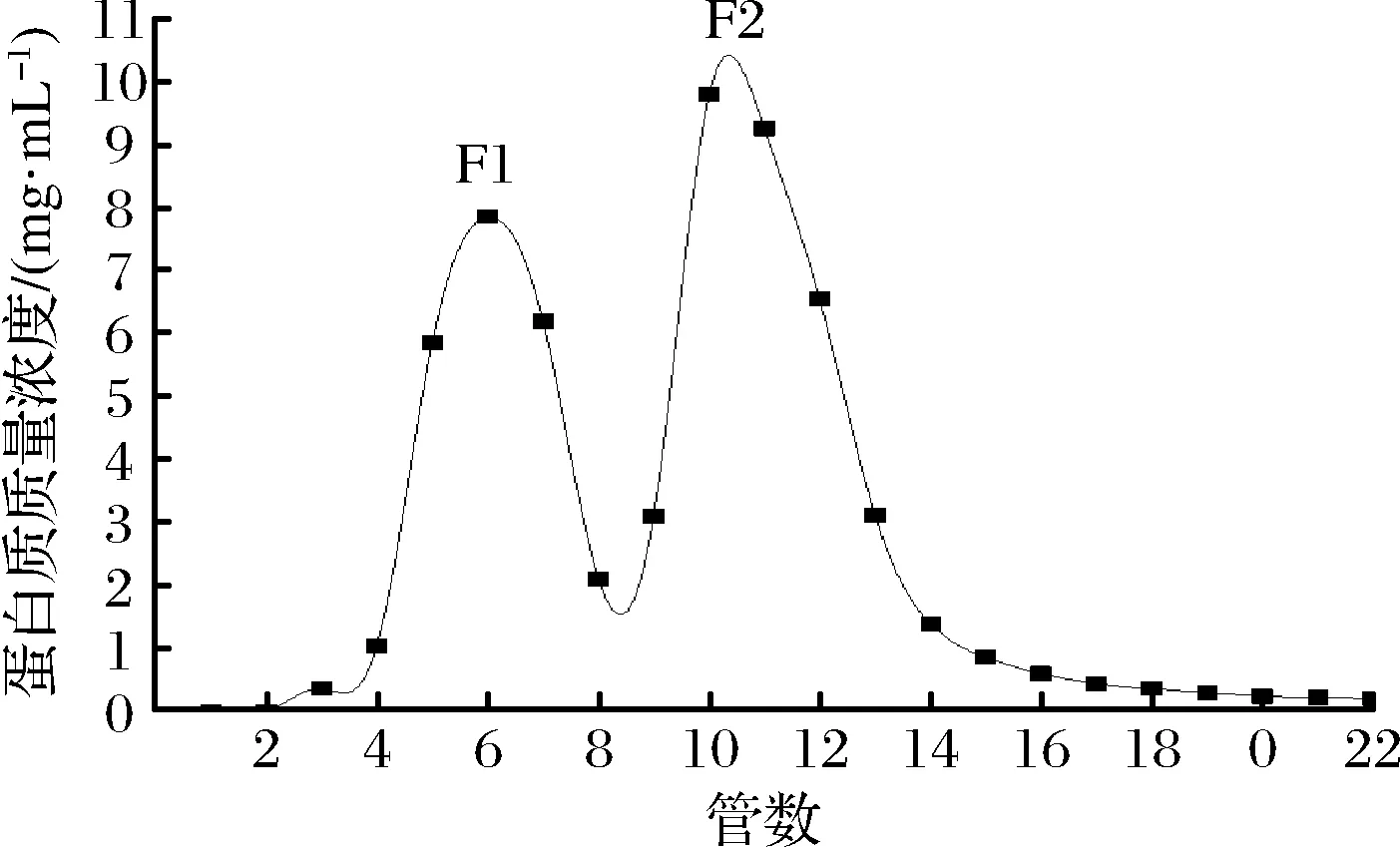
圖2 不同收集管數的細菌素濃度Fig.2 Bacteriocin concentrations in different tubes
2.3 Subtillicin L分子質量確定
將經過分級純化的Subtillicin L進行分子量測定(圖3)。結果顯示,經提純后的Subtillicin L在電泳條件下呈現出1條條帶,其分子質量為12.0~13.0 kDa。目前由芽孢桿菌屬產的細菌素有多種類型,其中Amylocyclisin科的細菌素分子質量約為12.3 kDa[18]。這類細菌素多為環形細菌素,且有較為廣泛的抑菌譜,其中Amylocyclisin作為其中代表研究最為透徹[19]。利用細菌素具有自身免疫系統的特點,本實驗利用Subtillicin L抑制1株產Amylocyclisin的解淀粉芽孢桿菌。結果發現Subtillisin L對其有抑制作用(結果未列出),這說明本實驗發現的Subtillisin L不同于已知發現的Amylocyclisin。因此,對產Subtillisin L的菌株進行后續的全基因組測序,并通過全基因組測序預測產Subtillicin L的結構基因,對結構基因進行PCR擴增進而判斷Subtillisin L與Amylocyclisin的相似程度。
2.4 潛在抑菌物質結構基因比較及分析
將產Subtillicin L細菌的全基因組完成圖上傳到BAGEL4,并對比現有細菌素數據庫信息。分析結果顯示,Subtillicin L結構基因由轉運蛋白,免疫蛋白等典型的細菌素結構基因組成(圖4)。對比數據顯示共有3個潛在相似結果,其中Subtillicin L與Amylocyclisin潛在相似度最高,相似度為99.11%。利用全基因組測序結果設計擴增引物并對擴增序列進行測序,結果發現Subtillicin L與Amylocyclisin在第88個氨基酸上存在差別。其中Subtillicin L為蘇氨酸而Amylocyclisin為丙氨酸(圖5)。該結果也與全基因組測序結果一致。這說明Subtillicin L可能為新型的環形細菌素,推測其分子質量與Amylocyclisin一樣為12.3 kDa。
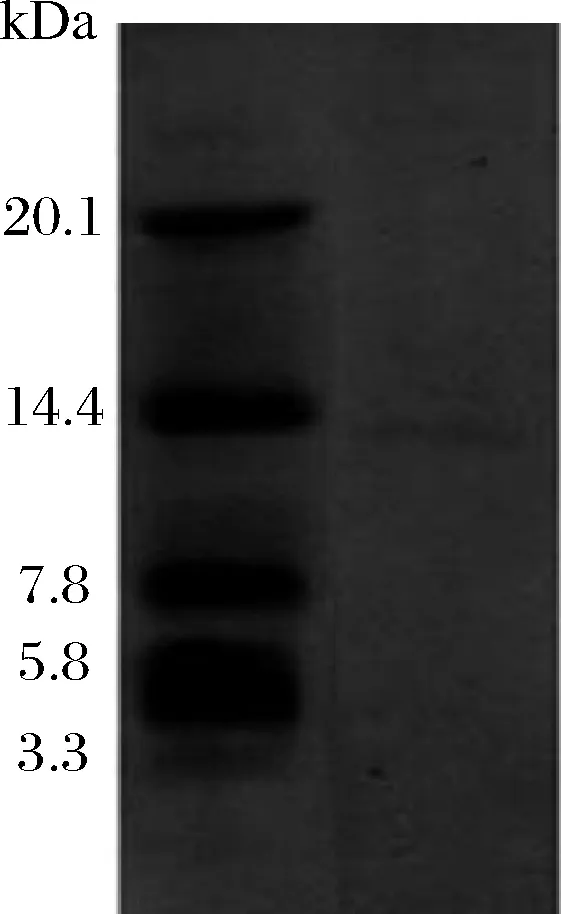
圖3 Subtillicin L的 tricine-SDS-PAGE電泳Fig.3 Tricine-SDS-PAGE electrophoresis of Subtillicin L

圖4 Subtillcin L潛在結構基因比對結果Fig.4 Predictive structure genes of Subtillicin L at BAGEL4

圖5 Subtillcin L與Amylocyclisin氨基酸比對Fig.5 Amino acids Alignment between subtillcin L and Amylocyclisin
2.5 Subtillicin L抑菌性質研究
圖6為不同濃度的Subtillicin L和Nisin對蠟樣芽孢桿菌8 h內的時間-殺菌曲線。結果顯示,MIC50條件下Subtillcin L與Nisin在4 h內均可以完全抑制蠟樣芽孢桿菌的生長,而后抑菌效果減弱導致蠟樣芽孢桿菌生長。4 MIC50條件下的Subtillcin L在8 h可以完全抑制蠟樣芽孢桿菌的生長,而4 MIC50條件下的Nisin抑制蠟樣芽孢桿菌5 h后開始緩慢生長,但生長速度低于MIC50條件下的Nisin。這說明高濃度條件下的Subtillicin L對于蠟樣芽孢桿菌屬于完全抑制(bacteriocide),Nisin屬于阻止生長(bacteriostatic)。同時,在相同MIC50條件下,Subtillicin L對蠟樣芽孢桿菌的抑菌效果要強于Nisin,這也為Subtillicin L在抑制蠟樣芽孢桿菌時提供除Nisin外更多的選擇。

圖6 不同濃度的Subtillicin L和Nisin對蠟樣芽孢桿菌的時間-殺菌曲線Fig.6 Time-killing curve of Subtillisin L and Nisin against B. cereus at different concentrations
3 結論
蠟樣芽孢桿菌可以在熱或其他極端條件下產生孢子從而殘存。過量殘存下的蠟樣芽孢桿菌可以產生腸毒素,人們誤食可引發嘔吐、腹瀉等癥狀[20]。因此,有效抑制蠟樣芽孢桿菌的殘存對解決由其引起的食品安全有促進作用。本文對實驗室前期分離出的1株具有廣譜抑菌效果的枯草芽孢桿菌(B.subtillisDH8403)所產的細菌素進行了系統分離純化、全基因組數據比對和抑菌特性研究。實驗結果顯示,飽和度為70%和80%的(NH4)2SO4對枯草桿菌素(Subtillicin L)粗提效果最好,對其抑菌效果有明顯的提高。將粗提后的Subtillicin L經過系統分離純化(陰離子交換和層析分離),得到唯一的一個蛋白峰,其分子質量為12~13 kDa。結合全基因組測序結果,對Subtillicin L的結構基因進行預測分析。結果發現Subtillicin L與Amylocyclisin相似度最高,為99.11%,Subtillicin L與Amylocyclisin氨基酸序列在第88個氨基酸上存在差別,前者為蘇氨酸,后者為丙氨酸。由此可以推斷Subtillicin L可能為新型環狀細菌素,其分子質量確定為12.3 kDa。最后,經過對比及分析一定時間內(8 h)的Subtillicin L粗提物與Nisin對蠟樣芽孢桿菌的抑菌效果,結果發現高濃度(4 MIC50)條件下的Subtillicin L可以完全抑制蠟樣芽孢桿菌生長,相同濃度條件下的Nisin只能對蠟樣芽孢桿菌暫時阻止生長。

