液相色譜-串聯質譜法測定木瓜發酵飲料中的三種α-二羰基化合物
陳榮祥,顧雯,羅敏,何婷,尹考,羅春燕
1(遵義醫科大學,分析測試中心,貴州 遵義,563000)2(遵義醫科大學 藥學院,貴州 遵義,563000)3(遵義醫科大學 檢驗醫學院,貴州 遵義,563000)
木瓜是我國廣泛分布的木本植物,作為藥食兩用作物其應用和研究有數千年之久。木瓜中含有蘋果酸、酒石酸、檸檬酸、琥珀酸等有機酸,同時含有豐富的單寧,其含糖量相對較低,口感酸澀,不宜生吃[1]。因此,木瓜作為食品多采用加工后食用,例如在黔北地區通常采用加糖、加水后自然發酵3個月左右,發酵生產的飲料口感明顯改善,在當地很受歡迎[2-3]。
然而,與其他發酵產品類似,木瓜發酵飲料在發酵過程中可能通過美拉德反應產生乙二醛、丙酮醛、丁二酮等α-二羰基化合物。這些化合物是在焦糖化反應逆醛醇縮合、自氧化和美拉德反應中形成的活性中間體[4]。在發酵飲料中,α-二羰基化合物是蘋果酸-乳酸發酵的結果,可在酒精發酵后或同時發生,廣泛存在于蜂蜜、啤酒、咖啡、食用油、醋和醬油中[5]。它們是食品中風味和顏色的重要前體物質,可與酯類物質相互作用,促進酯類物質的揮發,使發酵產物具有特殊的復合風味和口感。但是,如果α-二羰基化合物的含量過高,會對發酵產品的風味產生負面影響。同時,過量攝入這些化合物也會影響人體健康,導致蛋白質糖基化并誘導糖基化終產物的形成,造成細胞損傷和炎癥[6-7]。還可能引起淀粉樣蛋白的積累,誘發阿爾茨海默癥[8-9]。因此,發酵飲料中的α-二羰基化合物含量的準確、靈敏的檢測方法對于正確評價其質量具有重要意義和應用價值。
α-二羰基化合物早期檢測多采用分光光度法,但該法靈敏度低,只能測定α-二羰基化合物的總量,不能測定單個化合物的濃度[10]。目前最常用的方法是用衍生試劑與之反應,然后用氣相色譜或液相色譜法進行檢測[11-13]。常用的衍生試劑有2,4-二硝基苯肼、氨基胍、甲基羥胺、吉拉德T試劑、鄰苯二胺類等[14-15]。其中鄰苯二胺類衍生試劑如鄰苯二胺(o-phenylenediamine, OPD)[16]、4,5-亞甲二氧基-1,2-鄰苯二胺[17]、4-硝基鄰苯二胺[18],3,3-二氨基聯苯胺[19]等最為常用,衍生產物采用紫外、熒光檢測[20-21]。然而光學檢測器存在靈敏度不高、選擇性較差等問題。相對于光學檢測器,串聯質譜靈敏度更高,選擇性更好。例如,有文獻采用鄰苯二胺進行衍生化,進一步采用固相萃取凈化,液相色譜-串聯質譜(liquid chromatography-tandem mass spectrometry,LC-MS/MS)測定乳制品中的α-二羰基化合物[22]。也有文獻首先進行固相萃取凈化,后采用鄰苯二胺衍生化的方式測定碳酸飲料中的α-二羰基化合物[23]。然而,這些方式均需要復雜的固相萃取凈化,前處理步驟繁瑣,成本較高。超濾離心是一種簡單的前處理凈化方式,可以有效去除樣品中的蛋白質、核酸等大分子成分,適合乳制品、血漿等蛋白含量較高的樣品的凈化[24-25]。木瓜中含有豐富的木瓜蛋白酶、超氧化物歧化酶等多種蛋白質,然而目前還沒有針對木瓜發酵飲料中α-二羰基化合物的測定方法。本研究采用離心超濾的方式對木瓜發酵飲料進行凈化,進一步采用鄰苯二胺進行衍生化,建立了柱前衍生-高效液相色譜-串聯質譜法測定3種α-二羰基化合物的方法,并應用該方法測定不同發酵時間下木瓜飲料中的α-二羰基化合物的含量。
1 材料與方法
1.1 儀器和試劑
I-class-TQ-S超高效液相色譜-三重四級質譜儀,美國Waters公司;SB-800DTD超聲波清洗儀,寧波新芝;Microfuge-20高速離心機,美國Beckman Coulter公司;Purelab Chorus2超純水系統,英國Elger公司;ME-104電子天平、FE-28 pH計,瑞士Mettle-Toledo公司;超濾離心管(截留分子質量為10、50、100 kDa),美國Millipore公司。
OPD(99.5%)、乙二醛(40%)、丙酮醛(40%)、丁二酮(≥99%),上海阿拉丁生化科技股份有限公司;乙腈(質譜純),霍尼韋爾貿易(上海)有限公司;其他試劑均為分析純;木瓜發酵飲料,正安天樓食品有限公司。
1.2 標準儲備液和衍生試劑的制備
標準儲備液的制備:準確移取乙二醛、丙酮醛、丁二酮溶于超純水中,定容至100 mL,制備質量濃度為1 mg/mL的儲備液,4 ℃下儲存備用。
衍生溶液的配制:稱取鄰苯二胺10 mg,用水溶解并定容至10 mL,配成質量濃度為1 mg/mL的鄰苯二胺溶液。
1.3 樣品處理和衍生化反應
移取1 mL待測樣品,加水稀釋至10 mL。取1 mL加入超濾管中(截留分子質量10 kDa),5 000 r/min離心10 min。吸取濾液0.5 mL加入0.5 mL OPD 衍生試劑和0.1 mL 0.1 mol/L NaHSO4溶液,渦旋混勻,室溫下反應15 min后,進行LC-MS/MS測定。OPD與3種α-二羰基化合物的反應方程式如圖1所示。
1.4 色譜條件
色譜柱:Waters Xbridge BEH C18(100 mm×2.1 mm,1.7 μm); 流動相:0.2%乙酸水溶液(A)-乙腈(B),梯度洗脫:0~5 min,25%B, 6 min,80%B, 7 min,80%B, 7.5 min,25%B;體積流量0.2 mL/min;柱溫40 ℃;進樣量1 μL。

圖1 α-二羰基化合物與OPD的衍生化反應Fig.1 Derivative reaction of α-compounds with OPD
1.5 質譜條件
電噴霧電離源,正離子模式下采用多反應監測模式檢測。毛細管電壓3.5 kV;脫溶劑溫度500 ℃;脫溶劑氣體(N2)流量750 L/h,離子源溫度150 ℃,碰撞氣為Ar。為防止過量的衍生試劑及難揮發緩沖鹽污染質譜,2 min之前的色譜洗脫成分不經質譜直接排入廢液。
2 結果與分析
2.1 超濾管截留分子質量的選擇
木瓜中含有豐富的木瓜蛋白酶、超氧化物歧化酶等多種蛋白質,此外還含有豐富的多糖。這些大分子化合物不僅會污染色譜柱,影響色譜分離,還可能導致較強的基質效應影響離子化效率。食品檢測中大分子化合物通常可以采用有機溶劑沉淀、固相萃取、超濾等方式去除[26-28]。其中離心超濾的方式操作簡單,不需要額外有機溶劑及吸附劑等,綠色環保[25]。因此,本研究選擇超濾離心的方式去除此類大分子化合物。
將3種化合物對照品儲備液稀釋成質量濃度為0.5 mg/L混合溶液,分別向截留分子質量10、50、100 kDa的超濾管內室加入3種化合物溶液2 mL,5 000 r/min下離心10 min,收集濾液。將超濾離心前后的3種化合物溶液衍生化之后進樣測定,計算不同截留分子質量的超濾管對3種化合物回收率的影響,結果表明使用10、50、100 kDa超濾管離心過濾后,3種化合物的回收率均>95%,說明不同規格超濾管對于3種化合物均無顯著性吸附作用。考慮到截留分子量越低,去除雜質效果越好,選擇10 kDa超濾管用于凈化。
2.2 衍生化反應條件的優化
2.2.1 反應體系pH優化
通常,反應體系的酸度、溫度和反應時間對反應效果有直接影響。鄰苯二胺類衍生試劑的衍生化反應條件的優化有文獻進行了大量的研究,反應條件為弱酸性[14]、中性[23]、弱堿性[13]均有報道。我們分別采用不同濃度的NaHSO4溶液(0.05, 0.1, 0.2, 0.3, 0.5 mol/L)、pH 3~10的緩沖溶液(pH 3.0, 5.0, 7.0, 8.5, 10.0),在40 ℃反應15 min,結果表明,所有條件下的產物峰面積無顯著性的差異(峰面積差異<10%),均可用于OPD的衍生化反應。考慮配制和操作方便,采用0.1 mol/L NaHSO4作為衍生試劑的添加劑。
2.2.2 反應體系的溫度和反應時間的優化
在本實驗中研究了不同反應溫度(室溫、40、50、60、70、80、90 ℃)對衍生物峰面積的影響。結果表明,隨著反應溫度的升高,衍生物的峰面積保持不變,可以在室溫下進行反應。隨后,在室溫下研究了反應時間(5、15、30、60 min)對衍生物峰面積的影響。結果表明,當反應時間為15 min時,產物的峰面積已達最大,且隨著反應時間的延長,產物的峰面積保持穩定。因此,選擇反應時間為15 min。
2.2.3 衍生試劑用量的優化
按照樣品和衍生試劑的體積比為1∶1,比較不同濃度的OPD衍生試劑對于衍生產物的影響。結果表明,在OPD質量濃度為0.05~5 mg/mL,乙二醛、丙酮醛、丁二酮衍生產物的峰面積隨著OPD質量濃度的增加而增加,初始增加較快,當衍生試劑的質量濃度>1 mg/mL時,其峰面積增加緩慢(圖2),因此,選擇衍生試劑的質量濃度為1 mg/mL。

圖2 衍生試劑OPD質量濃度的優化Fig.2 Optimization of OPD concentration for the derivative reaction
2.3 色譜條件優化
在本次試驗中,我們比較了乙酸和乙酸銨溶液作為流動相添加劑對目標化合物色譜峰和電離度的影響,結果表明,在2種流動相條件下其分離效果均較好。但在ESI+模式下,酸性環境有利于目標化合物的離子化,提高靈敏度,所以選擇0.2%(體積分數)乙酸作為流動相添加劑。
2.4 質譜條件優化
將乙二醛、丙酮醛、丁二酮用超純水配制成質量濃度為0.5 mg/L混合標準溶液,加入OPD衍生化后進樣,進行質譜條件的優化。通過全掃描模式確定3種衍生產物的母離子,在選擇離子監測模式下優化錐孔電壓。進一步通過產物離子掃描模式確定其產物離子,選擇峰度最高的產物離子用于質譜多反應監測(multiple reaction monitoring,MRM),并優化其碰撞能量。優化后的最佳質譜條件如表1所示,衍生產物的二級質譜如圖3所示。
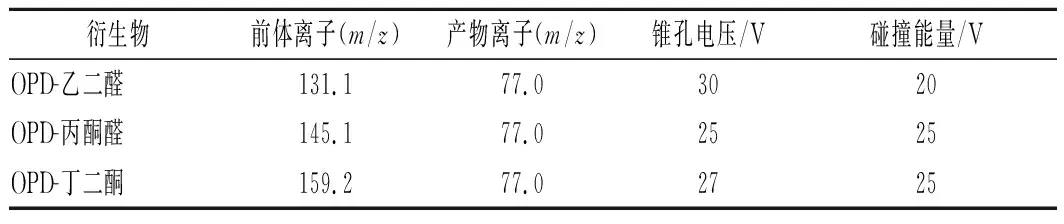
表1 α-二羰基化合物衍生產物的質譜分析參數Table 1 MRM parameters of the α-dicarbonyl compound derivative products

a-OPD-乙二醛;b-OPD-丙酮醛;c-OPD-丁二酮圖3 三種α-二羰基化合物衍生產物的二級質譜圖Fig.3 Mass spectrograms of the 3 kinds of α-dicarbonyl compounds
2.5 方法驗證
2.5.1 標準曲線及檢出限
將乙二醛、丙酮醛、丁二酮標準溶液配置成質量濃度為0.012、0.030、0.120、0.300、0.600、0.900 mg/L的混合標準品溶液,與OPD衍生試劑按1∶1的體積比均勻混合,在室溫下反應15 min,然后用LC-MS/MS進行檢測,重復3次,以峰面積y作為縱坐標,樣品質量濃度x(mg/L)作為橫坐標,進行線性回歸。結果表明,3種化合物在0.012~0.900 mg/L線性關系良好,相關系數r2>0.99,并以3倍信噪比計算檢出限。結果如表2所示。

表2 三種α-二羰基化合物的回歸方程、線性范圍和檢測限Table 2 Regression equation, liner range and LODs of the 3 α-dicarbonyl compounds
2.5.2 穩定性
乙二醛、丙酮醛、丁二酮與OPD溶液混合衍生化在室溫下放置12 h,每隔2 h進行測定,結果表明衍生物的峰面積RSD<5%(n=6),說明衍生產物穩定性較好。
2.5.3 回收率
在已測定濃度的實際樣品中進行3個不同質量濃度水平的加標回收試驗,重復6次。結果表明,乙二醛、丙酮醛、丁二酮的回收率為86.26%~95.29%,RSD為2.49%~7.31%(表3)。該方法回收率良好,可用于乙二醛、丙酮醛、丁二酮的準確測定。
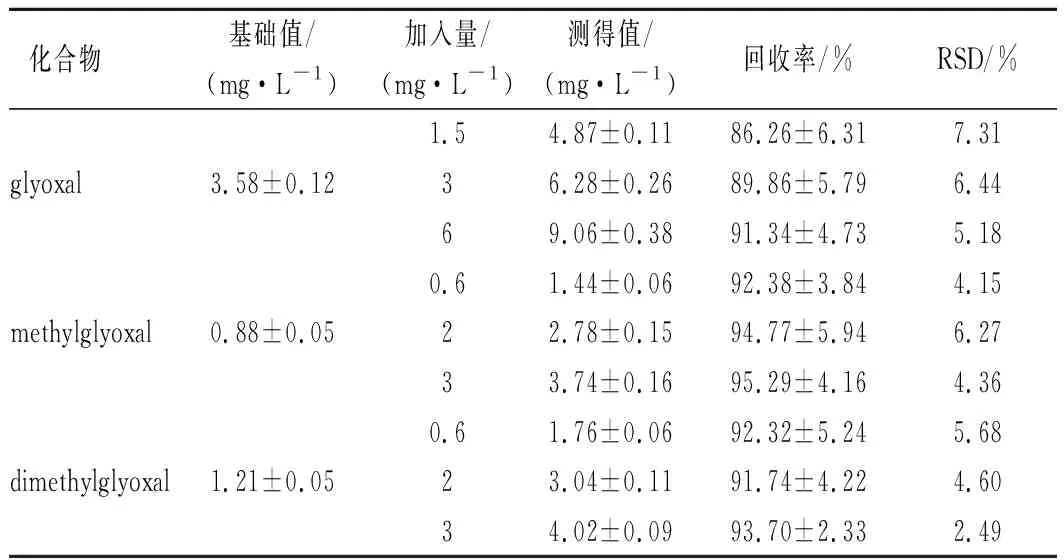
表3 木瓜發酵飲料中3種α-二羰基化合物的回收率(n=6)Table 3 Recovery of the α-dicarbonyl compounds in Fructus Chaenomelis fermented beverage
2.5.4 基質效應
木瓜發酵飲料中含有大量的蛋白、多糖、多酚等化合物,均可能影響其離子化。本實驗分別以水和待測樣品(稀釋10倍)為溶劑,分別配制不同質量濃度的3種待測化合物溶液,衍生化后測定,通過比較二者的斜率來評價基質效應,基質效應計算如公式(1)所示:

(1)
本研究中乙二醛、丙酮醛、丁二酮的基質效應分別為107.1%,111.8%,108.9%。通常認為在85%~115%范圍內無顯著基質效應[29]。本研究通過離心超濾以及衍生化處理后,3種衍生產物無顯著的基質效應。
2.6 實際樣品的檢測
取不同發酵時間木瓜果汁1 mL,用水稀釋至10 mL。按照1.3方法處理后進樣,測定乙二醛、丙酮醛、丁二酮的含量。標準品和樣品的色譜如圖4所示。
a-標準品OPD-乙二醛;b-樣品OPD-乙二醛;c-標準品OPD-丙酮醛;d-樣品OPD-丙酮醛;e-標準品OPD-丁二酮;f-樣品OPD-丁二酮圖4 木瓜發酵飲料中3種α-二羰基化合物衍生產物的標準品和樣品色譜圖Fig.4 Chromatograms of the 3 kinds of α-dicarbonyl compounds in standard solution and Fructus Chaenomelis fermented beverage
對不同發酵時間(0、0.25、0.5、1、2、4個月)的木瓜發酵飲料進行測定,結果表明,3種α-二羰基化合物的質量濃度隨著發酵時間延長而增加。其中乙二醛質量濃度最高,丙酮醛最低。當發酵時間達到0.5個月時,乙二醛的質量濃度達到峰值,發酵時間為1個月時,丙酮醛、丁二酮的質量濃度達到峰值,繼續增加發酵時間3種化合物的質量濃度基本保持穩定(圖5,表4)。
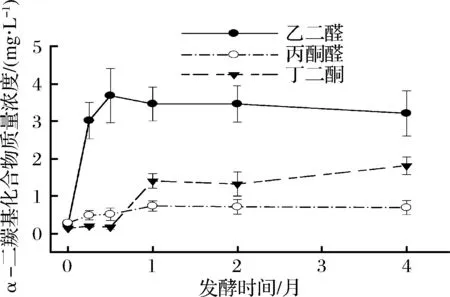
圖5 三種α-二羰基化合物質量濃度隨發酵時間的變化(n=3)Fig.5 Concentration of three α - dicarbonyl compounds with different fermentation time

表4 不同發酵時間下3種α-二羰基化合物濃度(n=3)單位:mg/L
3 結論
建立了以OPD為衍生試劑的柱前衍生-超高效液相色譜-串聯質譜法測定木瓜發酵飲料中乙二醛、丙酮醛、丁二酮含量的方法,并用于木瓜發酵飲料中這3種化合物含量的快速準確測定。結果表明,發酵時間為1個月時,α-二羰基化合物的質量濃度即達到最高值,繼續增加發酵時間其含量保持穩定。該方法線性范圍寬,重復性好,準確度高,可以為產品的質量控制提供方法依據。

