UO2芯塊在硝酸溶液中的溶解反應動力學
劉 方,鄭衛芳,左 臣,晏太紅
(中國原子能科學研究院,北京 102413)
近年來,有關UO2芯塊在HNO3溶液中的溶解行為的研究已有很多[1-6],但尚未給出明確的反應機制;另外,在溶解速率動力學計算方面,所得速率方程參數計算結果比較離散。UO2芯塊在硝酸溶液中的溶解表觀動力學參數差異較大[7],如H+反應級數1~3.3級,反應活化能15~97.5 kJ/mol。硝酸反應級數和反應活化能是這一反應的重要指標,分別表征酸度和溫度對溶解反應的影響程度。離散的動力學數據說明,不同研究對試驗數據的處理方法有較大差異;特別是在固體表面積無法準確測定條件下,很難清晰區分是反應條件(如溫度、酸度)的影響還是固體表面積變化的影響。從目前研究狀況看,分析溶解過程中的固體表面積及在固體表面積定量基礎上研究反應動力學還未見有公開報道。
單位面積內反應速率與反應過程的傳質及化學反應機制有關。若要獲得準確的溶解反應速率方程,須準確定量反應過程中固體的活性反應面積。假設反應固體是均一的,則可以認為反應活性面積與其表面積呈固定的正比關系。在溶解過程中,UO2芯塊表面積會變大,可能會增大至初始表面積的4倍左右[8]。目前的研究缺乏對溶解過程表面積的定量測定,這可能是造成所得反應動力學參數比較離散的原因。
在芯塊溶解過程中,通過測定溶解液中鈾質量濃度和繪制芯塊表面積變化曲線,計算單位面積溶解速率,并進一步計算硝酸反應級數及表觀活化能,有助于確定反應溫度與溶液酸度對溶解反應的影響,對工程設計具有參考意義。
1 試驗部分
1.1 試驗設備與試劑
UO2芯塊:中核包頭二〇二廠生產,直徑(8.19±0.01) mm,高(12.69±0.03) mm,圓柱形,密度10.34 g/cm3。
硝酸:分析純,國藥集團試劑廠生產。
壓汞儀,AutoPore9505型,美國麥克公司生產;平板式加熱攪拌器,HP550-S型;分析天平,梅特勒PL1501型,感量千分之一克;傅里葉變換近紅外光譜儀,Antariss-Ⅱ型,美國熱電公司生產。
1.2 試驗原理與方法
根據典型的固-液表面反應,溶解速率計算公式為
(1)
式中:m—芯塊質量,g;t—反應時間,min;m0——芯塊初始質量,g;φ—與反應芯塊相關的函數;A—固體表面活性反應面積,cm2;IDR—單位面積內反應速率,g/(min·cm2))。



前期工作獲取了2個試驗條件下的溶解過程芯塊表面積變化曲線,本試驗直接引用其表面積數據[9]。
單個芯塊的溶解:單個芯塊用夾持裝置固定懸空于燒杯中,浸沒于1 L一定濃度硝酸溶液中,在一定溫度與攪拌條件下進行反應。間隔一定時間取溶解液分析其中鈾質量濃度,計算芯塊溶解質量。
1.3 分析方法
芯塊表面積采用壓汞儀測定。溶解過程中由于硝酸大大過量,所以只測定初始酸度,假設溶解過程中酸度不變。游離酸濃度采用近紅外光譜直接測定[10]。溶解液酸度范圍0.1~6.0 mol/L,3.0 mol/L 時,RSD<3%。溶液中的鈾濃度分析采用X熒光分析法測定,測定數據借助標準曲線計算鈾質量濃度。
2 試驗結果與討論
2.1 芯塊溶解過程中表面積的變化
硝酸濃度6.0 mol/L,75 ℃和90 ℃下溶解過程中芯塊表面積變化曲線如圖1所示。可以看出:隨溶解過程中固體芯塊質量逐漸減小,芯塊表面積先顯著增大后變小;表面積最大值約為其初始值的10倍。不同溫度下溶解的芯塊表面積隨芯塊質量變化趨勢基本相同,未溶解芯塊質量約為初始質量的60%,剩余芯塊表面積達最大;不同溫度下,表面積增長倍數略有差異,90 ℃下溶解的芯塊最大表面積略高。
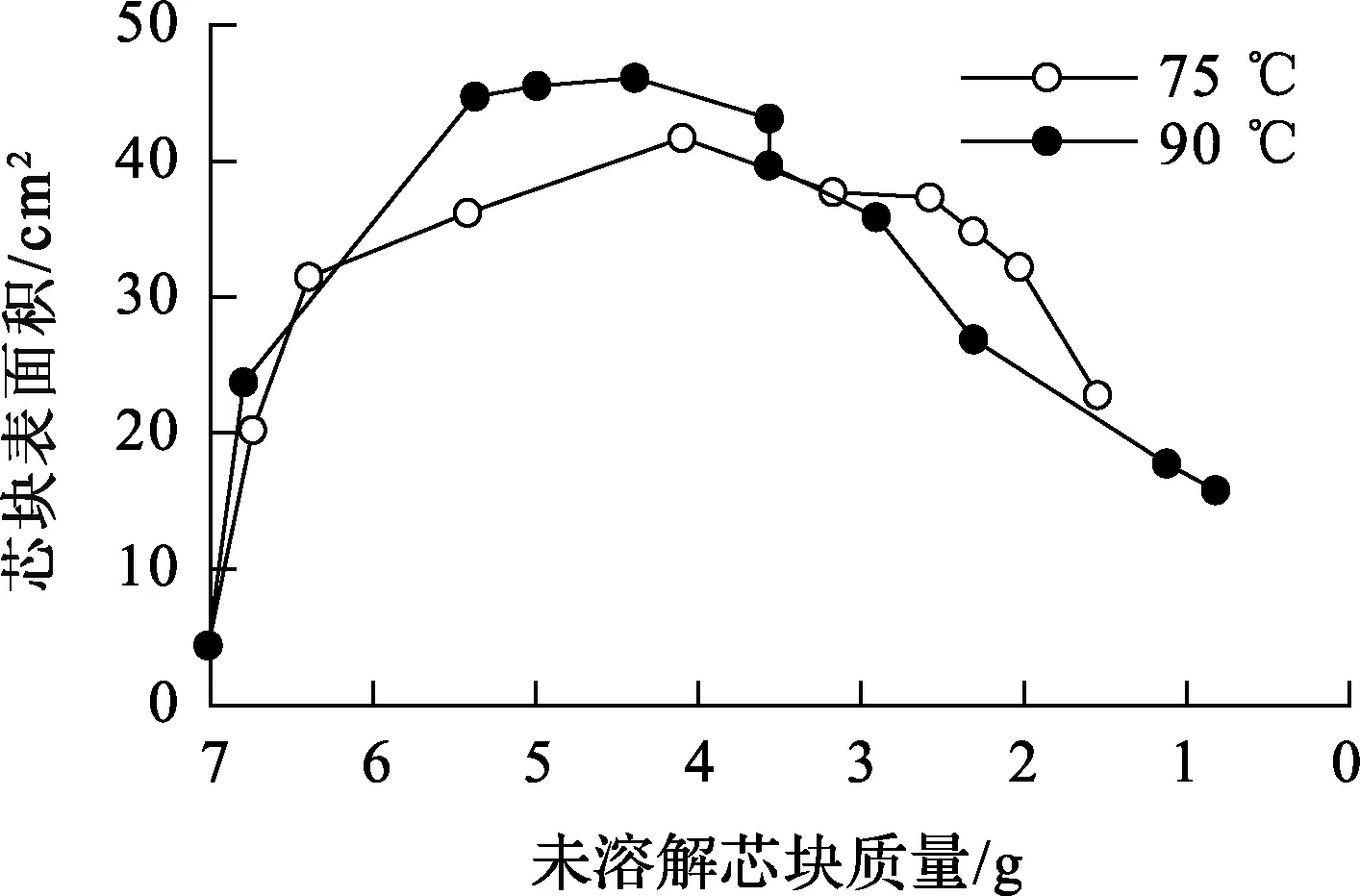
圖1 溶解過程中芯塊表面積變化曲線
在求取速率方程時分別取對應溫度下的表面積曲線進行計算,溫度低于75 ℃時,芯塊溶解較少,芯塊表面積變化不大。故采用75 ℃條件下的表面積曲線進行計算。
2.2 酸度對芯塊溶解速率的影響
在溫度90 ℃、初始酸度分別為6.0 mol/L和4.5 mol/L條件下,所得溶解液中鈾質量濃度隨反應時間的變化曲線如圖2所示。
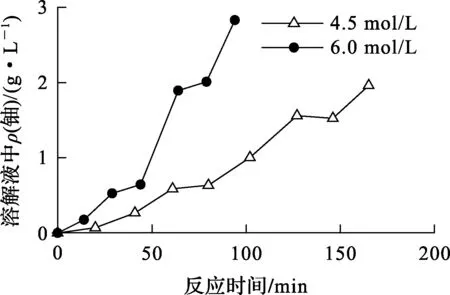
圖2 不同酸度條件下的溶解曲線
根據圖2計算取樣時間下單位面積的溶解速率。計算過程如下:1)利用圖2中鈾質量濃度-反應時間曲線,計算溶解速度-反應時間曲線,即對圖2中數據進行平滑處理,采用3次多項式進行擬合,然后對擬合數據求導函數,再利用導函數求對應時間下的反應速率;2)利用圖1數據求對應質量條件下的表面積,即對圖中數據采用線性插值法求得對應質量條件下的表面積;3)以t時刻下的反應速率除以該時刻對應芯塊表面積求得單位面積溶解速率。計算結果見表1、2。可以看出,不同酸度條件下,芯塊溶解速率變化趨勢基本相同:初始階段,芯塊的單位面積溶解速率較小且隨溶解進行逐漸增大,之后達到穩定的溶解階段。這2個溶解階段與文獻[11-12]得出的反應前期的誘導期比較符合。試驗條件下溫度保持恒定,而且反應過程中酸用量大大過量,所以可認為整個反應過程中硝酸濃度為定值,故單位面積的表觀速率方程可簡化為:
θ=Ka[H+]n。
(2)
式中:θ—單位面積溶解速率,g/(min·cm2);Ka—表觀速率常數,g/((min·cm2)·(mol/L)n);[H+]—溶液中H+濃度,mol/L;n—硝酸反應級數。
UO2芯塊在硝酸溶液中的溶解過程分為誘導期和快速反應期。試驗數據也表明,芯塊在反應初期溶解速率略小之后趨于穩定。故在計算硝酸反應級數時,依據反應速率大小將反應分為誘導期和快速反應期來分別求取各反應階段的單位面積反應速率。將表1、2中的平均單位面積反應速率代入式(3),利用平均反應速率求反應級數。計算得到誘導期反應級數n1=2.61,快速反應期反應級數n2=2.62。
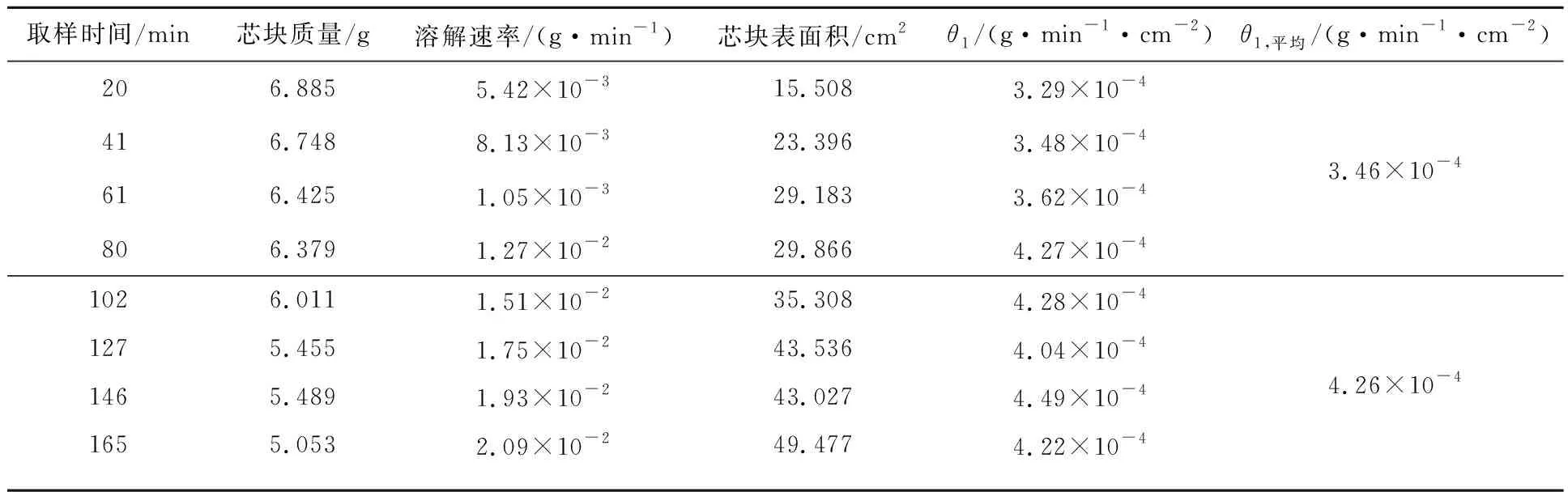
表1 硝酸濃度為4.5 mol/L條件下,芯塊的溶解速率及相對應表面積
(3)
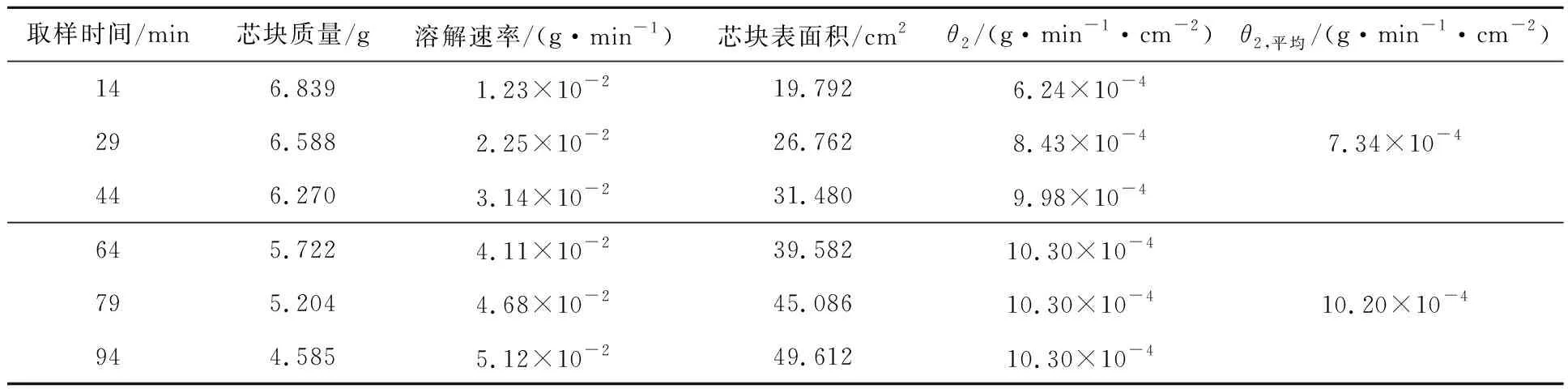
表2 硝酸濃度為6.0 mol/L條件下,芯塊溶解速率及相對應表面積
2.3 溫度對芯塊溶解速率的影響
起始酸度相同,不同溫度下芯塊的溶解速率試驗結果如圖3所示。可以看出,溫度對溶解速率有顯著影響,溫度升高反應速率顯著加快。根據圖3,利用2.2節中單位面積溶解速率計算方法,計算不同溫度下反應誘導期與穩定期的單位面積溶解速率,并根據式(2)計算反應速率常數,其中[H+]=6.0 mol/L,n=2.6。計算得到不同溫度下誘導期表觀反應速率常數K1和快速反應期表觀反應速率常數K2,結果見表3。

表3 不同溫度條件下的表觀速率常數
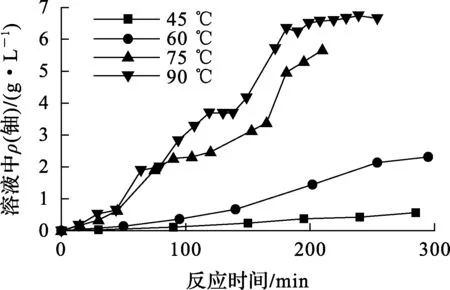
圖3 不同溫度下芯塊的溶解速率
阿倫尼烏斯方程為
式中:K—反應速率常數;A—指前因子,單位與K相同;R—氣體常數,8.314 J/(mol·K);T—熱力學溫度,K。根據阿倫尼烏斯方程得到表觀速率常數隨溫度的變化曲線,如圖4所示。根據圖4可求出誘導期活化能為49.75 kJ/mol,快速反應期活化能為33.29 kJ/mol。
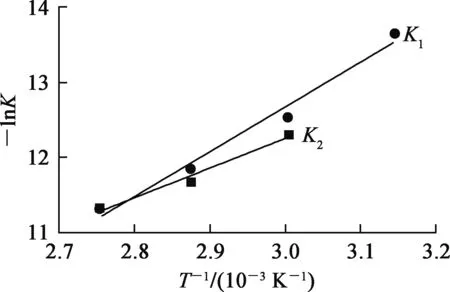
圖4 表觀速率常數隨溫度的變化曲線
3 結論
定量測定UO2芯塊在溶解過程中表面積的變化,根據表面積的變化可以計算出UO2芯塊在硝酸溶液中溶解時單位面積的溶解速率。反應溫度與溶液酸度對溶解反應有影響,且影響表觀動力學方程。芯塊溶解在經歷誘導期后進入快速反應期,誘導期及快速反應期的硝酸反應級數均為2.6級,活化能分別為49.75、33.29 kJ/mol。

