用堿性樹脂從硝酸銀溶液中吸附銅的反應動力學
于 凱,艾崢嶸,寧志強,胡 偉,謝宏偉
(1.東北大學 冶金學院,遼寧 沈陽 110819;2.東北大學 材料科學與工程學院,遼寧 沈陽 110819;3.東北大學 材料各向異性與織構教育部重點實驗室,遼寧 沈陽 110819)
在電解法提純銀工藝[1-2]中,為增強電解液導電性、改善濃差極化,需要嚴格控制硝酸銀電解液中Cu2+濃度。Cu2+濃度過高會使其在陰極夾雜析出,影響產品純度。目前,從銀電解液中去除銅一般采用熱分解法、置換法、離子交換法、NaCl沉淀法[3-6]等。離子交換法用離子交換樹脂作載體,通過嵌于樹脂表面及內部的活性官能團對不同種類離子進行選擇性交換。離子交換樹脂因具有高選擇性、耐酸堿性及可再生等特性,在濕法冶金、污染治理、反應催化、純化處理等方面得到廣泛應用[7-11]。按照樹脂中交換基團的堿性劃分,陰離子交換樹脂可分為強堿性和弱堿性兩種[12]。堿性陰離子交換樹脂通過表面配合作用,可用于選擇性去除溶液中的微量重金屬[3,13-22],對電解液進行凈化除雜[3,15]。
試驗選擇兩種堿性的陰離子交換樹脂(D201、D301),采用離子交換法從硝酸銀溶液中凈化去除Cu2+,探討兩種樹脂對Cu2+的吸附動力學、靜態吸附性能,旨在為陰離子交換法在硝酸銀溶液提純處理中的應用提供理論指導。
1 試驗部分
1.1 試驗儀器、原料及試劑
TAS-900型原子吸收分光光度計(上海普析分析儀器有限公司),自制離子交換柱(L=50 mm、φ=30 mm),FA2204B型電子天平(杭平有限公司),LHZW001型微型蠕動泵(聯合眾為科技公司),HY-2型調速多用振蕩器(常州榮華儀器制造有限公司)。
D201、D301樹脂,苯乙烯系,粒度0.400~0.700 mm, 浙江爭光實業股份有限公司產品,性能指標見表1。

表1 D201、D301樹脂的性能指標
三水合硝酸銅,硝酸銀,氫氧化鈉溶液,硝酸溶液,均為分析純。
溶液均用去離子水配制,Cu2+質量濃度1 000 mg/L,NaOH溶液、HNO3溶液質量濃度50 g/L,HNO3溶液質量濃度100 g/L。
1.2 試驗方法
試驗中,除樹脂不同外,其他條件均相同。以下試驗過程以D201樹脂為例。
1.2.1 樹脂的預處理
首先將樹脂在去離子水中浸泡1 h,然后用去離子水清洗3~5次,去除有機物雜質;隨后用5%NaOH溶液浸泡12 h,用去離子水洗至中性;最后用5%的HNO3溶液浸泡12 h,再用去離子水洗至中性。
1.2.2 吸附等溫線
用天平準確稱取1 g經預處理并且吸干表面水分的樹脂,放置于250 mL分液漏斗中;分別移取200 mL不同Cu2+質量濃度的硝酸銀溶液于分液漏斗中,蓋好瓶塞,放置于振蕩床上,25 ℃下振蕩12 h,靜置一段時間后取樣,以FAAS(火焰原子吸收)法測定溶液中Cu2+質量濃度。
1.2.3 吸附動力學
用天平準確稱取1 g經預處理且吸干表面水分的樹脂,放置于250 mL分液漏斗中,移取200 mL Cu2+質量濃度60 mg/L的硝酸銀溶液于分液漏斗中,蓋好瓶塞,放置于振蕩床上,在25 ℃下振蕩12 h,每隔一段時間取樣5 mL,以FAAS法測定溶液中Cu2+質量濃度。
1.2.4 溶液流量對吸附過程的影響
取一定量預處理后的樹脂于離子交換柱內,移取250 mL Cu2+質量濃度60 mg/L的硝酸銀溶液于分液漏斗中,利用蠕動泵使溶液分別以不同速度經過樹脂層,在25 ℃下吸附6 h,靜置一段時間后取樣,以FAAS法測定溶液中Cu2+質量濃度。
2 試驗結果與討論
2.1 樹脂的吸附選擇性
在室溫下,用D201、D301樹脂分別對4組硝酸銀溶液中的Cu2+、Ag+進行吸附。吸附前、后硝酸銀溶液中Cu2+、Ag+質量濃度變化見表2。

表2 吸附前、后硝酸銀溶液中Cu2+、Ag+質量濃度變化 mg/L
由表2看出:室溫條件下,D201、D301樹脂對Ag+幾乎不吸附,對Cu2+有一定吸附;D301樹脂對Cu2+的吸附效果更好,最高吸附率可達33.3%。
2.2 吸附等溫線
在一定溫度下,分離物質在固液兩相中的濃度關系可用吸附方程式來表示。Langmuir等溫吸附方程主要是從動力學角度反映單分子層吸附模型。方程式[13]為
(1)
Freundlich等溫吸附方程主要反映多分子層吸附特點。方程式[18]為
(2)
式中:ρe—平衡質量濃度,mg/L;qe—平衡吸附量,mg/g;q0—樹脂交換容量,mg/g;b—吸附平衡常數,L/mg;kF—經驗常數,L/g;n—吸附反應強度[23]。


表3 等溫線模型擬合數據
2.3 吸附平衡時間
在室溫條件下,用D201、D301樹脂從硝酸銀溶液中吸附Cu2+,吸附率隨時間的變化曲線如圖1所示。
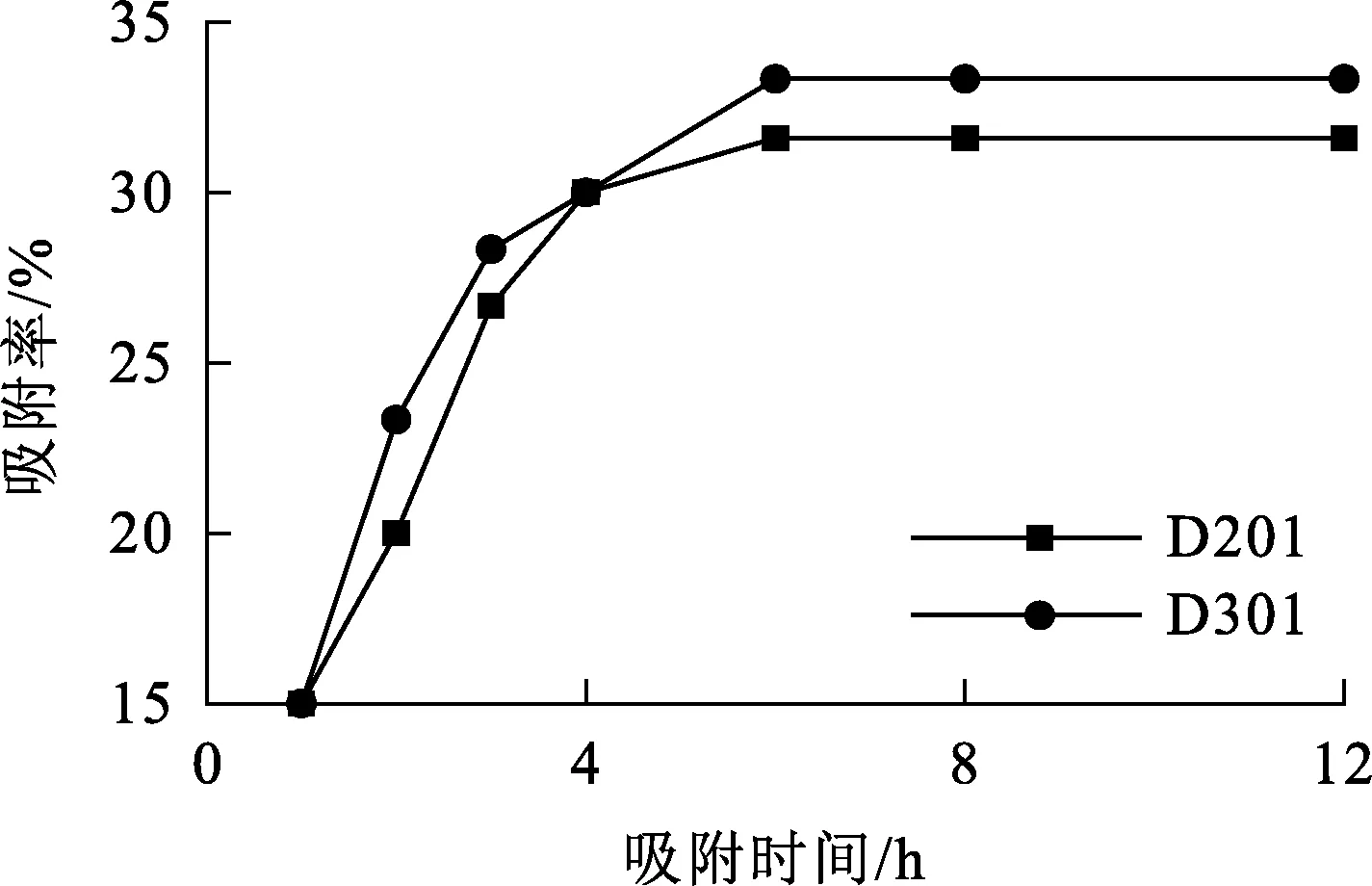
圖1 樹脂對Cu2+吸附率隨時間的變化曲線
由圖1看出:在0~6 h內,隨吸附進行,樹脂吸附量逐漸增大;6 h后,固液相達到平衡,吸附量不再變化。故2種樹脂對Cu2+的吸附過程達到平衡狀態均需6 h。
2.4 吸附過程控制步驟
離子交換樹脂吸附金屬離子的過程可分3步[14]:1)金屬離子由溶液經液膜擴散到樹脂表面;2)金屬離子由樹脂表面向樹脂內部擴散;3)金屬離子在樹脂內活性基位置發生表面配合反應。故離子交換過程由液膜擴散、顆粒擴散和化學反應3個步驟控制,其中速度最慢的步驟控制著整個反應速度。
膜擴散反應控制方程為
ln(1-F)=-kt,
(3)
顆粒擴散反應控制方程為
(4)
化學反應控制方程為
(5)

將圖1中各時刻溶液中Cu2+質量濃度分別代入方程(3)~(5)中進行擬合,擬合曲線如圖2所示。

a—膜擴散反應控制;b—顆粒擴散反應控制;c—化學反應控制圖2 不同模型的線性擬合曲線
由圖2看出:在室溫條件下,D201樹脂對Cu2+的吸附過程中,1-(1-F)1/3-t的線性關系最好,故化學反應是主要速度控制步驟;D301樹脂對Cu2+的吸附過程中,-ln(1-F)-t的線性關系最好,故膜擴散反應是主要速度控制步驟。
2.5 吸附過程的反應級數
離子交換樹脂吸附金屬離子的反應一般遵循一級反應、假二級反應或二級反應[24]。
一級反應公式為
(6)
假二級反應公式為
(7)
二級反應公式為
(8)
式中:qe—平衡吸附量,mg/g;qt—吸附t時間時吸附量,mg/g;k1—一級反應速率常數;k′—假二級反應速率常數;k—二級反應速率常數。
將圖1中不同吸附時間條件下溶液中Cu2+質量濃度分別代式(6)~(8)中進行擬合,結果如圖3所示。可以看出,2種樹脂對Cu2+的吸附過程中,都是t/qt-t線性關系最好,說明吸附過程近似于假二級反應。

a—一級反應;b—假二級反應;c—二級反應。圖3 不同反應的線性擬合曲線
2.6 溶液流量對吸附率的影響
室溫條件下,硝酸銀溶液流量不同,樹脂對Cu2+的吸附率與溶液流量之間的關系如圖4所示。

圖4 樹脂對Cu2+的吸附率與溶液流量之間的關系
由圖4看出:2種樹脂對Cu2+的吸附率均與溶液流量成反比;D301樹脂的動態吸附率高于D201樹脂的吸附率。這可能是D301樹脂的吸附過程主要受膜擴散控制,更易受流量影響所致。
3 結論
在室溫條件下,研究了用D201、D301堿性樹脂從硝酸銀溶液中凈化除Cu2+。結果表明:
1)2種堿性樹脂均對溶液中的Cu2+有選擇性吸附作用,D301樹脂吸附效果好于D201樹脂,最高吸附率達33.3%。
2)2種堿性樹脂吸附達平衡所需時間均為6 h, 且吸附率均與溶液流量成反比。
3)D201樹脂對Cu2+的吸附過程符合Freundlich吸附模型,為多分子層吸附;吸附過程近似于假二級反應;吸附過程主要受化學反應控制。
4)D301樹脂對溶液中Cu2+的吸附符合Langmuir吸附模型,為單分子層吸附;吸附過程近似于假二級反應;吸附過程主要受膜擴散控制。

