高中化學有效教學策略的探討
———以氧化還原反應教學為例
◇ 黃彩菊
高中化學涉及的知識點較多,不僅需要牢固記憶,更要深入理解,才能實現靈活應用.為實現這一目標,教師應尋找相關教學策略,既要引導學生夯實基礎,又要啟發學生透過現象看本質,促進學生化學學習成績的進一步提升.
1 講解概念,深挖知識內涵
氧化還原反應是高中化學最為基礎的概念,做好該概念的教學,對學生以后高中化學知識的學習具有重要的促進作用.教師可圍繞這一概念,做好充分的教學準備,使學生更好地掌握氧化還原反應本質.1)引導學生回顧所學,形成對氧化還原反應概念的初步認識.授課中從初中已學的C還原CuO的反應切入,復習氧化反應知識.同時,引導學生分析C與CuO反應后的生成物,建立氧化反應與還原反應同時進行的初步認識.2)巧妙點撥,鼓勵學生總結氧化還原反應特點.課堂上通過展示常見化學反應,要求學生分析物質反應前后化合價的變化情況,從化合價角度入手總結氧化還原反應特點.
元素化合價升降是氧化還原反應的宏觀表現,那么造成元素化合價變化的真正原因是什么,在授課中教師要引導學生,使其對氧化還原反應這一概念進行深挖.1)借助多媒體技術展示元素最外層電子數的改變給元素化合價帶來的影響.授課中制作多媒體課件,向學生展示原子內部結構,并在課堂上為學生演示原子得到電子、失去電子后化合價的變化情況.通過多媒體課件,學生可清晰地看到原子得到電子后化合價降低了,得到幾個電子化合價就變為負幾價,失去電子情況剛好相反.如此幫助學生建立電子得失與化合價升降之間的內在聯系.2)結合實例剖析電子與氧化還原反應的關系.授課中要求學生重新回到氧化還原反應這一概念,根據從多媒體演示中獲得的啟發,展示兩個具有代表性的化學反應:鈉與氯氣反應生成氯化鈉;氯氣與氫氣反應生成氯化氫.兩個反應都伴隨著化合價變化,顯然都屬于氧化還原反應,課堂上引導學生思考兩個反應中原子內部電子的行為是否相同,鼓勵學生在課堂上相互討論,并播放相關的視頻短片輔助學生理解,使其深刻認識到氧化還原反應中不僅包含電子的得失,還包括電子的偏移.按照上述教學方法,為學生講解氧化劑、還原劑等概念,就變得順理成章了.
2 注重訓練,提高運用能力
高中化學教學中理解氧化還原反應是基本的要求.為進一步提高學生能力,還應通過訓練提高其運用所學分析化學問題的靈活性.這就需要對學生進行針對性的訓練,使其更好地掌握氧化還原反應規律以及相關的計算技巧.教學中可給出以下習題對學生進行訓練,并給予適當的點撥,使學生能夠順利解答.
例1①Pb3O4與HNO3溶液反應的離子方程式:Pb3O4+4H+=PbO2+2Pb2++2H2O;
②PbO2和酸化的MnSO4溶液反應的離子方程式:5PbO2+2Mn2++4H++5SO2-4=2MnO-4+5PbSO4+2H2O.下列說法正確的是( ).
A.反應①中Pb3O4中顯+2價和+4價的Pb的物質的量之比為2∶1
B.分析可知氧化性:HNO3>PbO2>MnO-4
C.Pb能與稀硝酸發生反應:3Pb+16HNO3=3Pb(NO3)4+4NO↑+8H2O
D.Pb3O4和鹽酸發生反應:Pb3O4+8HCl=3PbCl2+4H2O+Cl2↑
分析該題考查氧化還原反應以及氧化性強弱的判斷知識.反應①不是氧化還原反應,根據反應前后化合價關系可知選項A正確.因其不是氧化還原反應,自然不能判斷出HNO3的氧化性強于PbO2,選項B、C錯誤.根據反應②可知PbO2的氧化性強于MnO-4,在含有酸的情況下,MnO-4可將HCl氧化成Cl2,因此,+4價的Pb也能將HCl氧化成Cl2,由氧化還原反應知識可知選項D正確.
例2將適量氯氣通入含有Fe2+、I-、Br-的溶液中.溶液中離子的物質的量變化情況如圖1所示,則下列表述錯誤的是( ).
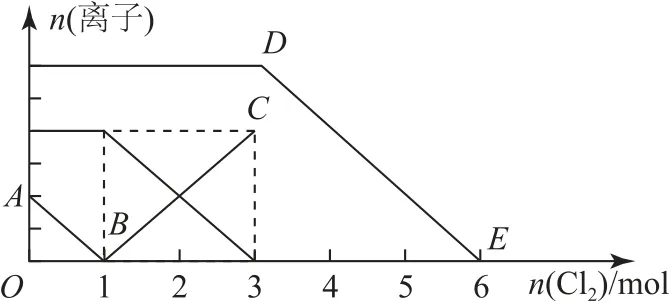
圖1
A.線段BC表示的是Fe3+物質的量的變化情況
B.原混合液中c(FeBr2)=6mol·L-1
C.Cl2通入的量為2 mol時,溶液中發生的離子反應為2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
分析該題目將氧化還原反應知識、圖象、定量計算融合在一起,能很好地考查學生綜合運用所學知識的能力.解答該題目的關鍵在于熟練掌握Fe2+、I-、Br-3種離子的還原性強弱,并能讀懂圖1中的內容.根據所學氧化還原反應知識可知3種離子還原性強弱順序為:I->Fe2+>Br-,由圖1可知AB、BC、DE分別表示I-、Fe3+、Br-物質的量變化,選項A正確.因題干未告知溶液體積,物質的濃度是無法計算的,選項B錯誤.根據發生的氧化還原反應可知,選項C正確.另外,結合圖1中消耗氯氣的量,不難推斷出原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3,選項D正確.答案為B.
3 做好延伸,拓寬學生視野
在氧化還原反應教學中,相關習題常常是給出具體的化學反應方程式要求學生分析解答,難度中等.為提高學生的綜合能力,還應做好教學的延伸.課堂上可圍繞以下習題,與學生一起分析解題思路,深化其所學的同時,給學生解答相關習題帶來良好啟發.
例3在一定條件下,Cl2和KOH溶液發生如下反應:Cl2+KOH→KX+KY,而在一定條件下KX能自身發生反應KX→KY+KZ(其中KY和KZ的關系比為1∶3).已知KX、KY、KZ均是一元酸的鉀鹽,則KX中氯元素的化合價為( ).
A.+1 B.+3 C.+5 D.+7
分析該題目是對還原反應中化合價規律的考查,因未完整給出化學反應方程式,難度較大.需要學生具備較強的分析能力,從已知條件中找到解題突破口.解題中應能看出兩個反應均是歧化反應,由此引導學生先確定KY是何種物質,顯然根據經驗以及所學可知KY為KCl,由此不難推出Z中Cl元素顯示的正價大于X中Cl元素顯示的正價.同時,引導學生可采用假設法尋找化合價之間的關系,即,假設KX中Cl元素顯+a價,KZ中Cl元素顯+b價.由已知條件以及化合價原理可得到關系式a+1=3(b-a),而后將a=1、3、5分別代入討論,發現只有a=5,b=7時滿足題意,因此正確選項為C.
綜上所述,為達到良好的課堂教學目標,教學中應積極總結以往教學經驗,尋找高效的教學策略,尤其應做好氧化還原反應概念教學,使學生深刻理解氧化還原反應概念內涵,而后通過優秀習題的訓練以及教學拓展,提高學生靈活應用所學解答化學問題的能力,為后續化學知識的學習奠定堅實基礎.

