復發性椎動脈夾層1例并文獻回顧
周宏星,黎凱鋒,黃靜,黎杰,張亮,賀雄軍,劉亞杰
1 病例介紹
1.1 首次發病 患者男性,29歲,因“突發頭痛2天”于2018年12月27日到南方醫科大學深圳醫院就診。患者于入院2 d前休息時無明顯誘因突發頭痛,右側枕部為主,呈持續性脹痛,陣發性加重,嚴重時自覺難以忍受。本院門診頭顱CT提示:右側小腦半球大片狀低密度影,擬“頭痛原因待查”收入院。
既往史:否認“高血壓、糖尿病、冠心病”等慢性病史。
入院查體:脈搏69次/分,血壓126/83 mm Hg。神志清楚,對答切題,雙側瞳孔等大等圓,直徑3.0 mm,對光反射靈敏,眼球活動正常,未見眼震,雙側額紋、鼻唇溝對稱,伸舌居中。四肢肌張力、肌力正常,雙側腱反射(++),病理征未引出,雙側指鼻試驗、跟膝脛試驗穩準,腦膜刺激征陰性。
實驗室檢查:同型半胱氨酸30.61 μmol/L,總膽紅素33.30 μmol/L,直接膽紅素5.50 μmol/L,間接膽紅素27.80 μmol/L。尿常規:尿膽原(+),尿酮體弱陽性(±)。血常規、大便常規、糖化血紅蛋白、電解質、腎功能、凝血功能、血脂正常。
心電圖、心臟彩超均正常。肝膽脾胰彩超:脾臟稍大。
頭顱MRI平掃+增強(2018-12-27):右側小腦半球、中腦右側、右枕葉缺血性改變,考慮血管源性病變,頭顱MRA、椎-基底動脈平行解剖磁共振成像(basi-parallel anatomical scanning,BPAS)未見異常。
頭頸部CTA(2018-12-27):右側大腦前動脈A1較對側纖細;右椎動脈V3段管腔重度狹窄(圖1A)。
診療經過:根據影像檢查考慮腦梗死,住院后給予抗血小板治療(阿司匹林100 mg/d、氯吡格雷75 mg/d),阿托伐他汀降脂,甘露醇脫水,以及止痛等對癥治療。進一步完善椎動脈MRI(2018-12-29):MRA示右椎動脈V3段管腔重度狹窄70%~80%(圖1B~C),HR-MRI黑血序列示管壁明顯增厚,管壁高信號考慮壁間血腫(圖1D),增強掃描管壁明顯強化。根據HR-MRI檢查考慮動脈夾層,予停用抗血小板治療,改用抗凝治療(達比加群110 mg,每日2次),住院1周后患者頭痛好轉出院。
出院診斷:

隨訪:出院后規律使用口服抗凝藥物。3個月后復查椎動脈MRI(2019-03-24):頸部MRA結合HR-MRI黑血序列示右椎動脈V3段原管腔狹窄明顯緩解(圖2)。6個月后復查椎動脈MRI(2019-06-30):右椎動脈V3段管腔正常。
1.2 夾層復發 首次發病16個月后,患者因“反復頭痛”于2020年4月26日再次入院。患者入院前5 d因右肩部疼痛在當地醫院行理療后出現頭痛,以枕部為主,呈緊縮性疼痛,偶有搏動脹痛感,伴輕微頭暈,持續5~6 h后自行緩解。本院門診查頭頸部MRA提示:右側椎動脈V2段節段性變細,管腔重度狹窄(圖3A),右側椎動脈V2段橫斷面血管雙腔征(圖3B)。
入院神經系統查體無明顯陽性體征。全腦DSA提示右側椎動脈V2段節段性管腔變細,前向血流正常(圖3C)。患者出現右側椎動脈夾層復發,但此次無缺血性腦血管事件,表現為單純性頭痛,且夾層部位前向血流正常,無介入手術指征,給予抗凝(達比加群110 mg,每日2次)等藥物治療,患者頭痛好轉出院,門診隨診。
最終診斷:
右側椎動脈V2段夾層并管腔重度狹窄
2 討論
頸部動脈夾層所致缺血性卒中的發生率低,卻是青年卒中的重要原因,占青年卒中的8%~25%[1-2]。頸部動脈夾層的病因分為自發性和創傷性,自發性夾層常見于患有纖維肌發育不良、常染色體顯性多囊腎、先天性結締組織病(如馬方綜合征)等疾病的患者[3]。嚴重外傷或輕度機械刺激也可導致頸部動脈夾層,據報道超過40%的頸部動脈夾層與輕度機械刺激有關[4],比如頸部推拿按摩、球類運動、跳舞,甚至是打噴嚏都有可能引發動脈夾層。本例患者第一次動脈夾層無明確誘因,可能屬于自發性夾層,第二次夾層有明確的頸部理療誘因,屬于創傷性夾層。但也有觀點認為自發性夾層大多數是由那些被患者遺忘或認為不重要的輕微外傷所致。
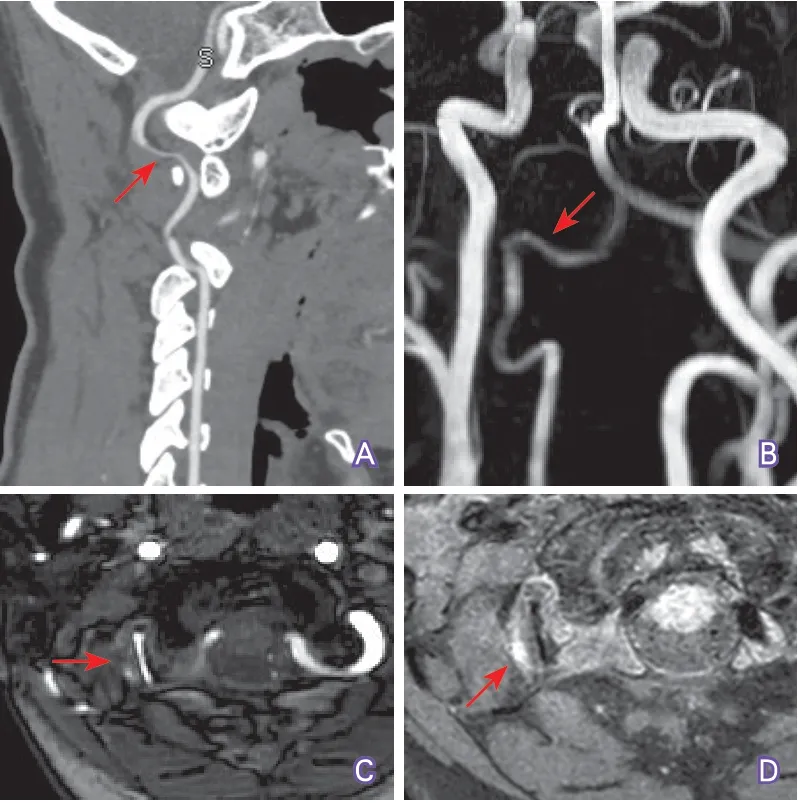
圖1 首次發病時椎動脈血管成像
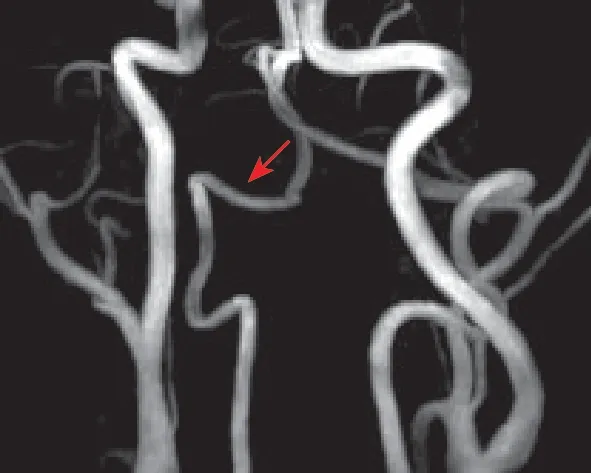
圖2 發病3個月后MRA圖像

圖3 夾層復發后的頭頸部MRA和DSA圖像
椎動脈夾層臨床上主要表現為頸部疼痛、頭痛、后循環腦梗死。本例患者兩次椎動脈夾層發病均表現為單純性頭痛,如果詢問病史時忽視頸部理療的誘因,則容易誤診為緊張性頭痛,尤其在該患者第二次發生椎動脈夾層后。因此,對于存在頭痛、頸部疼痛,同時有頸部機械外力損傷病史的患者,則首先考慮排查動脈夾層。這時需進一步影像學檢查明確夾層的診斷,最具有診斷意義的影像學特征是DSA、MRA、CTA上內膜瓣或雙腔征[5]。此外,以下典型影像學征象也具有診斷價值:①DSA上存在非特異性夾層征象,如串珠樣、錐形閉塞(火焰征);②MRA上可見與DSA一致的串珠樣、線樣征、錐形閉塞;③T1WI顯示壁間血腫。符合以上三個影像學特征中其中一個,并且隨訪發現明確的血管變化,也可診斷動脈夾層[6]。本例患者首次椎動脈夾層影像學特征是HR-MRI黑血序列上存在壁間血腫,多次隨訪復查MRI提示血管腔逐漸恢復正常。第二次椎動脈夾層的診斷主要依靠MRA上的雙腔征和DSA長節段管腔變細,且患者起病前有頸部理療史,診斷夾層明確。DSA是診斷腦血管病的金標準,但無法直接觀察到血管壁病變,高度懷疑動脈夾層的病例,CTA或HR-MRI能補充更多的診斷夾層的征象,如雙腔征、壁間血腫,在血管壁病變評估方面較DSA更有優勢。
頸部動脈夾層復發率較低[7],一項對432例頸部動脈夾層患者進行31個月的隨訪研究中,僅有4例患者出現夾層復發,其中2例夾層復發導致缺血性卒中[8],這也提示頸部動脈夾層相關的卒中再發風險較低。頸部動脈夾層復發的位置多數不在原先病變的血管,一項研究對103例連續性的夾層病例進行為期4年的跟蹤隨訪,發現5例患者出現頸部動脈夾層復發,其中有4例患者動脈夾層復發出現在另外一側頸部動脈[9]。本例患者所不同的是,先后兩次夾層均在同一側椎動脈,分別是V3段和V2段。大多數頸部動脈夾層的患者沒有傳統的腦血管病危險因素,夾層發生和復發的危險因素尚不清楚[10]。相對來說,自發性頸部動脈夾層更容易復發,其血管本身可能有一定的遺傳因素及容易產生夾層病變的基礎。Ohta等[11]報道1例雙側頸內動脈自發性夾層的卒中患者,發病12年后在上呼吸道感染后復發雙側頸動脈夾層,該報道認為患者可能存在彈性纖維異常的疾病基礎,感染只是可能起到觸發夾層的作用。但是,Kloss等[12]對282例頸動脈夾層患者進行平均52個月的隨訪,17例(7.1%)在1個月以后夾層復發,該研究還對其中108例(45.4%)患者的真皮結締組織形態學進行了研究,但未發現皮膚結締組織異常與復發夾層相關。
動脈夾層的治療包括夾層相關的急性缺血性卒中溶栓治療、急診血管內介入治療,以及預防卒中復發的抗栓治療。抗栓藥物主要是抗血小板聚集和抗凝藥物。動脈夾層卒中復發主要原因之一是血栓脫落引起遠端血管栓塞,理論上,抗凝治療對預防血栓形成和血栓脫落的效果會優于抗血小板治療。但是對于合并缺血性卒中的動脈夾層患者,抗凝治療可能增加出血風險,現有的臨床證據顯示抗血小板聚集和抗凝對預防夾層相關的缺血性卒中復發無明顯差異[13]。關于這兩類抗栓藥物對動脈夾層早期愈合是否有差異,動脈夾層引起的血管狹窄或夾層動脈瘤是否需常規進行手術干預,這些問題目前尚不清楚。
綜上所述,椎動脈夾層可以單純表現為頸后部頭痛,也可以表現為后循環缺血癥狀,甚至在顱內的椎動脈發生夾層動脈瘤破裂時可導致腦出血癥狀。對于有頸部按摩理療等病史的患者,MRA、CTA、DSA,尤其HR-MRI可以幫助早期診斷動脈夾層。動脈夾層復發危險因素尚不清楚,抗栓治療是預防的基礎,同時應避免各種誘發動脈夾層的機械外力因素。

點評專家:霍曉川 副主任醫師
E-mail:huoxiaochuan@126.com
工作單位:北京天壇醫院神經介入中心
主要研究方向:出血及缺血性腦血管病介入治療
專家點評:
顱外椎動脈夾層是缺血性卒中的少見病因,卻是青年卒中的常見病因,建議對年輕患者、尤其是無常見腦血管病危險因素的缺血性卒中患者進行篩查,本病例通過MRA、HR-MRI和DSA診斷夾層。對于動脈夾層的治療,應根據臨床實際情況及患者個體化選擇治療方案。在頸部動脈夾層形成的急性期,使用抗血小板或抗凝治療,通常維持3~6個月。目前,缺乏足夠的證據推薦在頸部動脈夾層患者中常規開展血管內介入治療或手術治療,如在積極藥物治療基礎上仍有缺血性事件發生,可考慮血管內介入治療或手術治療。但血管內介入治療或手術治療的有效性及安全性有待進一步研究。本病例夾層的復發容易考慮到血管本身問題,在外力作用下,再次發作。因此,應針對有夾層病史的患者,開展評估和干預頸部動脈夾層的危險因素,以減少頸部動脈夾層復發。

