急性缺血性卒中血管內治療的術式轉換和補救
朱其義,王浩,韓紅星,宮健,王賢軍
大血管閉塞性急性缺血性卒中(acute ischemic stroke,AIS)急診血管內治療作為標準治療方法已得到業內公認[1-2],無論采用哪種手術方法,達到前向血流分級mTICI 2b/3級,是公認的缺血區恢復有效灌注的標志,也是患者取得良好預后的基礎[3-6],而血流未達到mTICI 2b/3級,則認為靶血管未獲得有效開通。對于術中多次嘗試后靶血管仍然未獲得有效再通時,術者應仔細分析原因,適時改變手術方式或尋找可行的補救措施完成手術。
AIS血管內治療術式轉換是指首選取栓策略失敗時轉換為其他補救策略,這種情形常見于手術路徑迂曲、血管痙攣、硬性栓子嵌頓等原因,手術材料不能到位。補救手術多見于以下三種情況:①未取出/部分取出血栓,或未解除/部分解除閉塞;②血栓逃逸阻塞大的分支;③閉塞血管復流后觀察階段(一般指30 min內)再次不完全或完全閉塞。筆者針對使用取栓支架取栓、抽吸導管取栓、球囊/支架成形術等手術方式實施血管內治療時的操作要點、常見手術失敗的原因、術式轉換和補救方法,做簡要論述。
1 支架取栓
支架取栓是臨床研究證據最多的取栓方法之一[7-8],單純導引導管配合支架取栓手術成功率低,易出現栓子逃逸,通常推薦在球囊導引導管或中間導管配合下支架取栓[9-13]。首先應掌握取栓支架的正確使用,各種取栓支架使用方法相似,即使用取栓支架有效段后三分之二覆蓋閉塞段,停留3~5 min,使支架壁金屬絲切入血栓體,配合負壓抽吸拉出血栓[9-10]。當前兩次支架取栓效果不滿意時,應在第三次釋放取栓支架后,通過取栓輔助導管緩慢注射適量抗血小板藥物替羅非班或溶栓劑阿替普酶、尿激酶協助取栓,若仍未達到mTICI 2b/3級血流,標志著支架取栓失敗,應實施補救手術。由于支架取栓可損傷血管內膜,因此,不應無休止地重復支架取栓。總結常見支架取栓失敗的原因及處理建議如下。
(1)血栓負荷量大:大負荷量的血栓與血管壁黏合面積大,單純支架取栓往往每次僅能取出部分碎片,常見于頸內動脈末端栓塞,可改用抽吸導管配合支架取栓,抽吸導管靠近血栓負壓抽吸有助于支架拉出血栓;也可嘗試使用雙支架取栓,增強支架切入血栓的能力(圖1)。
(2)質地較硬/高韌性的血栓:該類血栓難以嵌入支架內被取出。可試用抽吸導管抽吸取栓、支架近端金屬絲鉗夾取栓或用Solitaire FR取栓支架覆蓋血栓并釋放,必要時球囊后擴,抑或釋放其他適用于狹窄的支架;支架覆蓋盡可能不用于穿支血管較多的大腦中動脈和基底動脈,以免血栓阻塞穿支血管。
(3)血栓位于大腦中動脈M1分叉處或基底動脈尖部:支架取栓時血栓在兩個分支血管擺動。可試用雙支架取栓或抽吸導管抽吸取栓(圖2)。
(4)取栓支架不能到位:較硬的血栓卡入血管,微導絲或支架釋放導管不能通過閉塞段,導致取栓支架不能到位,可改為抽吸取栓(圖3)。
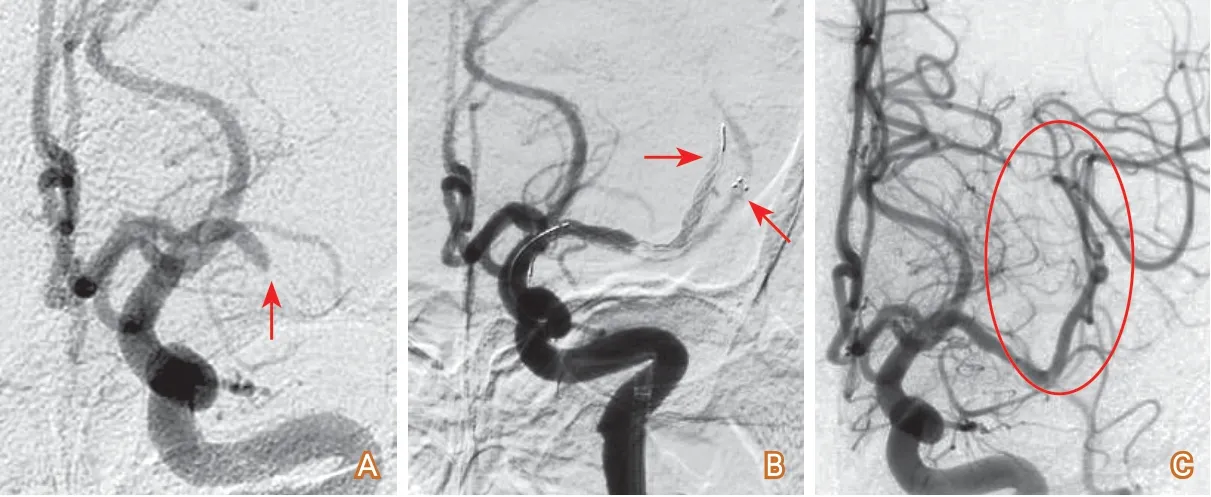
圖2 大腦中動脈M1段閉塞雙支架取栓病例
2 導管抽吸取栓
抽吸導管抽吸取栓(a direct aspiration first pass technique,ADAPT),是取栓效果不亞于支架取栓的機械取栓方法[14-16]。抽吸導管應抵近血栓體,直接連接負壓抽吸泵,采用斷續式的循環抽吸進行ADAPT操作,可以顯著增加抽吸導管抽吸進栓子的數量,增加單次操作抽通的概率,同時可以降低遠端血管栓塞的風險[17],然后持續負壓抽吸60~90 s后,緩慢回撤抽吸導管直到負壓泵連接管內血流速度恢復正常。如果血流一直沒有恢復正常,在保持負壓抽吸指引導管的同時,將抽吸導管拉出體外。抽吸3次未能達到有效開通時標志著導管抽吸失敗。常見導管抽吸取栓失敗的原因及處理建議如下。
(1)大負荷量血栓:血栓負荷量大時僅抽吸導管抽吸往往難以取出血栓,補救措施為抽吸導管輔助支架取栓,或同時輔以球囊導引導管。常見于頸內動脈末端大負荷量栓塞(圖4)。
(2)病變性質判斷錯誤:也是抽吸取栓失敗的原因之一,如動脈粥樣硬化狹窄性閉塞,此時應改用血管成形術作為補救措施。
(3)抽吸導管不能到位:見于路徑較迂曲患者,可轉換術式為抽吸導管輔助支架取栓。
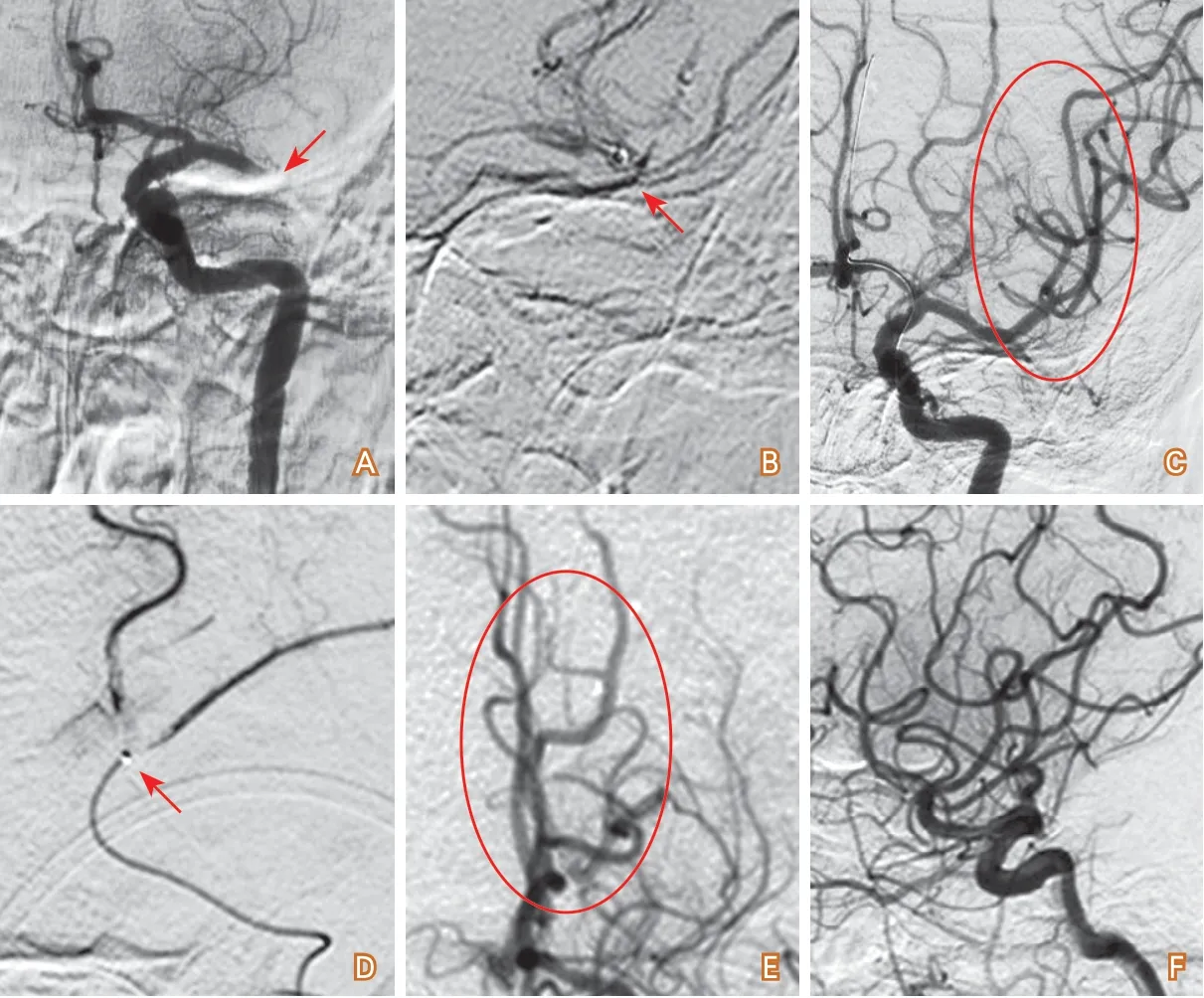
圖3 取栓支架不能到位的閉塞開通病例
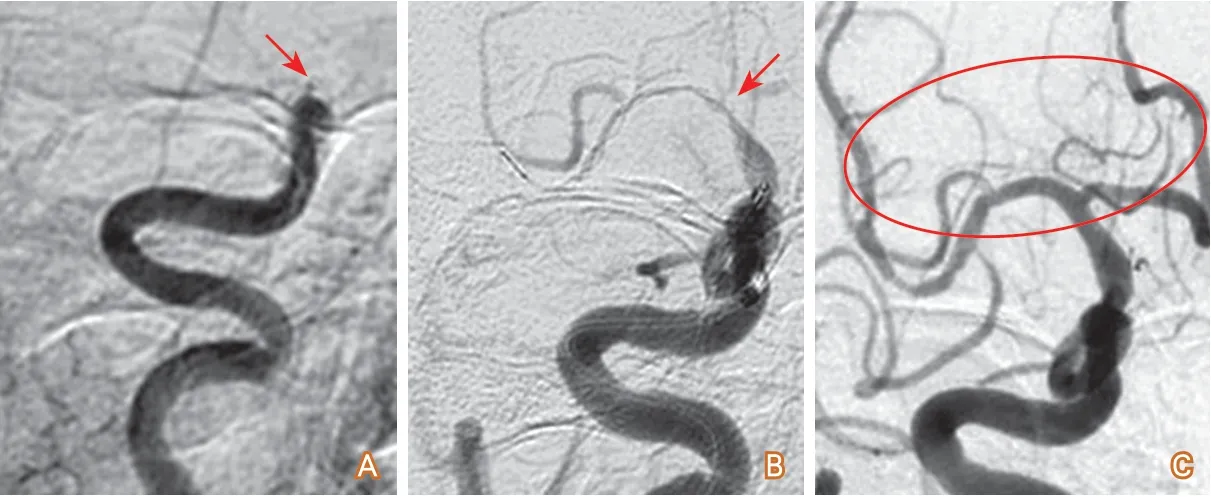
圖4 抽吸取栓失敗后改為抽吸加支架取栓開通病例
3 球囊/支架成形術開通閉塞血管
顱內動脈粥樣硬化性狹窄(intracranial atherosclerosis stenosis,ICAS)是導致AIS的重要原因之一,ICAS在亞裔人群中更為常見[18-20]。由于單純支架取栓困難大、開通率低,常選擇血管成形術、支架置入術和糖蛋白Ⅱb/Ⅲa受體拮抗劑(替羅非班)靜脈或手術通路導管內給藥作為補救措施[21]。中國多中心前瞻性血管內治療急性缺血性卒中研究(Endovascular therapy for Acute ischemic Stroke Trial,EAST)結果表明,合并顱內動脈狹窄的比例為34%,有21.4%的取栓患者需要進行補救性球囊擴張或支架成形治療,當取栓后原位狹窄>70%或狹窄影響遠端血流或導致反復再閉塞時,通過補救性球囊擴張或支架成形能夠獲得較為滿意的預后[22]。常見手術失敗原因和補救如下。
(1)球囊成形術后血管彈性回縮:動脈粥樣硬化狹窄性閉塞球囊擴張前應給予有效的抗血小板藥物,如果閉塞部位在頸內動脈或椎動脈,有合并大量血栓可能時,應給予必要的保護,如使用保護傘遠端保護或球囊導引導管近端保護;擴張后觀察血流情況,管腔回縮不能維持有效血流時,可再次球囊擴張,并適當增加擴張壓力,延長擴張時間,仍不能維持有效血流時應補救性置入支架。
(2)球囊成形術后急性血栓形成:球囊擴張后局部繼發急性血栓形成,與血管內膜撕裂和抗血小板治療不充分有關,應立即通過取栓通路導管或微導管局部注入替羅非班,如血栓量較大時可同時導管內給予溶栓藥rt-PA或尿激酶,仍未能清除血栓時可補救性支架取栓或導管抽吸取栓。
(3)支架成形術后急性血栓形成:AIS支架成形術無論在顱內還是顱外,都是血管內治療的補救手術,只有在球囊擴張后仍不能維持有效灌注時實施。急診支架成形術后不能維持有效血流,常見原因是支架內急性血栓形成,同樣與血管內膜損傷和未給予有效的抗血小板治療有關,補救措施可導管內用藥替羅非班或rt-PA、尿激酶,也可謹慎試用導管抽吸,但應避免支架移位損傷血管壁;必要時球囊后擴張促進支架與血管壁貼合。不同部位適合置入何種支架尚缺乏相關研究,為使出現意外時采用的取栓材料能通過責任閉塞血管實施再次補救,本中心的經驗是,補救性支架置入在頸內動脈起始部盡可能使用編織的自膨式支架;椎動脈起始部使用球擴支架應減少支架近端突出到鎖骨下動脈;頸內動脈和椎動脈的其他部位狹窄可選用球擴支架如Apollo支架,增大釋放壓使其與血管壁貼合緊密;大腦中動脈和基底動脈確需支架置入時,盡可能使用Solitaire、Enterprise支架,一旦支架內形成大量血栓,抗血小板藥物和溶栓藥物難以清除血栓時,能夠取出支架(Solitaire)或通過抽吸導管進入支架內抽吸。筆者之所以謹慎對待急診支架置入,是因為尚無急診顱內外支架置入獲益的有力證據,此外,并非所有的支架內血栓都易于取出,有時甚至不得不終止手術(圖5)。
對于AIS血管內治療,需要術者掌握缺血性腦血管病介入治療的綜合技術,術中的術式轉換和補救方法也是順利完成血管內治療的必備技能,有些復雜病例甚至需要多次術式轉換和補救才能順利完成手術。取栓材料的升級改進和研發已顯示出良好的血栓抓取能力和較高的閉塞開通率,期待AIS血管內治療實踐經驗的積累,催生出更優化的術式和補救方法。
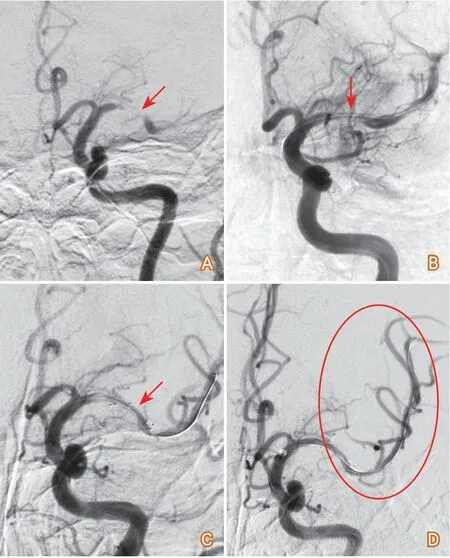
圖5 支架成形術后急性血栓形成病例

