瑞舒伐他汀與替羅非班聯合冠脈介入治療急性心肌梗死療效及對患者心功能、循環內皮祖細胞數量的影響*
陳 芳,孫黎博
1.陜西省第四人民醫院心血管內科(西安 710043);2.陜西省第四人民醫院急診科(西安 710043)
急性心肌梗死(Acute myocardial infarction,AMI)是冠狀動脈內硬化斑塊破裂或血栓形成所誘發心血管疾病,具有發病率高、致殘率高、病死率高等特征[1]。當前冠脈介入術(Percutaneous coronary intervention,PCI)是臨床治療AMI主要手段,能迅速重建冠脈血運,緩解心肌供血缺乏及相關癥狀。但臨床長期實踐發現,PCI術中擴張球囊會不同程度損傷冠狀動脈血管內皮,增加術后急性、亞急性冠脈內血栓再生及支架內再狹窄風險,影響手術效果及遠期預后[2]。目前,針對上述問題尚缺乏有效干預手段及早期監測機制,主要予以調脂、抗血小板藥物預防性治療。瑞舒伐他汀是降脂類藥物,具抗血栓、調節血脂、改善內皮功能等多重作用[3];替羅非班為高選擇性非肽類血小板糖蛋白(GP)Ⅱb/Ⅲa受體緩聚劑,具有較強抗血小板能力[4]。內皮祖細胞(Endothelial progenitor cells,EPCs)是血管內皮細胞前體細胞,多項研究顯示,存在心血管高危因素患者循環血EPCs含量降低顯著,高水平EPCs往往預示心血管疾病患者預后良好[5]。本研究首次從EPCs、心功能方面探究瑞舒伐他汀與替羅非班聯合PCI術治療AMI的效果。現報告如下。
資料與方法
1 一般資料 選取2016年8月至2019年10月我院AMI患者130例,均行PCI術,予以瑞舒伐他汀治療的65例作為對照組,予以瑞舒伐他汀與替羅非班治療的65例作為觀察組。符合AMI診斷標準[6];病例納入標準:①具備PCI術適應證;②發病至就診時間<12 h;造影證實病變血管近段無明顯扭曲;③近2周內無心肺復蘇史或重大外傷史;需置入支架1個。排除標準:伴動脈瘤、顱腦腫瘤、腦出血者;存在血液系統疾病者;肝腎功能障礙者;入組前1個月內服用他汀類藥物或可能影響本研究結果藥物者。觀察組男38例,女27例,年齡49~64歲,平均(56.48±2.66)歲;體質量指數18~25 kg/m2,平均(21.81±1.02)kg/m2;合并癥:高血壓9例,高血脂20例;犯罪血管:左前降支32例,左回旋支14例,右冠脈19例。對照組男36例,女29例,年齡50~63歲,平均(55.98±2.09)歲;體重指數18~25 kg/m2,平均(22.03±1.04)kg/m2;合并癥:高血壓13例,高血脂16例;犯罪血管:左前降支33例,左回旋支11例,右冠脈21例。兩組年齡、性別、體質量指數、合并癥、犯罪血管等基礎資料比較,差異無統計學意義(P>0.05),具有可比性。
2 治療方法 PCI術前30 min均口服拜阿司匹林(國藥準字H10960304)300 mg、氯吡格雷(國藥準字H20133212)600 mg、瑞舒伐他汀(國藥準字H20143338)20 mg、靜注肝素(國藥準字H11020963)70~100 U/kg。橈動脈穿刺行冠脈造影明確犯罪血管,根據具體情況行PCI術,術后維持雙聯抗血小板治療1年以上,拜阿司匹林100 mg/d,氯吡格雷75 mg/d。①對照組術后繼續服用瑞舒伐他汀10 mg/次,1次/晚,連用30 d。②觀察組在對照組基礎上予以替羅非班(國藥準字H20090328)泵注,PCI術前推注10 μg/kg,3 min內推注完畢,此后以0.15 μg/(kg·min)持續泵注,連用36 h,若術中發生嚴重出血即刻停止泵注。
3 觀察指標 ①對比兩組術前、術后1周心功能[左室射血分數(Left ventricular ejection fraction,LVEF)、左室舒張末期內徑(Left ventricular end-diastolic dimension,LVEDD)、左室收縮末期內徑(Left ventricular end-systolic dimension,LVESD)]。心功能檢測以超聲心動圖分析儀(西門子ACUSON Antares)測LVEF、LVEDD、LVESD,操作由相同資深影像學醫師規范完成。②對比兩組術前、術后1周血清炎癥因子[白細胞介素-6(Interleukin-6,IL-6)、腫瘤壞死因子-α(Tumor necrosis factor,TNF-α)、超敏C反應蛋白(hypersensitive C-reactive protein,hs-CRP)]水平。非抗凝真空管取晨空腹靜脈血2 ml,加溫促凝(37 ℃),離心9 min(半徑8 cm,轉速3500 r/min),取血清,以IL-6酶聯免疫吸附法試劑盒、TNF-α酶聯免疫吸附法試劑盒、hs-CRP酶聯免疫吸附法試劑盒測IL-6、TNF-α、hs-CRP水平。由資深專科檢驗醫師參考試劑盒步驟規范完成。③對比兩組術前、術后1周肱動脈內徑、循環EPCs數量。肱動脈內徑以超聲心動圖分析儀(西門子ACUSON Antares)檢測;循環EPCs數量檢測:取10 min肘靜脈血,肝素抗凝,分離外周血單核細胞(PBMN),將獲取細胞加入EGM-2培養基2 ml重懸,置細胞培養板培養7 d,用D-Hank’s清洗未貼壁細胞,加Dil標記乙酰化低密度脂蛋白溶液2.4 mg/L,孵育2 h,以多聚甲醛固定(2%);經D-Hank’s浸洗,向標本內加異硫氰酸熒光素所標記荊豆凝素10 mg/L,再次孵育1 h(37 ℃),中性甘油封片,共聚焦顯微鏡觀察染色,隨機取10個視野,計黃色熒光細胞數,即EPCs數量。④對比兩組術前、術后1周血管內皮細胞功能[血清一氧化氮(Nitric oxido,NO)、內皮素-1(Endothelin-1,ET-1)、血管性假血友病因子(von Willebrand factor,vWF)]。檢測方法:非抗凝真空管取晨空腹靜脈血2 ml,加溫促凝(37 ℃),離心9 min(半徑8 cm,轉速3500 r/min)取血清分光光度法測NO、ET-1、vWF水平。試劑盒由上海西塘生物科技有限公司提供,資深專科檢驗醫師參考試劑盒步驟規范完成。⑤隨訪1個月對比兩組生活質量(SAQ評分)。以西雅圖心絞痛量表(SAQ)評估生活質量,包括軀體活動受限程度、心絞痛穩定狀態、心絞痛發作情況、對治療的滿意度、疾病認知程度等方面,滿分100分,得分越高生活質量越好。⑥統計兩組胃腸道反應、頭暈頭痛、輕度轉氨酶升高、輕度出血等不良反應發生率。
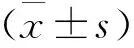
結 果
1 兩組心功能指標比較 兩組術前LVEF、LVEDD、LVESD水平相比,差異無統計學意義(P>0.05);兩組術后1周LVEF較術前提高,且觀察組高于對照組,LVEDD、LVESD水平較術前降低,且觀察組低于對照組(P<0.05)。見表1。
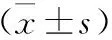
表1 兩組心功能指標比較
2 兩組血清炎癥因子指標比較 兩組術前血清IL-6、TNF-α、hs-CRP水平相比,差異無統計學意義(P>0.05);兩組術后1周血清IL-6、TNF-α、hs-CRP水平較術前下降,且觀察組低于對照組(P<0.05)。見表2。
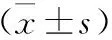
表2 兩組血清炎癥因子指標比較
3 兩組肱動脈內徑、循環EPCs數量比較 兩組術前肱動脈內徑、循環EPCs數量相比,差異無統計學意義(P>0.05);兩組術后1周肱動脈內徑、循環EPCs數量較術前提高,且觀察組高于對照組(P<0.05)。見表3。
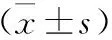
表3 兩組肱動脈內徑、循環EPCs數量比較
4 兩組血管內皮細胞功能指標比較 兩組術前血清NO、ET-1、vWF水平比較,差異無統計學意義(P>0.05);兩組術后1周血清NO較術前增高,且觀察組高于對照組,血清ET-1、vWF水平較術前降低,且觀察組低于對照組(P<0.05)。見表4。
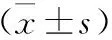
表4 兩組血管內皮細胞功能指標比較
5 兩組SAQ評分比較 兩組術前SAQ評分相比,差異無統計學意義(P>0.05);經隨訪,無脫落病例,兩組術后1個月SAQ評分較術前增高,且觀察組高于對照組(P<0.05)。見表5。

表5 兩組SAQ評分比較(分)
6 兩組不良反應比較 兩組不良反應發生率相比,差異無統計學意義(P>0.05),見表6。

表6 兩組不良反應比較[例(%)]
討 論
PCI術是AMI主要治療手段,但部分患者PCI術后出現再狹窄,增加治療難度,臨床研究發現,其主要原因是血管內皮損害修復不良[7]。因此,近年開始強調高危AMI患者行PCI術的同時應用血管保護、抗凝類藥物治療。
瑞舒伐他汀是一種強效調脂藥物,能通過抑制羥甲基戊二酰輔酶(HMG-CoA)活性,降低肝臟膽固醇生成,發揮降脂,穩定動脈粥樣硬化作用[8]。研究結果顯示,AMI患者早期應用瑞舒伐他汀可顯著改善PCI術前血管條件,但對終點事件無顯著影響[9]。替羅非班為血小板糖蛋白(GP)Ⅱb/Ⅲa受體緩聚劑,通過抑制纖維蛋白原結合(GP)Ⅱb/Ⅲa受體可阻斷血小板的最后聚集通路,能更完全、更徹底阻止血小板血栓形成,利于改善缺血組織灌注及心功能[10]。本研究在PCI術中聯合瑞舒伐他汀與替羅非班治療,結果顯示,術后1周觀察組LVEF水平高于對照組,LVEDD、LVESD水平低于對照組(P<0.05),與學者程云濤等[11]研究結果近似。此外,本研究結果還顯示,術后1周觀察組肱動脈內徑高于對照組(P<0.05)。肱動脈內徑可于一定程度上反映血管健康狀態,相關研究表明,肱動脈內徑縮小與動脈硬度增加關系密切,其通常預示心血管疾病高發病率、病死率,較大肱動脈內徑可代償性降低動脈硬度,降低心血管事件病死風險[12]。本研究觀察組術后肱動脈內徑升高更顯著,提示瑞舒伐他汀與替羅非班能有效抑制AMI發展,改善心功能。分析可能是瑞舒伐他汀通過調脂作用,能減少脂質黏附于血管內壁,同時聯合替羅非班強效抗血小板作用,阻止血小板局部聚集可進一步改善血管壁生理形態,舒張肱動脈。
大量研究表明,AMI與炎癥反應關系密切,發病后巨噬細胞、單核細胞均被激活,并大量釋放炎癥因子,如IL-6、TNF-α、hs-CRP等[13]。IL-6是炎癥反應重要介質,由單核細胞、心肌細胞等多種細胞生成,可誘導血栓形成,加重心肌損害[14];TNF-α是促炎細胞因子,主要由單核細胞、巨噬細胞生成,是誘發AMI患者心肌損害的關鍵性炎癥介質;hs-CRP是肝臟生成急性期蛋白,能刺激IL-6、TNF-α表達,三者互相作用增加粥樣斑塊不穩定性,提升AMI患病率及預后心血管不良事件發生概率。外周血IL-6、TNF-α、hs-CRP可作為預測AMI患者預后的主要指標[15]。本研究也顯示,術前AMI患者血清IL-6、TNF-α、hs-CRP水平均呈高表達狀態,但治療后觀察組血清IL-6、TNF-α、hs-CRP水平低于對照組(P<0.05),說明瑞舒伐他汀與替羅非班聯合能進一步緩解炎癥反應。瑞舒伐他汀除降脂作用外,還具有降低氧化應激、抗炎等多重作用,且有研究顯示,予以瑞舒伐他汀14 d即可觀察到hs-CRP顯著降低,AMI發病后即刻予以瑞舒伐他汀可抑制炎癥因子分泌[16];替羅非班能迅速阻斷血小板凝集效應,此過程可緩解、延緩梗死狀態進展,減輕機體炎性應激反應程度,抑制炎癥級聯反應,二者聯合可發揮協同作用。
EPCs是血管內皮細胞前體細胞,具有促進血管新生、維持血管內皮功能、修復血管內皮等生理作用,已有研究顯示,EPCs數量是心血管疾病治療重要指針[17]。本研究顯示,治療后瑞舒伐他汀與替羅非班聯合治療的患者EPCs數量高于瑞舒伐他汀治療患者(P<0.05),提示此方案能促使骨髓EPCs動員、歸巢至損害血管內皮,對血管內皮實施修復,以維持血管內皮結構、功能完整性。另外,血清NO、ET-1、vWF是反映血管內皮細胞功能主要指標,ET-1為血管內皮細胞生成主要縮血管因子;NO是血管內皮細胞生成舒張因子,二者比例失衡時可引起血管舒縮功能障礙;vWF由血管內皮細胞合成,其水平高低直接反映血管內皮細胞損害程度,表達越高,內皮細胞損害越嚴重[18]。本研究還顯示,術后1周觀察組血清ET-1、vWF水平低于對照組,NO水平高于對照組(P<0.05),說明瑞舒伐他汀與替羅非班聯合方案能通過增加EPCs數量改善血管內皮細胞功能。此機制可能是觀察組肱動脈內徑較大的又一主要原因,但具體通過何種信號途徑介導EPCs細胞動員需后期深入探究。
綜上可知,瑞舒伐他汀與替羅非班聯合PCI術治療AMI不僅能有效緩解炎癥反應,且具有血管內皮保護作用,能進一步改善心功能及生活質量。

