高血壓前期人群血壓晝夜節律與中性粒細胞淋巴細胞比值的關系研究
李建偉,張 婕,王 曼,王 輝,林奔騰
西安市第四醫院(西安 710004)
高血壓是一種常見的慢性心血管疾病,罹患高血壓者需經歷從健康血壓發展為高血壓的過程,即高血壓前期。2003年美國高血壓預防、檢測、評估和治療聯合委員會第7次報告(簡稱JNC-7)明確提出了高血壓前期的概念,將兩次及以上不同時間測得收縮壓120~139 mmHg(1 mmHg=0.1333 kPa)和(或)舒張壓80~89 mmHg定義為高血壓前期[1]。2005年我國高血壓防治指南中也將同樣范圍血壓值定義為正常高值[2],這個血壓值時期即為高血壓前期。高血壓前期極易發生發展為高血壓,且常常伴隨血壓晝夜節律紊亂,心腎眼腦等靶器官損害及合并臨床疾病發生風險增加。近年來研究發現炎癥因子的激活在高血壓的發生發展中起著重要的作用,在高血壓前期即有炎癥因子的參與。但目前關于高血壓前期血壓晝夜節律異常與炎癥的關系研究罕有,未證實兩者之間是否有相關性。故本研究以244例高血壓前期為研究對象,旨在探討高血壓前期血壓晝夜節律異常與炎性相關因子中性粒細胞淋巴細胞比值(Neutrophils to lymphocyte ratio,NLR)的相關性。
對象與方法
1 研究對象 選取2019年12月在西安市第四醫院健康體檢符合中國高血壓防治指南高血壓前期標準的受試者244例進行研究。診斷標準:高血壓前期采用中國高血壓防治指南診斷標準為收縮壓120~139 mmHg和(或)舒張壓80~89 mmHg,所有受試者均未曾服用降壓藥。排除標準:①急慢性感染者及近期服用抗炎藥物者;②患有冠心病、心肌病、心力衰竭、風濕性疾病、呼吸疾病、內分泌疾病者;③患有繼發性高血壓者;④妊娠者;⑤罹患腫瘤者。該研究符合2013年修訂的《赫爾辛基宣言》的要求。所有受試者均進行24 h動態血壓監測,根據動態血壓結果,夜間血壓較白天血壓下降超過10%歸入杓型組,不足10%者歸入非杓型組[3]。
2 研究方法
2.1 一般資料:收集所有受試者的高血壓家族史、性別、年齡、體重、身高等一般臨床資料,身高、體重均脫鞋著內衣測量。
2.2 血壓測量:按WHO制定的血壓測量標準進行。受試者靜坐休息30 min后,測試前避免飲酒及刺激性飲料,按照Korotkoff 聽音法測量3次血壓,每次測量間隔2 min,取3次血壓測量值的平均值作為最后測量結果。
2.3 24 h動態血壓監測:采用動態血壓監測儀(DMS-ABP,American)測量受試者動態血壓。采用松緊適中的袖帶置于受試者左上臂,白天每20 min測量1次血壓,夜間每30 min測量1次血壓,監測過程中需避免劇烈運動。血壓測量有效值比例占≥80%即認定24 h動態血壓監測合格。收集血壓指標:24 h收縮壓(24 h SBP)、24 h舒張壓(24 h DBP)、24 h平均動脈壓(24 h MAP);白天平均收縮壓(DSBP)、白天平均舒張壓(DDBP)、夜間平均收縮壓(NSBP)、夜間平均舒張壓(NDBP),計算夜間血壓較日間血壓下降程度[(日間血壓平均值-夜間血壓平均值/日間血壓平均值)×100%]。夜間血壓較白天血壓下降超過10%即認定為“杓型”,反之則認定為“非杓型”。
2.4 實驗室檢測:禁飲食8 h后空腹抽取外周靜脈血,利用全自動生化分析儀進行血常規、血清總膽固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、肌酐、血鈉、血鉀、血糖等指標檢測。
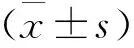
結 果
1 兩組一般資料比較 與杓型組受試者相比,非杓型組受試者體質量指數顯著升高[(26.25±3.06)比(23.27±3.03)kg/m2,P<0.01]。非杓型組受試者年齡高于杓型組受試者[(44.87±8.38)比(42.18±7.27)歲,P<0.05]。兩組受試者間甘油三酯、低密度脂蛋白膽固醇比較差異均有統計學意義(P<0.01)。兩組受試者間性別、空腹血糖、高密度脂蛋白膽固醇、血清鉀、鈉、肌酐比較差異均無統計學意義(P>0.05)。見表1。

表1 兩組一般資料比較

續 表
2 兩組受試者炎性指標比較 與杓型組相比,非杓型組高血壓前期患者NLR及C反應蛋白(C reactive protein,CRP)值均顯著升高,比較差異有統計學意義,見表2。
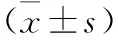
表2 兩組受試者炎性指標比較
3 兩組受試者血壓水平及節律比較 與杓型組高血壓前期患者相比,非杓型組高血壓前期患者24 h舒張壓平均值、24 h平均動脈壓值、夜間收縮壓平均值、夜間舒張壓平均值比較差異有統計學意義(P<0.01)。非杓型組與杓型組相比,夜間收縮壓下降率、夜間舒張壓下降率均明顯降低,差異有統計學意義(均P<0.01)。見表3。

表3 兩組受試者血壓水平及節律比較
4 夜間血壓下降率與觀察因素的相關性分析 Spearman 分析結果顯示夜間收縮壓下降率與年齡、體重指數、甘油三酯、NLR呈顯著負相關[(r=-0.402,-0.524,-0.282,-0.335),P<0.05],與空腹血糖、總膽固醇、低密度脂蛋白膽固醇、高密度脂蛋白膽固醇、血清鈉鉀、肌酐、WBC、CRP均無相關性(P>0.05)。夜間舒張壓下降率與年齡、體重指數、NLR均呈顯著負相關[(r=-0.276,-0.458,-0.346),P<0.01],與甘油三酯、低密度脂蛋白膽固醇呈負相關[(r=-0.217,-0.228),P<0.05],與空腹血糖、總膽固醇、高密度脂蛋白膽固醇、血清鈉鉀、肌酐、WBC、CRP均無相關性(P>0.05),見表4。

表4 夜間血壓下降率與觀察因素相關性分析
5 夜間血壓下降率與相關危險因素的Logistics回歸分析 分別以夜間收縮壓下降率及夜間舒張壓下降率為因變量(賦值方法:0=杓型,1=非杓型),以各相關指標(年齡、體質量指數、甘油三酯、低密度脂蛋白膽固醇、NLR)為自變量進行二元Logistics回歸分析,在校正了體重指數(Body mass index,BMI)、甘油三酯、低密度脂蛋白膽固醇等危險因素后,NLR仍為高血壓前期患者夜間血壓下降率的獨立危險因素(夜間收縮壓下降率:OR=1.531,95%CI:0.554~4.231,P<0.05,夜間舒張壓下降率OR=1.869,95%CI:0.541~6.451,P<0.05),見表 5。

表5 夜間血壓下降率與相關危險因素Logistics回歸分析
討 論
近年來,全球高血壓的發病率逐年上升,且趨于年輕化,為了積極控制高血壓的發生及防治靶器官的損害,2003年美國JNC-7首次明確提出了高血壓前期的概念,即收縮壓120~139 mm Hg和(或)舒張壓80~89 mmHg,而2018年我國高血壓前期人群已超過4億,作為可逆轉時期,高血壓前期人群血壓干預管理迫在眉睫。人體正常血壓受體內神經內分泌影響,表現為夜間血壓下降,較白天下降約10%~20%左右,該血壓節律即為杓型,若夜間血壓下降率不足10%,即為非杓型。研究表明,高血壓前期時即可表現出血壓晝夜節律的異常,血壓晝夜節律是高血壓發生發展的獨立危險因素,相較于單純血壓升高,血壓晝夜節律消失顯著增加靶器官損害及心腦血管事件發生的風險[3-4],2011年英國高血壓協會即建議除3級高血壓患者外,均應等待動態血壓結果指導降壓藥物治療,恢復正常的血壓晝夜節律也指出降壓治療的新方向。本研究中觀察到,在高血壓前期患者中已存在明顯的血壓晝夜節律紊亂,與既往研究結論一致,夜間血壓下降不足,正是引起并加重靶器官損害的重要原因。
本研究共納入244例受試者,觀察到非杓型組高血壓前期患者年齡明顯高于杓型組患者,表明隨著年齡的增大,血壓晝夜節律逐步弱化,這與自身神經內分泌調節及血管動脈硬化相關。同時我們觀察到,非杓型組高血壓前期患者血脂顯著高于杓型組患者,提示晝夜節律紊亂,夜間交感神經興奮,一方面引起夜間血壓下降不足,另一方面可造成血脂代謝失常。既往研究發現低密度脂蛋白膽固醇升高影響血壓數值,并且多表現為非杓型高血壓。國外學者觀察到高血脂可作用于血管緊張素-2受體促進高血壓發生發展[5],且高脂血癥通過損害血管內皮功能、壓力感受反射等途徑影響血壓。因此高血壓前期患者積極控制血壓的同時,也應關注血脂代謝。一項針對22111例健康人群為期6年的調查發現,處于高血壓前期中年齡越大、肥胖、有高血壓家族史者更易進展為高血壓。國內外多項研究顯示血壓處于120~139/80~89 mmHg時,即可觀察到心、腦、腎、眼底等靶器官損害,自115/75 mmHg開始,收縮壓每升高20 mmHg,心血管疾病風險就升高1倍[6-7]。眾所周知,高血壓患者危險因素越多,發生心血管風險越高,晝夜節律紊亂更進一步加重血管內皮功能受損,相較于杓型組,非杓型組患者體重指數、血脂均顯著升高,提示本研究中非杓型組高血壓前期患者較杓型組更易進展為高血壓,且心血管疾病風險更高。
炎癥參與多種慢性疾病的發病機制已成為近幾年來研究的熱點,如冠心病、心力衰竭、腦血管疾病、糖尿病等疾病。高血壓是一種以血壓升高為特征的慢性綜合征,同許多慢性疾病一樣,血壓的升高伴隨著體內慢性炎癥水平的升高,低度炎癥促進高血壓的發展,循環中炎性因子水平與高血壓的程度與靶器官的損害密切相關。同時,高血壓的危險因素如腹型肥胖、高脂血癥、高鹽飲食、吸煙等也能觸發體內的炎癥因子,參與促進高血壓的發生發展。高血壓前期是正常血壓向高血壓過渡的一種狀態,理論上也應存在全身炎癥反應,炎癥因子參與血壓升高及靶器官損害的發生。NLR是近年來一個新型的炎性標志物,由白細胞的兩個亞型之比構成,NLR 體現了直接炎癥反應和氧化應激反應的程度,國內外研究表明NLR對急性冠狀動脈綜合征、房顫、心力衰竭、代謝綜合征及其不良事件的發生、預后具有預測價值[8-10]。Yayla及劉建峰等[11-12]國內外學者研究證實NLR水平在健康人群與高血壓患者之間比較存在統計學差異,且與血壓分級密切相關,高血壓3級NLR水平(2.91±1.29)顯著高于高血壓1、2級(1.90± 0.78)、(2.5 ± 0.88)。Aydin等[13]對35例未診斷高血壓的健康人進行觀察發現,隨著NLR水平的升高,高血壓前期患者的人數也隨之增加。Liu等[14]對28850名健康人進行長達6年的隨訪,有1824名受試者出現了高血壓,發現NLR比值與血壓水平呈正相關,NLR水平的升高增加高血壓的患病風險。國外研究也發現降壓藥可通過降低血壓及抗炎作用降低NLR水平。Tolga及Hamza等[15-16]學者觀察到在高血壓患者中夜間血壓下降不足者NLR水平要明顯升高。但目前鮮有NLR在高血壓前期時的研究,尤其該時期患者循環中NLR水平與血壓晝夜節律關系尚未明確。本研究觀察到,在高血壓前期患者中,NLR值在非杓型組為(2.70±1.84),在杓型組為(1.88±0.61),均高于一般健康人群水平,且非杓型組較杓型組NLR值顯著升高。在調整了年齡、BMI、甘油三酯、低密度脂蛋白膽固醇等危險因素后,NLR仍為高血壓前期患者夜間血壓下降率的獨立危險因素。
NLR反映了高血壓前期患者血管炎癥水平[17]。在高血壓動物模型實驗研究中顯示中性粒細胞計數的升高早于血壓值的升高[18]。中性粒細胞促進花生四烯酸、髓過氧化物、超氧自由基、白細胞介素-1β和基質金屬蛋白酶等炎性介質的分泌與釋放[19],并激活腎素-血管緊張素-醛固酮系統及還原型輔酶Ⅱ[20],引起血管內皮功能障礙、動脈硬化,導致血壓升高及節律紊亂的風險增加。既往研究證實氧化應激在高血壓發病機制中扮演重要角色,而中性粒細胞可導致反應性氧族釋放,誘導血管收縮,并抑制一氧化氮的合成及其生物利用度,減弱內源性血管舒張作用,導致水鈉潴留、血容量增多,參與血壓節律的紊亂。另外,淋巴細胞減少與血壓紊亂激活機體適應性免疫及應激反應有密切關系,機體炎癥反應也可加速調節性淋巴細胞凋亡、抑制抗炎因子分泌,抗炎系統與促炎系統失衡[21-22],進一步導致血管內穩態失衡,引起血壓升高。炎癥反應及氧化應激反應使血壓晝夜節律逐步弱化,增加夜間交感張力,血壓晝夜節律紊亂進一步促進炎癥因子釋放、血管內皮損害,兩者交互作用最終引起高血壓發生并加重靶器官損害。即使NLR水平在正常范圍內,其值水平越高,與血壓升高、節律失調及預后關系也越密切。中性粒細胞淋巴細胞比值體現了機體內兩種白細胞亞型之間的平衡,受環境及機體生理因素影響較小,且經濟易采集,較單一指標預測準確度更高,可作為高血壓前期非杓型血壓節律的預測因子廣泛應用于臨床,通過篩查高血壓前期人群的NLR,盡早識別高危人群;同時,將炎癥因子作為治療靶點,為有效防治高血壓及靶器官損害指明了新方向。
本研究對象數量較少,且未能與健康者進行對比,由高血壓前期進展為高血壓期NLR變化水平也需進一步觀察研究,尚待以后更合理、樣本量更大的實驗來實現。綜上所述,我們發現在高血壓前期人群非杓型組NLR水平升高,其介導的炎癥反應在血壓晝夜節律改變中起重要作用,NLR為高血壓前期患者夜間血壓下降率的獨立危險因素。

