不同分型幽門螺桿菌感染消化性潰瘍患者血清胃蛋白酶原、共刺激分子CD40、α防御素表達及檢測意義
張彥亭,楊振威,原姍姍,莊 坤,陳曉露
西安市中心醫院消化內科(西安 710003)
消化性潰瘍(Peptic ulcer disease,PUD)是一種十二指腸或胃黏膜自我消化性潰瘍,可見于任何年齡段,臨床主要表現為上腹部疼痛、燒心、反酸等。幽門螺桿菌(Hpylori,HP)被認為是PUD的主要致病因子,臨床約80%PUD由HP感染所致[1]。然而,并非所有HP感染所致PUD患者均有臨床癥狀表現。PUD患者臨床癥狀表現和預后如何,不僅與環境、宿主自身遺傳因素等有關,還與HP菌株的毒力,即HP分型有關[2]。早期確定PUD患者HP感染情況和感染類型,對于治療方案的選擇和療效的改善均具有重要臨床意義。胃蛋白酶原(Pepsinogen,PG)是胃黏膜泌酸腺上主細胞分泌的蛋白酶前體,可在酸性條件下活化,消化自身黏膜組織[3]。共刺激分子是一種為B或T淋巴細胞的活化提供信號的細胞表面分子或其配體,包括腫瘤壞死因子家族,其中CD40是腫瘤壞死因子(Tumor necrosis factor,TNF)受體家族成員,與其受體結合后,可通過刺激胃腸黏膜組織固有層的淋巴細胞活化,促進多種炎癥介質合成釋放,引誘胃腸黏膜損傷[4]。α防御素(Alpha defensin,DEFA)是一種最早分離于兔肺巨噬細胞中的抗菌肽,人體中主要分布于是中性粒細胞中,具有殺滅細菌和病毒,參與機體免疫和炎癥反應[5]。以往有研究研究顯示,HP感染者外周血中PG、CD40和DEFA表達水平均異常于非感染者,可作為HP感染性疾病診斷及病情評估的重要指標[6-8]。為分析PG、CD40和DEFA在不同分型HP感染PUD患者的應用價值,本研究89例HP陽性PUD患者血清PG、CD40和DEFA水平進行了測定分析,現報告如下。
資料與方法
1 一般資料 選擇2018年7月至2020年2月本院消化內科收治的PUD患者162例為研究對象。病例納入標準:符合PUD相關診斷標準[9],且經胃鏡檢查和X線鋇餐造影檢查確診;近期未使用抗炎、抑酸、胃黏膜保護劑、免疫抑制劑;無血液系統疾病。排除標準:既往存在HP感染或治療史;其他炎癥性疾病;復合型潰瘍;合并其他感染性疾病;合并免疫系統疾病;胃食管反流或腫瘤。依據14C尿素呼氣試驗和HP血清IgG抗體分型檢測結果將入選患者分為HP陰性組、HPⅠ型組和HPⅡ型組。HP陰性組26例中男15例,女11例;年齡41~71歲,平均(55.76±8.42)歲;病灶直徑0.30~1.72 cm,平均(1.06±0.43) cm;病灶部位:胃潰瘍7例(9個病灶),十二指腸球潰瘍13例(13個病灶);復合型6個(13個病灶)。HPⅠ型組103例中男59例,女44例;年齡39~73歲,平均(55.91±8.36)歲;病灶直徑0.37~1.86 cm,平均(1.22±0.41) cm;病灶部位:胃潰瘍29例(35個病灶),十二指腸球潰瘍50例(50個病灶),復合型24例(49個病灶)。HPⅡ型組33例中男性19例,女性14例;年齡40~73歲,平均(55.65±8.42)歲;病灶直徑0.35~2.01 cm,平均(1.05±0.47) cm;病灶部位:胃潰瘍9例(13個病灶),十二指腸球潰瘍15例(15個病灶),復合型9例(19個病灶)。三組患者一般資料間比較差異無統計學意義(P>0.05),具有可比性。
2 研究方法
2.1 HP感染和其抗體檢測:①HP感染檢測:叮囑患者空腹3 h后,服用1例14C尿素膠囊(國藥準字H20000020),靜止30 min;隨后向呼氣卡(卡式幽門螺桿菌檢測儀呼吸卡YH04)中持續呼氣2~5 min,直至呼氣卡顏色由黃色變為白色時,打印實驗結果。結果判讀:檢測結果中放射性計數≥100 dpm/mmol時為HP陽性,否則為陰性[10]。②HP抗體檢測:取HP陽性患者周圍靜脈血樣2.0~3.0 ml,使用HP抗體分型分型檢測試劑盒,按照免疫印跡法操作步驟[國食藥監械(準)字2011第3400800號],測定患者HP抗體類型。結果判讀:VacA或(和)CagA抗體陽性為HPⅠ型,VacA和CagA抗體均陰性則為HPⅡ型。
2.2 血清PG、CD40、DEFA水平測定:抽取入選者空腹狀況下周圍靜脈血樣,高速離心分離血清備用。雙抗體酶聯免疫吸附法(試劑盒購自于上海信裕生物科技有限公司)測定其血清PGⅠ和PGⅡ;酶聯免疫吸附法(上海聯邁生物工程有限公司)測定血清DEFA。另取患者周圍靜脈血液一份,美國貝克曼CytoFLEX流式細胞儀測定CD40。
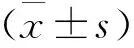
結 果
1 三組HP感染組血清PG、CD40、DEFA水平比較 見表1。三組PUD患者血清PGⅠ、PGⅡ、CD40、DEFA水平間比較差異具有統計學意義(P<0.05),HPⅠ型組和HPⅡ型組血清PGⅠ、PGⅡ、CD40水平明顯高于HP陰性組,DEFA水平明顯低于HP陰性組,HPⅠ型組血清PGⅠ、PGⅡ、CD40水平明顯高于HPⅡ型組,DEFA明顯低于HPⅡ型組(P<0.05)。
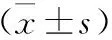
表1 三組HP感染組血清PG、CD40、DEFA水平比較
2 各組不同病灶類型患者血清PG水平比較 見表2、3。HP陰性組、HPⅠ型組、HPⅡ型組胃潰瘍、十二指腸球潰瘍和復合型潰瘍患者血清PGⅠ和PGⅡ水平間差異均具有統計學意義(P<0.05),十二指腸球潰瘍患者血清PGⅠ和PGⅡ水平顯著高于胃潰瘍,復合型潰瘍顯著高于十二指腸球潰瘍和胃潰瘍(P<0.05)。

表2 各組不同病灶類型患者血清PGⅠ水平比較(ng/ml)

表3 各組不同病灶類型患者血清PGⅡ水平比較(ng/ml)
3 各組不同病灶類型患者血清CD40水平比較 見表4。HP陰性組、HPⅠ型組、HPⅡ型組胃潰瘍、十二指腸球潰瘍和復合型潰瘍患者血清CD40水平間差異均具有統計學意義(P<0.05),十二指腸球潰瘍患者血清CD40水平顯著高于胃潰瘍,復合型潰瘍顯著高于十二指腸球潰瘍和胃潰瘍(P<0.05)。

表4 各組不同病灶類型患者血清CD40水平比較(%)
4 各組不同病灶類型患者血清DEFA水平比較 見表5。HP陰性組、HPⅠ型組、HPⅡ型組胃潰瘍、十二指腸球潰瘍和復合型潰瘍患者血清DEFA水平間差異均具有統計學意義(P<0.05),十二指腸球潰瘍患者血清DEFA水平顯著低于胃潰瘍,復合型潰瘍顯著低于十二指腸球潰瘍和胃潰瘍(P<0.05)。

表5 各組不同病灶類型患者血清DEFA水平比較(ng/L)
討 論
PUD屬于多發性消化系統炎癥病變,累及消化道黏膜及黏膜下層,具有多種臨床表現。PUID發生機制較為復雜,與胃酸分泌過剩、HP感染、消化道黏膜自我保護功能降低、遺傳、自身精神狀況等多種因素有關,而HP感染被認為是PUD發生的主要因素[11]。HP感染會對消化道黏膜產生免疫炎癥損傷,致使消化道黏膜組織出現出血、潰瘍等病理變化,隨著病情進展,甚至存在癌變風險,嚴重威脅患者生命健康和安全,早期準確診斷PUD類型具有重要臨床意義。
PG是胃黏膜細胞分泌的蛋白物質,包括PGⅠ和PGⅡ兩種類型,前者主要由胃黏膜主細胞和頸黏液細胞合成,后者由胃賁門腺、胃竇幽門腺體和十二指腸Brunner腺體分泌。在酸性條件下,可活化成對自身消化道黏膜具有消化功效的胃蛋白酶。正常條件下,機體約1% PG會進入血液循環,血液含量較為穩定。當機體受到HP感染初期,后者可分解尿素產生鹽酸或氨,促進胃黏膜組織對胃泌素的分泌,抑制對生長素的分泌,胃泌素分泌量增加會刺激胃酸分泌增多,進而導致PGⅠ釋放,從而形成惡性循環,最終加重對消化道黏膜組織的損傷;PGⅡ表達與胃底黏膜的異常病變相關,當機體發生假性胃上皮生化和異型增生,幽門腺體生化等病理變化時,其表達水平顯著升高[12-13]。聞華等報道顯示,HP陽性胃部疾病患者血清PGⅠ和PGⅡ水平高于HP陰性患者,且HPⅠ型感染者血清PGⅠ和PGⅡ水平明顯高于HPⅡ型感染者,與本研究在PUD患者研究中多的結果相吻合[6]。此外,本研究進一步分析顯示,HP陽性患者中,血清PG表達水平由高到低依次為胃和十二指腸球復合型潰瘍病灶、十二指腸球潰瘍和胃潰瘍。提示,血清PG水平測定可為PUD發病類型、發病部位診斷和臨床用藥方案確定提供參考。CD40是腫瘤壞死因子受體家族的重要成員,可表達于樹突狀細胞、巨噬細胞、B淋巴細胞等多種細胞表層,促進T淋巴細胞定向分化,誘導B淋巴細胞的增殖、分化,從而調節機體特異性免疫炎癥反應,參與其病理生理變化。在消化系統中,CD40與其配體CD40L結合,可激活胃腸黏膜固有層淋巴細胞,刺激多種促炎介質釋放,誘發黏膜組織損傷和功能異常[4]。目前,關于CD40在PUD發生發展中的研究未見報道。本研究結果顯示,HPⅠ型感染者血清CD40含量顯著高于HPⅡ型感染者和HP陰性患者,胃和十二指腸球復合型潰瘍病灶顯著高于十二指腸球潰瘍和胃潰瘍,該結果與腫瘤壞死因子-α在不同菌型HP感染的PUD患者體內表達情況相似。提示,HP感染,尤其是毒性較強的Ⅰ型HP感染,可導致機體細胞免疫應答增強,促進炎癥介質釋放,加重消化道黏膜損傷;此外,研究結果提示Ⅰ型HP是引起十二指腸球潰瘍發生的重要攻擊因子,通過促進共刺激分子家族中腫瘤壞死因子受體表達,后者與腫瘤壞死因子相結合,直接或間接作用于胃竇組織,促進胃酸分泌,最終引發十二指腸球性潰瘍病灶發生,相對于單純十二指腸球潰瘍,同時發生胃潰瘍和十二指腸球潰瘍的復合型病變炎癥程度更高,故CD40含量相對更高[14]。防御素是人體最大防御系統,具有廣譜性抗微生物活性,尤其在第血漿蛋白和低鹽離子狀態下,其殺菌濃度達1~10 mg/L。防御素包括DEFA、β防御素和θ防御素,其中DEFA由29~36個氨基酸組成,參與全身性和小腸宿主的防御。以往報道顯示,正常情況下,人體結腸黏膜內DEFA-5和DEFA6表達水平低,但當潰瘍性結腸炎發生時,結腸上皮細胞中其基因表達水平異常增加,尤其在感染性結腸炎中異常表達更為明顯[15]。陳思宇等[8]測定結果顯示,PUD患者血清DEFA表達水平顯著低于健康人群,活動期低于疤痕期和愈合期,且其表達水平與機體促炎因子IL-17顯著負相關,可作為診斷PUD發生的良好指標。本研究結果顯示,HPⅠ型感染者血清DEFA水平明顯低于HPⅡ型感染和HP陰性者,十二指腸球發病者低于胃部位發病者,復合型發病者低于十二指腸球發病者,該結果與陳思宇等[8]研究結果相一致。提示,HP感染,尤其是Ⅰ型HP感染,可破壞機體防御系統,降低全身性防御系統功能,尤其是十二指腸球部位防御功能,導致炎癥病灶發生,損傷機體消化系統。
綜上所述,HP感染性PUD患者血清PG、CD40水平升高,DEFA水平降低,且其含量與患者感染HP分型存在相關性,可作為臨床PUD患者HP感染情況和感染部位診斷的血清因子。

