胰島素受體底物1對成骨細胞分化的影響及機制
王 娜,劉 暢,劉斯靜,WANG Xiao,李玉坤,薛 鵬*
(1.河北醫科大學第三醫院內分泌科,河北省骨科生物力學重點實驗室,河北 石家莊 050051;2.河北醫科大學期刊社,河北 石家莊 050017;3.約翰·霍普金斯醫學院肌肉與骨骼研究中心,美國 馬里蘭 21212)
骨組織可持續再生,但在病理狀態下這種自我修復能力會被降低。糖尿病等疾病破壞骨轉換平衡,導致骨組織再生障礙,骨修復能力受損,骨微結構異常而易于發生脆性骨折[1]。骨髓間充質干細胞(bone marrow derived mesenchymal stem cells,BMSCs)具有多向分化潛能,可分化為成骨細胞、成軟骨細胞、脂肪細胞、神經細胞等[2],其向成骨細胞分化能力在骨質疏松癥發病中具有重要意義。BMSCs分化方向受多種因素調節,尤其是轉錄后調節因子。其中,具有盤狀同源區域結合序列的轉錄共活化因子(transcriptional coactivator with PDZ-binding motif,TAZ)具有廣泛生物學功能,參與調節BMSCs成骨-成脂分化平衡[3]。TAZ通過結合Runt相關轉錄因子2(runt related transcription factor 2,RUNX2)促進成骨分化,或結合過氧化物酶體增生物激活受體γ(peroxisome proliferator activated receptorγ,PPARγ)抑制成脂分化[4-5]。作為胰島素通路的樞紐因子,胰島素受體底物1(insulin receptor substrate 1,IRS-1)在糖尿病、骨質疏松癥中的作用舉重若輕。目前,關于IRS-1對BMSCs分化的影響尚有爭議。據報道,IRS-1胞內蓄積有利于細胞向成軟骨方向分化[6]。也有其他學者認為,IRS-1是細胞分化的抑制因子[7-8]。據此,本研究將進一步探索IRS-1/TAZ信號轉導調節BMSCs向成骨細胞分化的潛在機制,為干細胞分化調控程序提供新靶點。報告如下。
1 材料與方法
1.1實驗動物 3月齡SPF級雌性未受孕SD(Sprague Dawley)大鼠15只,用于動物實驗;4周齡SD大鼠9只,用于BMSCs的原代培養。實驗動物購于河北醫科大學實驗動物中心,動物合格證書號 1708080。
1.2動物分組及骨質疏松模型的構建 將15只3月齡SD大鼠隨機分為對照組、假手術組、去卵巢手術(ovariectomy,OVX)組,每組5只。去卵巢手術操作步驟如下:大鼠禁食禁水12 h后,對其進行麻醉,于俯臥位對大鼠卵巢進行定位,消毒手術部位,依次剪開皮膚、肌肉及筋膜,分離脂肪團,手術結扎輸卵管,完整切除雙側卵巢,止血并逐層縫合。假手術組僅切除卵巢等體積大小脂肪組織,保留卵巢。術后3 d內連續應用抗生素預防感染。術后12周用于后續實驗。
1.3大鼠BMSCs的原代培養及成骨分化 將4周齡SD大鼠CO2麻醉后處死,用75%乙醇浸泡5 min。在無菌條件下取雙側股骨,剪除股骨近端骨骺,用5 mL注射器吸取DMEM培養基反復沖洗骨髓腔,用1 mL注射器反復抽吸制成細胞懸液。細胞取出后,以5×106/cm2的密度接種于含12%胎牛血清及1%青鏈霉素的DMEM培養基中,放入細胞培養箱中培養。原代細胞達到80%融合后傳代,P3代細胞用于后續實驗。應用成骨誘導培養基(DMEM含12%胎牛血清,1%青鏈霉素,10 nmol/L地塞米松,10 mmol/L β-甘油磷酸和50 mg/L抗壞血酸)誘導BMSCs向成骨細胞分化。
1.4微型電腦斷層成像(micro-computed tomography,μCT)分析 取SD大鼠股骨,用4%多聚甲醛固定,4 ℃,24 h。應用高分辨率μCT (SkyScan,1176)對股骨進行掃描分析(65 kv,153 μA),分辨率9.0 μm/pixel。應用重建軟件(NRecon,v1.6,SkyScan)、數據分析軟件(CTAn,v1.9,SkyScan)和三維模型可視化軟件(CTVol,v2.0,SkyScan)對掃描圖像進行處理和分析。分析指標包括骨小梁體積分數(bone volume fraction,BV/TV),骨小梁厚度(trabecular thichness,Tb.Th)和骨小梁分離度(trabecular separation,Tb.Sp)。
1.5免疫熒光分析 取SD大鼠股骨,用4%多聚甲醛固定,4 ℃,24 h;0.5 mol/L乙二胺四乙酸脫鈣3周,4 ℃,搖床;應用8%明膠包埋,制作20 μm冰凍切片。將冰凍切片于37 ℃烘干,浸泡于PBS液15 min,5% BSA封閉1 h,一抗孵育(抗大鼠IRS-1,Abcam),4 ℃,過夜;TBST清洗,熒光二抗孵育1 h,TBST清洗,DAPI封片。采用Image J軟件對熒光強度進行統計分析。
1.6質粒轉染 課題組在前期實驗中已經自行構建IRS-1高表達質粒(pCMV-IRS-1)[9]。本實驗構建了分別用于敲除IRS-1和TAZ表達的質粒,即嵌入敲除IRS-1表達的小干擾RNA(SiIRS-1)的質粒,和嵌入敲除TAZ表達的小干擾RNA(SiTAZ)的質粒(上海吉凱基因化學有限公司)。應用脂質體3 000(Thermo)對BMSCs進行轉染。細胞轉染24 h后,更換為成骨誘導培養基進行培養。同時為上述實驗設立對照,未進行質粒轉染組設置為“空白對照組”,轉染空白質粒組作為“陰性對照組”。
1.7茜素紅染色 將細胞接種至35 mm塑料培養皿中,成骨誘導基培養14 d。PBS清洗2次,4%多聚甲醛室溫固定20 min。蒸餾水清洗3次后,0.1%茜素紅染色,37 ℃,30 min。蒸餾水清洗3次后,顯微鏡下拍照。然后,應用10%氯化十六烷基吡啶對茜素紅進行脫色,室溫,30 min。應用酶標儀(562 nm)讀取其吸光度值。
1.8蛋白免疫印跡(Western blot) 將細胞接種至60 mm塑料培養皿中,成骨誘導基培養3 d。利用RIPA裂解液提取蛋白。應用12% SDS-PAGE膠對蛋白進行電泳分離后,采用半干法將其轉移至PVDF膜。5%牛奶封閉,37 ℃,室溫。一抗孵育(抗TAZ,Cell Signaling;抗RUNX2,Boster;抗骨鈣蛋白(osteocalcin,OCN),Boster;抗GAPDH,Bioworld),4 ℃,過夜。二抗37 ℃孵育1 h。應用image J軟件分析蛋白條帶灰度值,并計算目的蛋白與內參蛋白條帶灰度值的比值。
1.9統計學方法 應用SPSS 20.0統計軟件分析數據。計量資料比較采用單因素方差分析和SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1不同組別大鼠股骨μCT和IRS-1免疫熒光染色比較 采用μCT對大鼠股骨的松質骨相關指標進行分析,結果顯示,3組間BV/TV值、Tb.Th值、Tb.Sp值差異有統計學意義(P<0.05);OVX組BV/TV值、Tb.Th值低于對照組和假手術組,Tb.Sp值高于對照組和假手術組,差異有統計學意義(P<0.05);對照組和假手術組BV/TV值、Tb.Th值、Tb.Sp值差異無統計學意義(P>0.05)。采用免疫熒光染色定量分析大鼠股骨IRS-1的表達量,結果顯示,3組間IRS-1+熒光強度百分比差異有統計學意義(P<0.05);OVX組IRS-1+熒光強度百分比低于對照組和假手術組,差異有統計學意義(P<0.05);對照組和假手術組IRS-1+熒光強度百分比差異無統計學意義(P>0.05)。見圖1,表1。
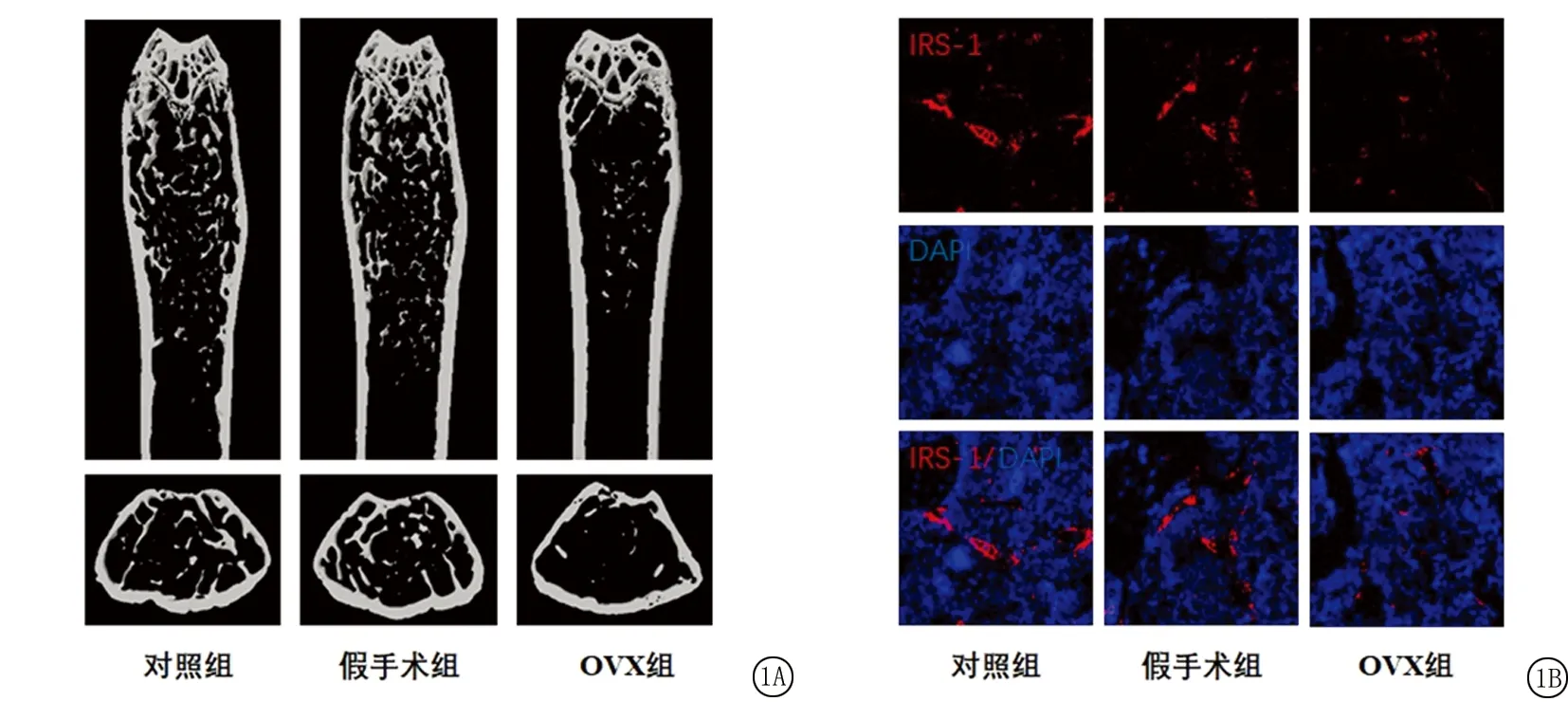
圖1 不同組別大鼠股骨μCT結果和IRS-1熒光染色的比較
表1 不同組別大鼠股骨μCT定量分析和IRS-1免疫熒光染色定量分析比較Table 1 The quantitative analysis of μCT results of rat femurs and IRS-1 immunofluorescence results in different groups
2.2IRS-1基因高表達對茜素紅染色結果和成骨分化相關蛋白表達的影響 BMSCs成骨誘導14 d后,對其進行茜素紅染色,結果顯示,應用pCMV-IRS-1轉染后,IRS-1組BMSCs的鈣結節明顯多于空白對照組和陰性對照組(圖2A)。進一步對茜素紅吸光度進行定量分析后發現,3組間茜素紅吸光度差異有統計學意義(P<0.05);IRS-1組茜素紅吸光度高于空白對照組和陰性對照組,差異有統計學意義(P<0.05);空白對照組和陰性對照組茜素紅吸光度差異無統計學意義(P>0.05)。BMSCs成骨誘導3 d后,采用Western blot方法分析成骨分化相關蛋白TAZ、RUNX2、OCN的表達水平,結果顯示,IRS-1組TAZ、RUNX2、OCN的表達量明顯高于空白對照組和陰性對照組(圖2B)。進一步對蛋白條帶灰度值進行定量分析后發現,3組間TAZ、RUNX2、OCN的表達量差異有統計學意義(P<0.05);IRS-1組TAZ、RUNX2、OCN的表達量高于空白對照組和陰性對照組,差異有統計學意義(P<0.05);空白對照組和陰性對照組TAZ、RUNX2、OCN的表達量差異無統計學意義(P>0.05)。見圖2,表2。
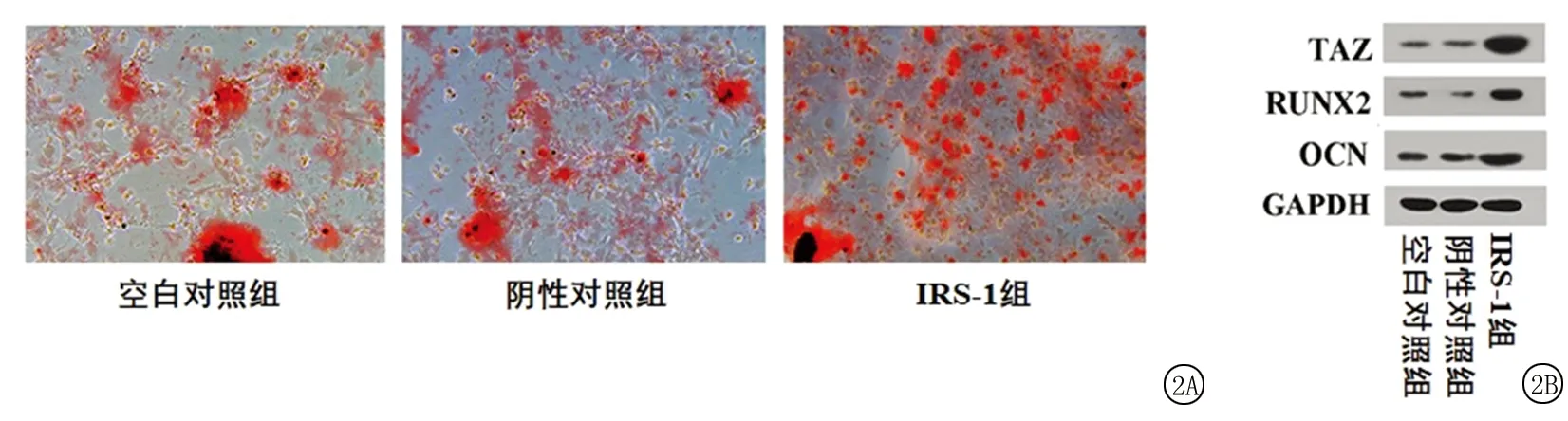
圖2 IRS-1基因高表達對茜素紅染色結果和成骨分化相關蛋白表達的影響
表2 IRS-1基因高表達對茜素紅染色和TAZ、RUNX2、OCN表達影響的定量分析 Table 2 The quantitative analysis of the effects of high expression of IRS-1 mRNA on alizarin red staining results and the expression of osteogenic differentiation related proteins
2.3IRS-1或TAZ基因敲除對茜素紅染色結果和成骨分化相關蛋白表達的影響 茜素紅染色結果提示, SiIRS-1組和SiTAZ組的鈣結節明顯少于空白對照組和陰性對照組(圖3A)。進一步對茜素紅吸光度進行定量分析后發現,4組間茜素紅吸光度差異有統計學意義(P<0.05);SiIRS-1組和SiTAZ組茜素紅吸光度低于空白對照組和陰性對照組,差異有統計學意義(P<0.05);空白對照組和陰性對照組、SiIRS-1組和SiTAZ組差異無統計學意義(P>0.05)。Western blot結果顯示,SiIRS-1組和SiTAZ組TAZ、RUNX2、OCN的蛋白表達量明顯低于空白對照組和陰性對照組(圖3B)。進一步對蛋白條帶灰度值進行定量分析后發現,4組間TAZ、RUNX2、OCN的表達量差異有統計學意義(P<0.05);SiIRS-1組和SiTAZ組TAZ、RUNX2、OCN的表達量低于空白對照組和陰性對照組,差異有統計學意義(P<0.05);空白對照組和陰性對照組、SiIRS-1組和SiTAZ組間TAZ、RUNX2、OCN的表達量差異無統計學意義(P>0.05)。見表3。
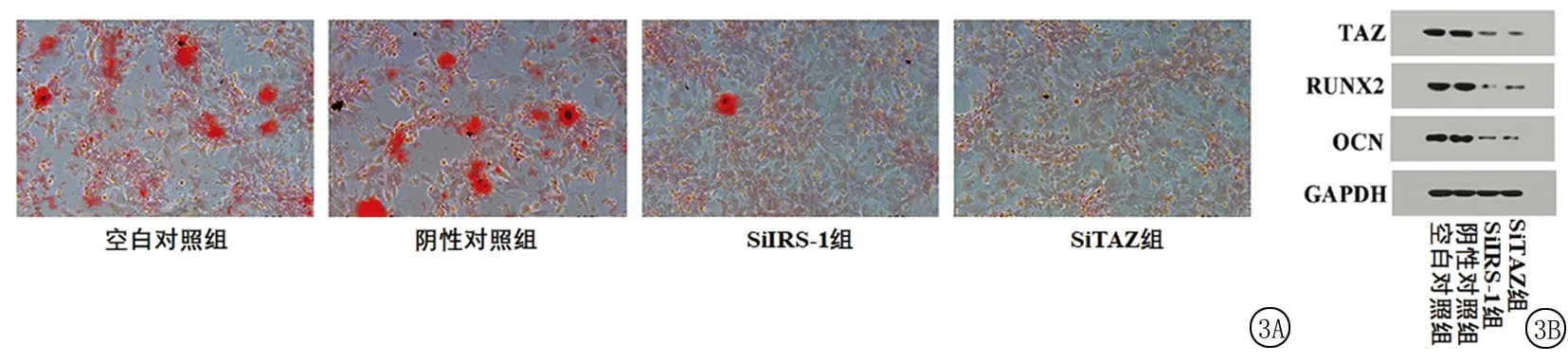
圖3 IRS-1或TAZ基因敲除對茜素紅染色結果和成骨分化相關蛋白表達的影響
表3 IRS-1或TAZ基因敲除對茜素紅染色和TAZ、RUNX2、OCN表達影響的定量分析Table 3 The quantitative analysis of the effects of IRS-1 or TAZ knockout on alizarin red staining results and the expression of osteogenic differentiation related proteins
3 討 論
骨質疏松癥是一種以骨形成受損、骨吸收增加為特征的骨代謝疾病,骨量降低、骨微結構損害,骨折風險明顯增加。近來,學者發現基因修飾干細胞可促進BMSCs向成骨細胞分化,改善骨細胞功能,在來源上增加骨形成[10]。同時,體外培養BMSCs在骨生理學研究領域廣為應用,可作為干細胞基因修飾的種子細胞。本研究結果顯示,IRS-1和TAZ之間存在相互作用,這種相互作用是調節BMSCs向成骨細胞定向分化的潛在機制,是聯絡糖尿病和骨質疏松癥的關鍵因素,可作為基因修飾干細胞治療的新靶點。
IRS-1是胰島素信號轉導的船塢蛋白,在胰島素受體結合SH2結構蛋白中起錨定作用。同時,IRS-1本身含有21個酪氨酸磷酸化位點,可直接與SH2結構蛋白結合,進而激活下游信號通路[11]。此外,IRS-1還包含絲氨酸/蘇氨酸殘基,可被絲氨酸/蘇氨酸蛋白激酶磷酸化,抑制胰島素受體酪氨酸蛋白激酶活性,進而參與調節細胞增殖、生長、分化等多種功能[12]。近來,研究發現IRS-1在成骨細胞和軟骨細胞中表達,而不在破骨細胞表達[13-14]。進一步研究,IRS-1基因特異性敲低小鼠表現為成骨分化抑制,成骨細胞數量減少,導致骨形成率降低[15]。可見,IRS-1不僅是胰島素抵抗的候選基因,在骨代謝中的作用也不容忽視。但是,目前關于IRS-1對細胞分化的作用尚存爭議。IRS-1是一種細胞分化抑制因子。Xi等[16]體內外實驗發現,敲低IRS-1減少p53/Kruppel樣因子4復合體形成,促進血管平滑肌細胞增殖和分化。與此相反,多數學者認為IRS-1是一種細胞分化促進因子[17]。這可能是因為,不同細胞類型中,IRS-1對細胞分化的作用不盡相同。成肌細胞中研究發現,IRS-1是成肌細胞分化的必需因子,敲低IRS-1成肌細胞分化減少[18]。本研究部分結果表明,IRS-1是間充質干細胞成骨分化的必需因子,敲低IRS-1則TAZ表達下調,成骨分化抑制;過表達IRS-1則TAZ表達上調,成骨分化加強。
另一方面,本研究還發現了IRS-1和TAZ之間的密切聯系。TAZ是調節BMSCs成骨-成脂分化平衡的關鍵因子。最初,TAZ作為14-3-3結合蛋白被發現,其89位絲氨酸位點磷酸化后可以與14-3-3結合,進而阻滯于細胞質[19]。TAZ在哺乳動物廣泛表達,與Yes相關蛋白(Yes-associated protein,YAP)有約50%同源性,且在拓撲結構上十分相似[20]。TAZ和YAP一樣具有轉錄激活功能,最先發現TAZ可分別與成骨分化關鍵轉錄因子RUNX2及成脂分化關鍵轉錄因子PPARγ結合,激活RUNX2轉錄,抑制PPARγ轉錄活性,從而促進成骨分化而抑制成脂分化,即調節干細胞定向分化[21]。本研究首次發現了IRS-1和TAZ之間的相互作用,這種相互作用可能是IRS-1促進BMSCs向成骨細胞分化的潛在機制。
綜上所述,IRS-1可通過上調TAZ表達,促進BMSCs向成骨細胞分化。IRS-1/TAZ可能作為基因修飾干細胞治療糖尿病骨質疏松癥的新靶點。

