國內外敵螨普及硝苯菌酯殘留檢測方法的研究進展
杜月梅 高麗萍 邵華
[摘 要] ?硝苯菌酯是從敵螨普中分離出來的具有最高生物活性的異構體之一,二者都為高效的非內吸性、接觸性殺菌、殺螨劑,正被廣泛用于多種植源性食品的病蟲防治。但由于人類對它們的過度和不當使用,導致約70%~80% 的農藥殘留在環境中,造成嚴重的危害并威脅人類的生命健康。通過簡述敵螨普及硝苯菌酯的環境毒性,綜述敵螨普及硝苯菌酯農藥殘留檢測的樣品前處理技術及其發展趨勢以及常用的檢測手段,特別是液質聯用的廣泛應用,對未來可能用于檢測敵螨普及硝苯菌酯的殘留分析技術的發展前景進行了展望。
[關鍵詞] ?敵螨普;硝苯菌酯;農藥殘留;殘留檢測;植源性食品
[中圖分類號] ?TS 207.5 ?[文獻標志碼] A ?[文章編號] 1005-0310(2020)04-0079-06
Abstract: Meptyldinocap is one of the isomers with the highest biological activity isolated from dinocap. Both are used as a highly effective non-systemic, contact bactericidal and acaricide, and they are being widely used in the control of pests and diseases of multi-plant foods. However, due to the excessive and improper use of pesticides, about 70%~80% of pesticide residues are left in the environment, causing serious harm to the environment in which human beings live and threatening human life and health. In this review, environmental toxicity of dinocap and meptyldinocap were briefly described. Additionally, the pre-treatment techniques and its development trend and commonly used detection methods of dinocap and meptyldinocap were reviewed. We focuse on the widespread application of LC-MS/MS, and the prospects for the future development of the residual analysis technology that may be used to detect dinocap and meptyldinocap.
Keywords: Dinocap; Meptyldinocap; Pesticide residue; Residue detection; Plant-derived food
我國是農業大國,植源性食品占據人們生活餐桌的重要地位[1]。近年來,由于人們對農藥的過度和不當使用,導致很多植源性食品中存在農藥殘留的問題,在對人們的生命健康造成危害的同時,也影響了我國的進出口貿易[2-5]。敵螨普及硝苯菌酯是常用在植源性食品上的殺菌殺螨劑,其防治效果明顯[6]。雖然經過不斷的研發改進,在藥毒性上已比從前降低很多,但是在藥理上仍然屬于高毒農藥[7],因此必須要做好對敵螨普及硝苯菌酯農藥的殘留檢測。科研工作者對此作了大量的工作,本文在總結他們工作的基礎上,對國內外文獻中植物源性食品的敵螨普及硝苯菌酯殘留測定方法中的提取、凈化、檢測方法及其測定的發展趨勢等方面進行了綜述,以期為我國制定愈來愈嚴格的農藥殘留限量標準來控制食品的質量、提高食品的安全性提供參考。
1 敵螨普的概述
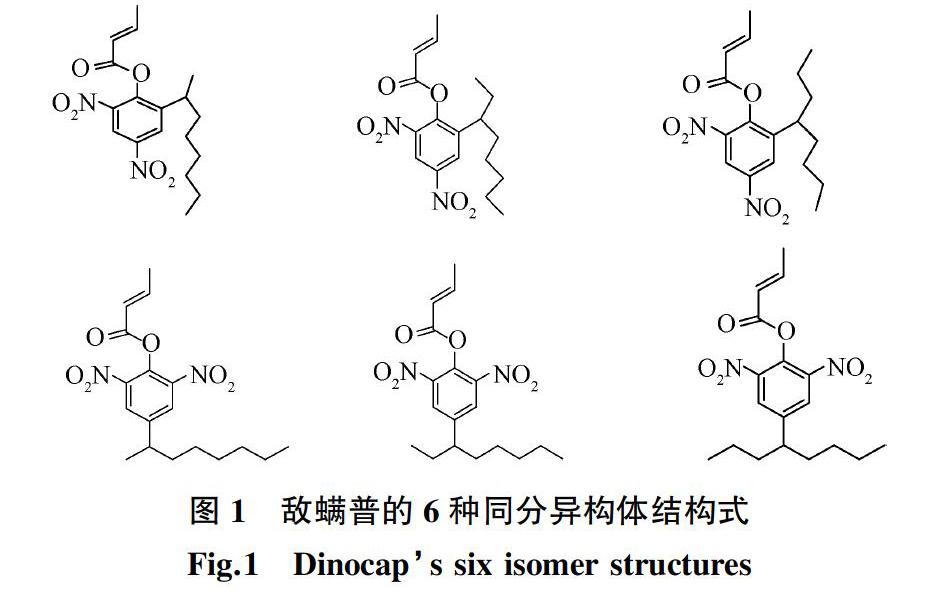
敵螨普(Dinocap,CAS登記號為39300-45-3),別名為2-異辛基-4,6-二硝基苯基2-丁烯酸酯,又稱開拉散或消螨普,分子式是C18H24N2O6,分子量為364.393,屬于農用化學品,是6種同分異構體的混合物(如圖1),ADI為0.008 mg/kg bw,具有熱不穩定性和化學不穩定性,容易水解成相應的酚[8]。該藥于2010年在意大利由陶氏益農公司登記上市,其化學制品系兩種構式(Ⅰ和Ⅱ)[9],是一種暗褐色液體,不溶于水,可溶于有機溶劑,分為可濕性粉劑和乳油兩種,對皮膚有一定的刺激作用,可致敏,長期接觸嚴重危害健康。除此之外,它有一定的發育毒性,可能致胎兒畸形,還可改變小鼠的免疫系統[10-11],并且對水生生物有極高毒性。敵螨普是一種非內吸性、接觸性殺螨劑,兼有殺菌活性,主要用于防治蘋果、葡萄、柑橘、煙草、薔薇、菊花、黃瓜、啤酒花、核果、漿果等中的紅蜘蛛和白粉病,同時還具有殺螨卵的作用,比如用于防治蘋果中的全瓜螨,可用作種子處理劑[12-13]。
硝苯菌酯 (Meptyldinocap, CAS登記號為131-72-6),又稱2-異辛基-4,6-二硝基苯基-2-丁烯酸酯(2, 4-dinitro-6- (1-methylheptyl) phenyl crotonate, 2, 4-DNOPC),ADI為0.02 mg/kg bw,是從敵螨普中分離出來的具有最高生物活性的異構體之一[14]。該藥是美國陶氏益農公司開發的二硝基苯酚類殺菌劑,2007年首次在羅馬尼亞獲得登記許可后,在意大利、英國、智利相繼獲得授權[15],2011年美國Gowan公司取得其銷售權,2015年在歐洲取得正式登記,目前正在中國登記。它為非內吸性殺螨劑,同時具有一定的接觸性殺菌作用,主要被用來防治柑橘類、核果類、仁果類、瓜果蔬菜和觀賞植物中的紅蜘蛛和白粉病,其中36%硝苯菌酯乳油對黃瓜上的白粉病防治效果較好。
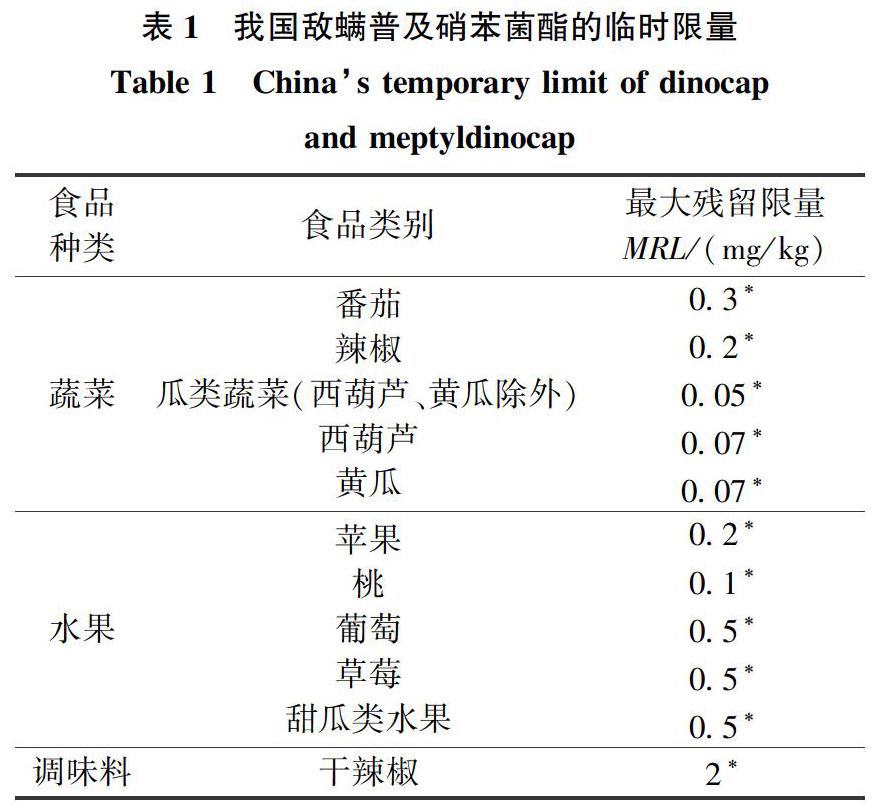
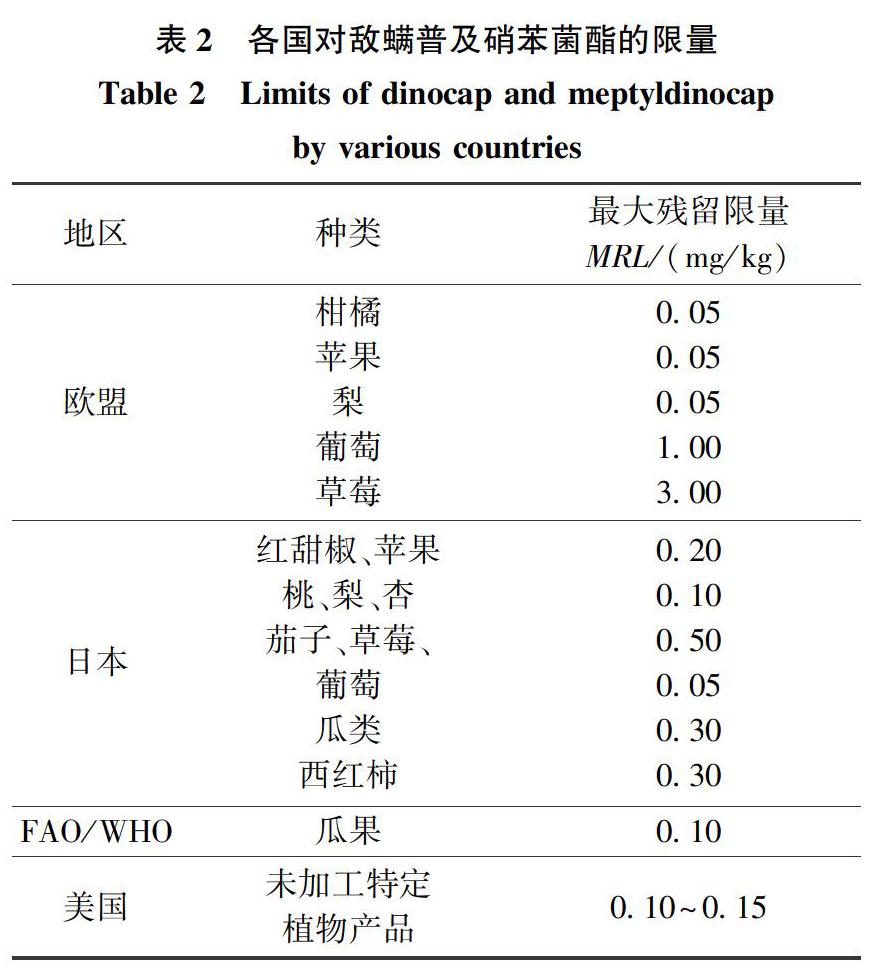
GB 2763—2019中敵螨普的殘留定義為:敵螨普異構體和敵螨普酚的總量,用敵螨普表示。根據歐盟法規396/2005可知,許多國家已制定了多種農產品中敵螨普及硝苯菌酯的最大殘留限量(MRL),但我國還未制定有關敵螨普及硝苯菌酯殘留限量的標準,GB 2763—2019中規定了敵螨普的臨時限量(見表1、表2),也規定了硝苯菌酯在黃瓜、西葫蘆、葡萄、草莓、瓜果類水果(西瓜除外)中的臨時限量,分別為2、0.07、0.2、0.3、0.5 mg/kg,但由于缺少相應的檢測方法,因此對于敵螨普和硝苯菌酯的風險評估很難開展。
2 國內外檢測方法的研究進展
敵螨普及硝苯菌酯的檢測方法主要有氣相色譜法(GC-ECD)、氣相色譜-質譜聯用法(GC-MS)、高效液相色譜法(HPLC)、液相色譜-質譜/質譜聯用法(LC-MS/MS)[8,14,16-29]等方法。
2.1 氣相色譜及其聯用技術
Grigoriu等[16]采用氣相色譜-質譜聯用技術對不同加標樣品(土壤樣品以及每種葡萄酒和葡萄樣品中的兩種)中低質量濃度的敵螨普進行評估。樣品用二氯甲烷進行萃取,結果表明:在敵螨普初始添加質量濃度為15~200 μg/mL時,施藥18天后,葡萄、土壤和葡萄酒中敵螨普的回收率分別由64%降至3%、72%降至9%、 82%降到10%。此外,他們的方法也可用于其他環境樣品中加標質量濃度低至2~20 μg/mL的命名農藥的篩選和鑒定。
Bella等[17]建立了一種使用配備電子捕獲檢測系統(ECD)的高分辨率氣相色譜儀直接分析的方法來對葡萄和葡萄酒中的敵螨普殘留量進行了分析。樣品由乙酸乙酯萃取,平均回收率為80.4%~110.4%,敵螨普的定量限為0.010 mg/kg,檢測限為6×10(-4) ng。
除此之外,Heimlich等[18]還運用氣相色譜-紅外光譜和質譜聯用技術(GC/IR and GC/MS)對敵螨普的6種同分異構體進行了測定,其中,活性最強的異構體硝苯菌酯也可用氣質聯用法測定。
景贊等[19]建立了一種固相萃取(SPE)氣質聯用法來測定油桃中的硝苯菌酯。油桃樣品用乙腈提取,C18固相萃取柱濃縮凈化,在0~4 μg/mL質量濃度范圍內,方法的線性關系良好,得到檢出限(LOD)為0.003 mg/kg,定量限(LOQ)為0.03 mg/kg,回收率為77.9%~85.3%,精密度的RSD為3.3%的結果。這種方法操作簡便,定性定量準確,靈敏度高,比較適合油桃中硝苯菌酯殘留的檢測。
2.2 高效液相色譜法(HPLC)
高效液相色譜法一般用來檢測農作物中敵螨普的殘留。
Schenck Frank J等[20]采用固相萃取-高效液相色譜-紫外分光光度法(HPLC-UV)測定蘋果、梨和葡萄中的敵螨普殘留。水果樣品用丙酮提取,并用反相(C-18)和正相(二氧化硅)固相萃取柱對萃取物進行凈化,測得在添加水平為0.1 mg/kg時,作物樣品的平均回收率為85.9%的結果。
Liang等[21]采用高效液相色譜-紫外檢測(245 nm)法測定了不同作物中敵螨普殘留量。農作物(添加0.5 mg/kg敵螨普)用丙酮萃取,并再次萃取到己烷中,然后依次通過己烷-乙腈分配和硅膠柱色譜法純化,檢出限為0.02 mg/kg,回收率為85%~100%。
Johansson[22]則采用衍生化-電子捕獲法測定果蔬中敵螨普的含量。
此外,如圖2所示,由于敵螨普具有熱不穩定性和化學不穩定性,所以它和硝苯菌酯在農產品中的殘留量分析方法目前主要采用有機試劑提取后,再水解成對應的酚,通過采用LC或LC-MS/MS分析其對應的水解產物酚的殘留量,從而計算母體的殘留量[8,14,23-27]。
2.3 液相色譜-質譜/質譜聯用法(LC-MS/MS)
液相色譜-質譜聯用法(LC-MS),是以高效液相色譜作為分離系統、高分辨率質譜為檢測系統的分析方法。該方法體現了液相色譜和質譜優勢的互補,將色譜對復雜樣品的高分離能力與質譜高選擇性、高靈敏度及能夠提供相對分子質量與結構信息的優點結合起來,目前已發展成為最重要的定性、定量分析技術之一。
張志勇等[23]建立了液相色譜-電噴霧串聯質譜 (LC-ESI-MS/MS) 檢測方法來測定甘藍、黃瓜、番茄、蘋果、梨、葡萄中硝苯菌脂殘留量。研究人員將蔬菜和水果經丙酮-甲醇-鹽酸的混合液進行液-液分配提取,在堿性條件下超聲水解后再進行液-液分配提取,通過測定硝苯菌脂中相應的水解產物硝苯菌脂苯酚的量來計算蔬菜水果中硝苯菌脂的殘留量。結果表明,硝苯菌脂在6種蔬菜水果中的平均回收率為81.2%~98.3%,RSD為5.1%~10.4%,最低檢測限均為0.01 mg/kg。
Mandal Sudeb等[24]也采用了同樣的方式來檢測硝苯菌酯的殘留。芒果和土壤樣品用丙酮∶甲醇∶4 mol/L鹽酸(100∶10∶5,v/v/v)進行萃取,然后將母體硝苯菌酯水解轉化為相應的苯酚代謝物,并使用乙酸乙酯進行液-液分配,再通過LC-MS/MS對硝苯菌酯苯酚進行最終定量。最后所得結果為:在0.025~2 mg/kg的添加水平上,樣品中硝苯菌酯的回收率為93%~98%,重復性和重現性的相對標準偏差可接受(2%~6%),定量限(LOQ)為0.025 mg/kg。他們對芒果中硝苯菌酯進行了多場所野外消散研究,為該農藥在印度安全使用也提供了一些依據。
為了檢測煙草中硝苯菌脂的含量,孔光輝等[8]也采用相同的思路和改進的QuEChERS技術對煙草樣品進行提取,在堿性條件超聲水解后進樣分析,采用UPLC-MS/MS方法檢測。結果表明,硝苯菌脂在0.001~0.5 mg/kg范圍內,線性關系良好,R2>0.999,檢出限為3 μg/kg,在煙草中的回收率為92.4%~100.5%,RSD為2.5%~3.3%。他們的方法前處理步驟更加簡潔快速,省溶劑,且融合了高效液相色譜高靈敏度、高選擇性的優點,檢測靈敏度與精確度也更加符合農藥殘留登記準則(NY/T 788—2004)的要求。Alexander等[25]采用QuEChERS方法進行敵螨普的提取凈化,然后再進行堿水解,但需要衍生12 h,對日常工作來說,時間過久。
Banerjee Kaushik等[26]采用液相色譜-質譜聯用法對不同水果基質中硝苯菌酯的殘留量進行了分析。研究人員采用乙酸乙酯萃取樣品,蒸發干燥,然后用乙醇胺將硝苯菌酯水解成硝苯菌酯苯酚,并用LC/MS/MS進行分析。結果顯示,在0.01 mg/kg的LOQ下,葡萄和芒果中的回收率大于80%,在0.025 mg/kg的LOQ下石榴回收率也大于80%,RSD<10%。
此外,Kurup等[27]提出了一種簡單的分光光度法測定硝苯菌酯,將硝苯菌酯堿水解為硝苯菌酯苯酚,在380 nm處具有最大吸收,檢出限和定量限分別為0.089 2 μg/mL和0.270 3 μg/mL。
Janssona Christer等[28]研究人員建立了一種利用乙酸乙酯萃取-液相色譜-質譜聯用技術(LC-MS/MS)測定57種果蔬中農藥殘留量的多殘留新方法。研究者用乙酸乙酯萃取樣品后,濃縮,再在甲醇中復溶,然后用LC-MS/MS進行檢測。在添加水平為0.01~0.5 mg/kg時,敵螨普的回收率在70%~100%之間。他們的方法比較快速、直觀,也不需要額外的清理步驟。
液相色譜-質譜聯用法結合QuEChERS,適用于植源性食品中多種農藥的殘留分析。Golge Ozgur等[29]采用乙腈對樣品進行基礎提取,然后用PSA進行SPE凈化,用LC-MS/MS法來檢測柑橘中的敵螨普殘留。得到敵螨普的檢出限(LOD)和定量限(LDQ)分別為0.006 mg/kg和0.017 mg/kg,R2>0.99,在0.01 mg/kg和0.1 mg/kg的添加水平上其回收率分別為111%和92.2%,RSD<13%,不確定性小于45%。此外,他們在同年用同樣的方法檢測西紅柿中敵螨普的殘留[30],得到敵螨普的檢出限(LOD)和定量限(LDQ)分別為0.005 8 mg/kg和0.017 mg/kg,R2>0.99,在0.01 mg/kg和0.1 mg/kg的添加水平上其回收率分別為87.5%和90.3%,RSD<20%,不確定性小于33%。他們的方法在線性度、特異性、回收率和精密度方面都為良好。
3 總結及展望
近年來,農藥殘留檢測技術向著過程簡單化、微型化和自動化的方向發展,而QuEChERS前處理技術更是因為它的簡便、快捷及經濟被廣泛用于農藥殘留的檢測[31-33],從本文中可以看出,經過國內外研究人員對敵螨普及硝苯菌酯的不斷研究,其前處理方法也從之前較復雜的方法發展為現在的QuEChERS方法及改進的QuEChERS法。在檢測技術方面,由于敵螨普和硝苯菌酯具有熱不穩定性和化學不穩定性,因此用氣相色譜-質譜(GC-MS)分析時選擇性、精密度和重現性較差;由于其電子噴霧離子化程度低,在采用液相色譜-串聯質譜(LC-MS/MS)分析時靈敏度也不盡理想。因此,研究人員對敵螨普及硝苯菌酯的檢測方法是將它水解為對應苯酚,再用LC-MS/MS的方法進行檢測其水解產物酚的殘留量來推算其母體的殘留量,但此法計算較困難,因此,還需科研人員不斷努力,利用科學技術的發展,不斷創新開發更加可靠、高靈敏、適用性強、簡便快捷的敵螨普及硝苯菌酯農藥殘留的檢測技術。目前以GC/MS、HPLC/MS甚至多重質譜串聯的方式來進行定性確認和定量檢測的技術己成為植物源性食品中農藥殘留分析技術的主流,而串聯質譜技術的不斷發展以及期望它與其他技術的結合,也對未來建立實施高分辨標準化提供了可能性[34]。除此之外,應用于農藥殘留分析領域的納米材料,尤其是將其與生物學、免疫學、電化學及材料技術相結合,將會成為檢測農藥殘留的重要發展趨勢之一。其他的方法像分子印跡技術、核磁共振技術和DNA重組技術的發展,也可能會給敵螨普及硝苯菌酯農藥殘留的檢測帶來新的技術上和理論上的突破。
[參考文獻]
[1] 趙民娟, 邵華, 檀思佳, 等. 農產品中展青霉素限量標準及檢測技術研究進展[J]. 分析試驗室,2019,38(8):1004-1008.
[2] 高磊. 食品安全標準對我國果蔬產品出口持續期的影響[J]. 國際經貿探索,2018,34(3):64-76.
[3] 馬立紅. 蔬菜中農藥殘留問題的現狀和對策[J]. 江西農業,2019(14):35.
[4] 劉娟, 劉雪. 我國果蔬農藥殘留現狀研究的文獻綜述[J]. 現代經濟信息,2019(16):328-329+332.
[5] 祝文峰, 李太平. 基于文獻數據的我國蔬菜農藥殘留現狀研究[J]. 經濟問題,2018(11):92-98.
[6] 張婧雯, 張海超, 王敬. 通過型固相萃取-液相色譜-高分辨質譜法快速測定糧谷中17種酰胺類農藥殘留量[J]. 分析試驗室,2020,39(2):154-160.
[7] KURUP S, PILLAI A K. A simple spectrophotometric determination of meptyldinocap by its hydrolysis[J]. Acta Chim Slov, 2013,60(1):81-86.
[8] 孔光輝, 師君麗, 李勇. QuEChERS-UHPLC-MS/MS法測定煙草中硝苯菌酯[J]. 分析試驗室,2018,37(9):1062-1065.
[9] 徐守林. 殺螨殺菌劑二硝巴豆酸酯的合成[J]. 現代農藥,2011,10(2):14-16.
[10] GRAY L E, ROGERS J M, OSTBY J S, et al. Prenatal dinocap exposure alters swimming behavior in mice due to complete otolith agenesis in the inner ear[J]. Toxicology and Applied Pharmacology, 1988, 92(2).266-273.
[11] ROGERS J M, BARBEE B, BURKHEAD L M, et al. The mouse teratogen dinocap has lower A/D ratios and is not teratogenic in the rat and hamster[J]. Birth Defects Research Part A Clinical & Molecular Teratology,2010,37(6):553-559.
[12] CERNOHLVKOVJITKA, JARKOVSK Y′JIR, HOFMAN JAKUB. Effects of fungicides mancozeb and dinocap on carbon and nitrogen mineralization in soils[J]. Ecotoxicology and Environmental Safety,2009,72(1):80-85.
[13] SEDLKOV B, LEBEDA A. Fungicide resistance in Czech populations of cucurbit powdery mildews[J]. Phytoparasitica, 2008, 36(3):272-289.
[14] OLIVEIRA D D S, LOBATO A L, RIBEIRO S M R, et al. Carotenoids and Vitamin C during Handling and Distribution of Guava (Psidium guajava L.), Mango (Mangifera indica L.), and Papaya (Carica papaya L.) at Commercial Restaurants[J]. Journal of Agricultural & Food Chemistry, 2010,58(10):6166-6172.
[15] 陶氏益農Karamat M獲意大利批準上市[J]. 山東農藥信息, 2010(3):50.
[16] GRIGORIU N, CALIN C, SCAETEANU G V, et al. Monitoring the breakdown of dinocap in spiked soil,wine and grape samples by GC/MS and FTIR/ATR[J]. Environmental Engineering and Management Journal, 2018, 17(9): 2179-2188.
[17] DI BELLA G, SAITTA M, SALVO F, et al. Gas chromatographic determination of azoxystrobin, dinocap, fenarimol, penconazole and quinoxyfen during wine making[J]. Italian Journal of Food Science, 2003,15(3):427-432.
[18] HEIMLICH F, DAVIES A N, KUCKUK R, et al. Identification of Dinocap in water using GC/IR and GC/MS[J]. FreseniusJ Anal Chem, 1995(352):743.
[19] 景贊, 劉超, 劉曉碧. 固相萃取-三重四級桿氣質聯用法測定油桃中硝苯菌酯[J].中國果菜,2019,39(9):28-30+40.
[20] SCHENCK F J, HENNESSY M K. Determination of Dinocap in Apples, Grapes, and Pears Using A Solid Phase Extraction Cleanup and HPLC-UV Detection[J]. Journal of Liquid Chromatography,1993,16(3):755-766.
[21] LIANG D X, SHIGA N, MATANO O, et al. Simultaneous determination of four active ingredients of dinocap in crops by high-performance liquid chromatography[J]. Journal of Chromatography A, 1987(387):385-392.
[22] JOHANSSON C E. Two improved methods for the determination of dinocap in fruits and vegetables[J]. Pesticide Science, 1975(6):97
[23] 張志勇, 單煒力, 簡秋, 等. 液相色譜-串聯質譜法測定蔬菜和水果中硝苯菌酯的殘留量[J]. 色譜,2012,30(9):962-965.
[24] MANDAL S, KANRAR B, DAS S, et al. Analytical method validation for the determination of meptyldinocap as 2,4-dinitrooctylphenol metabolite in mango and soil using LC-MS/MS and dissipation study of the fungicide in Indian mango field ecosystem[J]. Journal of Agricultural & Food Chemistry, 2010, 58(16):8911-8917.
[25] ALEXANDER L, ANJA B, ROBERT L, et al. Analysis of Dinocap and Meptyldinocap by modified QuEChERS[EB/OL].[2020-05-28].http://www.eurl_pesticides.eu/userfiles/file/EurlSRM/EPRW2016_Lemke_PD_060_Dinocap. Pdf.
[26] BANERJEE K, DASGUPTA S, JADHAV M R. A fast, inexpensive, and safe method for residue analysis of meptyldinocap in different fruits by liquid chromatography/tandem mass spectrometry[J]. J AOAC Int, 2010, 93(6):1957-1964.
[27] KURUP S, PILLAI A K. A simple spectrophotometric determination of meptyldinocap by its hydrolysis[J]. Acta chimica Slovenica, 2013, 60(1):81-86.
[28] JANSSONA C, PIHLSTROM T, OSTERDAHL B G, et al. A new multi-residue method for analysis of pesticide residues in fruit and vegetables using liquid chromatography with tandem mass spectrometric detection[J]. Journal of Chromatography A, 2004(1023):93.
[29] GOLGE O, KABAK B. Determination of 115 pesticide residues in oranges by high-performance liquid chromatography -triple-quadrupole mass spectrometry in combination with QuEChERS method[J].Journal of Food Composition and Analysis, 2015(41):86-97.
[30] GOLGE O, KABAK B. Evaluation of QuEChERS sample preparation and liquid chromatography- triple- quadrupole mass spectrometry method for the determination of 109 pesticide residues in tomatoes[J]. Food Chemistry,2015(176):319-332.
[31] 符靖雯, 林玉嬋, 黃子敬, 等. QuEChERS結合UHPLC-MS/MS及GC-MS/MS測定黃秋葵中多種農藥殘留[J]. 分析試驗室, 2017, 36(5): 452-464.
[32] CARVALHO GUEDES J A, SILVA R D O, LIMA C G, et al. Matrix effect in guava multiresidue analysis by QuEChERS method and gas chromatography coupled to quadrupole mass spectrometry[J]. Food Chemistry,2016(199):380-386.
[33] RIZZETTI T M, KEMMERICH M, MARTINS M L, et al. Optimization of a QuEChERS based method by means of central composite design for pesticide multiresidue determination in orange juice by UHPLC-MS/MS[J]. Food Chemistry, 2016(196):25-33.
[34] 倪佳. 農產品中農藥殘留檢測技術研究進展及發展趨勢[J]. 農業與技術,2020,40(2):49-50.
(責任編輯 ?李亞青)

