大刺鰍促黃體生成素基因克隆及其組織表達分析
黃小琪 鐘東明 何佩瑩 張明清 周惠強 舒琥


摘要:【目的】克隆大刺鰍(Mastacembelus armatus)促黃體生成素(LH)基因及明確其表達規律,為進一步闡明LH基因在大刺鰍性腺發育過程中的生理功能及揭示大刺鰍的生殖調控機理提供參考依據。【方法】采用RACE克隆大刺鰍LH基因cDNA全長序列,從GenBank中選擇硬骨魚類、兩棲動物、鳥類和哺乳動物等物種的LH氨基酸序列,通過ClustalX 2.1進行氨基酸序列比對,以MEGA 6.0中的鄰接法(NJ)構建系統發育進化樹,并應用實時熒光定量PCR檢測分析大刺鰍LH基因在不同組織及不同性腺發育期的表達情況。【結果】大刺鰍LH基因cDNA序列全長799 bp,包括224 bp的5'非編碼區(5'-UTR)、131 bp的3'非編碼區(3'-UTR)和444 bp的開放閱讀框(ORF),共編碼147個氨基酸殘基,第1~22位氨基酸殘基組成其信號肽區域。大刺鰍LH氨基酸序列C-末端區域高度保守,但N-末端區域與其他硬骨魚類、兩棲動物、鳥類和哺乳動物存在明顯差異。大刺鰍LH氨基酸序列與其他魚類的LH氨基酸序列同源性較高,其中與黃鱔(Monopterus albus)的親緣關系最近。大刺鰍LH基因在其腦組織中的相對表達量最高,顯著高于在其他組織中的相對表達量(P<0.05);在卵巢、心臟、肝臟和精巢中的相對表達量次之;大刺鰍LH基因在不同發育期卵巢和精巢中的表達變化趨勢一致,從II期開始其相對表達量隨之增加,至V期時達峰值。【結論】大刺鰍LH氨基酸序列具有高度保守區域,其基因在各組織中廣泛表達,尤其在腦組織和性腺中具有較高表達量,提示LH的靶基因可能在腦—垂體—性腺軸上,參與大刺鰍的性腺發育調控,主要促進卵母細胞和精子成熟并刺激排卵或排精。
關鍵詞: 大刺鰍;促黃體生成素(LH);性腺發育;基因克隆;組織表達
中圖分類號: S965.199? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼: A 文章編號:2095-1191(2020)07-1706-08
Abstract:【Objective】To clone luteinizing hormone(LH) gene from Mastacembelus armatus and clarify its expre-ssion rules, which could provide the reference for further elucidating the physiological functions of LH gene in the development of gonads and revealing the mechanism of reproductive regulation. 【Method】In this experiment, the full-length cDNA of M. armatus was cloned through the RACE techniques. The LH amino acid sequence of bony fish, amphibians, birds and mammals from GenBank were chosen while the amino acid sequence alignment was performed by ClustalX 2.1. Using the method of neighbour-joining(NJ) of MEGA 6.0 to construct the phylogenetic trees and the expression of LH gene in various tissues and at different gonads development stages were detected through qRT-PCR techniques. 【Result】The full length cDNAsequence of LH gene was 799 bp, including a 5' non-coding region(5'-UTR) of 224 bp, a 3'-UTR of 131 bp, and an open reading frame(ORF) of 444 bp. A total of 147 amino acid residues were encoded, and amino acid residues at positions 1-22 formed the signal peptide region. The C-terminal region of LH amino acid sequence of M. armatus was highly conserved, but the N-terminal region was different from that of other bony fish, amphibians, birds and mammals. The amino acid sequence of LH of M. armatus was highly homologous with that of other fishes, among which the closest relative was Monopterus albus. The relative expression level of LH gene of M. armatus was the highest in its brain tissue, which was significantly higher than that in other tissues(P<0.05). The relative expression in ovary, heart, liver and testis were followed behind brain. The expression of LH gene in ovary and testis of M. armatus showed the same trend at different developmental stages, and its relative expression increased from stage II to the peak at stage V. 【Conclusion】The LH amino acid sequences of the M. armatus have highly conserved regions and are widely expressed in various tissues, especially in the brain and gonads, which suggests that the target gene of LH might be on the brain-pituitary-gonadal axis and participate in the regulation of gonadal development of M. armatus. It mainly promotes oocyte and sperm maturation and stimulates ovulation and ejaculation.
Key words: Mastacembelus armatus; luteinizing hormone(LH); gonadal development; gene cloning; tissue expression
Foundation item: China-ASEAN Maritime Cooperation Foundation(Waicaihan〔2017〕513);Guangdong Marine Fishery Science and Technology Research and Development Project(A201601A05);Guangdong Marine and Fishery Development Special Project(2017A0007)
0 引言
【研究意義】大刺鰍(Mastacembelus armatus)隸屬于合鰓目(Synbranchiformes)刺鰍科(Mastacembelidae)刺鰍屬(Mastacembelus),廣泛分布在東南亞地區及我國長江以南的各大水系,其肉質鮮美,營養豐富,深受消費者青睞,是一種重要的淡水經濟魚類(趙子明和劉美劍,2017;周惠強,2019)。近年來,由于過度捕撈及生態環境惡化,我國大刺鰍野生資源急劇減少,福建、廣東、湖南等省已將其列為重點保護野生水生動物(楊華強等,2016;舒琥等,2017)。因此,加強大刺鰍生殖調控機理研究,對其種質資源的保護和利用具有重要意義。【前人研究進展】至今,針對大刺鰍的研究主要集中在生物學特征(黃永春,1999;初慶柱等,2009)、人工繁殖技術(薛凌展,2016;曾慶祥等,2016)及遺傳多樣性分析(林婷婷,2017;江小璐,2018;舒琥等,2017;周惠強等,2019)等方面,有關其生殖調控相關基因的研究尚無報道。促黃體生成素(Luteinizing hormone,LH)是由腦垂體前葉細胞分泌,通過血液循環到達性腺及其他組織的一類糖蛋白激素(Hurvitz et al.,2005;曹洪濤,2010)。Prat等(1996)采用放射免疫法測定虹鱒魚(Oncorhynchus mykiss)的促性腺激素(GTH),結果發現LH在性腺成熟時大量分泌并達峰值,其生物學功能是主要刺激7α,20β-二羥黃體酮生成,從而促使卵母細胞和精子成熟并刺激排卵和排精。也有研究證實,大馬哈魚(Oncorhynchus keta)存在2種不同類型的GTH,其表達形式及在不同發育時期的表達水平也存在明顯差異,其中LH主要調控性腺成熟及排精/排卵(Schulz et al.,2001,2002;Swanson et al.,2003)。目前,已從條紋狼鱸(Morone saxatilis)(Ha-ssin et al.,1995)、金頭鯛(Sparus aurata)(Elizur et al.,1996)、金魚(Carassius auratus)(Yoshiura et al.,1997)、真鯛(Pagrosomus major)(Gen et al.,2000)、半滑舌鰨(Cynoglossus semilaevis Gunther)(柳學周等,2014)及撫仙金線鲃(Sinocyclocheilus tingi)(楊國坤等,2016)等幾十種魚類中成功克隆獲得LH基因,為揭示魚類性腺發育的分子機制奠定了基礎。【本研究切入點】LH對魚類的生殖調控具有重要作用,但在大刺鰍上的研究至今鮮見報道。【擬解決的關鍵問題】采用RT-PCR和cDNA末端快速擴增技術(RACE)克隆大刺鰍LH基因全長cDNA序列,并以實時熒光定量PCR檢測分析大刺鰍LH基因在不同組織及不同性腺發育期的表達情況,為進一步闡明LH基因在大刺鰍性腺發育過程中的生理功能及揭示大刺鰍的生殖調控機理提供參考依據。
1 材料與方法
1. 1 試驗材料
供試大刺鰍采自云南瀾滄江,體長270±5 mm,體質量150±5 g。選取3尾成年健康大刺鰍,以MS-222(50 mg/L)麻醉后進行解剖,采集腦組織、性腺、心臟、肝臟、脾臟、腎臟、腸道、胃、鰓組織和眼睛等組織樣品,置于RNA Keeper(R501-01,南京諾維贊生物科技有限公司)中,液氮速凍后-80 ℃保存備用。同時選擇不同性腺繁殖周期的大刺鰍(體長200±5 mm,體質量100±5 g),用MS-222麻醉后解剖采集卵巢和精巢,置于RNA Keeper中,液氮速凍后-80 ℃保存備用。
1. 2 總RNA提取及cDNA合成
采用RNAprep pure動物組織試劑盒[DP431,天根生化科技(北京)有限公司]從大刺鰍不同組織中提取總RNA,用1.2%瓊脂糖凝膠電泳檢測RNA完整性,并以酶標儀(1807035,美國BioTek公司)檢測其濃度和純度。
1. 3 大刺鰍LH基因克隆及序列分析
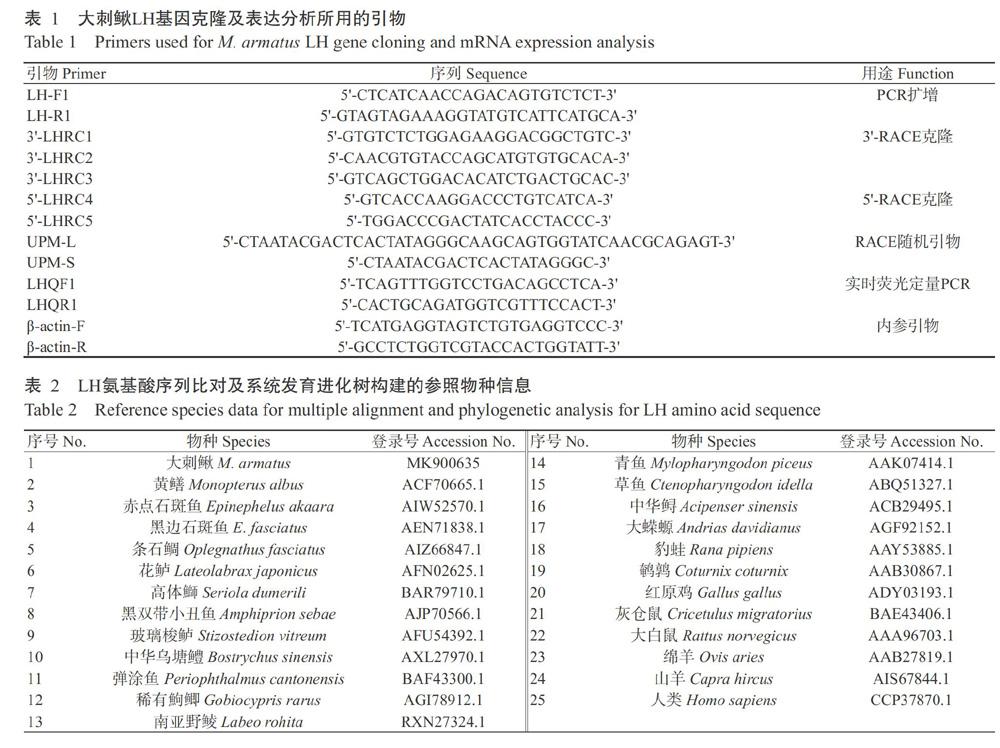
通過同源克隆獲得大刺鰍LH基因的中間部分序列,然后根據中間部分序列設計引物LHRC1、LHRC2、LHRC3、LHRC4和LHRC5(表1),采用Pri-meScript Ⅱ1st Strand cDNA Synthesis Kit試劑盒(634860,TaKaRa)反轉錄合成cDNA第一鏈,并以此為模板進行RACE擴增。擴增程序:94 ℃預變性3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,進行40個循環;72 ℃延伸10 min。PCR擴增產物采用1.0%瓊脂糖凝膠電泳進行檢測,目的片段采用DNA凝膠回收試劑盒[生工生物工程(上海)股份有限公司]進行純化,然后連接至pMD19-T載體上,并轉化大腸桿菌DH5α感受態細胞,接種至含氨芐青霉素的固體培養基上,37 ℃培養12~16 h,挑菌擴大培養后通過菌液PCR篩選陽性克隆,送至生工生物工程(上海)股份有限公司測序。
將獲得的正向和反向序列在NCBI數據庫中進行同源性比對,使用SeqMan Pro Version 7.1.0對中間片段序列、正向和反向序列進行剪切拼接(周惠強,2019),以獲得大刺鰍LH基因全長cDNA序列。使用NCBI數據庫中的BLAST對大刺鰍LH基因全長cDNA序列進行同源性比對,以DNAMAN 6.0推導其氨基酸序列;從GenBank中選擇硬骨魚類、兩棲動物、鳥類和哺乳動物等物種的LH氨基酸序列(表2),應用ClustalX 2.1進行LH氨基酸序列比對,具體操作為:選擇比對模型Multiple Alignment Mode(多序列比對),默認參數設置,選用Do Complete Alignment(進行完全比對),比對結果以BOXSHADE Server進行著色處理。采用Multiple Sequence Alignment by CLUSTALW進行物種同源性比對,并以MEGA 6.0中的鄰接法(Neighbor-joining,NJ)構建系統發育進化樹,選擇模型為Poisson Correction(泊松修正),自引導檢驗(Bootstrap)設為1000。
1. 4 大刺鰍LH基因表達分析
采用實時熒光定量PCR對大刺鰍LH基因在不同組織及不同性腺發育期的表達情況進行檢測分析。按照HiScript[?] II Q RT SuperMix for qPCR(R223-01,南京諾維贊生物科技有限公司)說明反轉錄合成cDNA。以β-actin基因為內參基因、LHQF1和LHQR1為擴增引物(表1),采用ChamQTM SYBR? q-PCR Master Mix(Q311-02,南京諾維贊生物科技有限公司)試劑盒在LightCycler 480熒光定量PCR儀上進行操作,所用樣品設3個重復。使用2?ΔΔCt法換算目的基因的相對表達量(Livak and Schmittgen,2001),并以SPSS 19.0進行單因素方差分析(One-way ANOVA)和Duncans多重比較。
2 結果與分析
2. 1 大刺鰍LH基因全長cDNA序列及系統發育進化分析結果
大刺鰍LH基因cDNA序列全長799 bp(登錄號MK900635),包括224 bp的5'非編碼區(5'-UTR)、131 bp的3'非編碼區(3'-UTR)和444 bp的開放閱讀框(ORF),共編碼147個氨基酸殘基(圖1)。利用SignalP 3.0 Server對大刺鰍LH基因的編碼氨基酸序列進行信號肽預測,結果顯示第1~22位氨基酸殘基組成其信號肽區域。大刺鰍LH氨基酸序列與其他魚類的同源性較高,其中,與黃鱔(M. albus)和赤點石斑魚(E. akaara)的同源性高達87%,與青魚(M. piceus)的同源性為56%;與兩棲動物大蠑螈(A. davidia-nus)和鳥類紅原雞(G. gallus)的同源性分別為48%和39%;與哺乳動物山羊(C. hircus)、灰倉鼠(C. migratorius)及人類(H. sapiens)的同源性分別為34%、34%和35%。根據LH氨基酸序列比對分析結果可知,大刺鰍LH氨基酸序列C-末端區域高度保守,但N-末端區域與其他硬骨魚類、兩棲動物、鳥類和哺乳動物存在明顯差異(圖2)。基于LH氨基酸序列同源性構建的系統發育進化樹(圖3)也顯示,大刺鰍與其他魚類聚為一支,其中與黃鱔的親緣關系最近;與魚類、兩棲動物、鳥類和哺乳動物的親緣關系越來越遠,與傳統的形態學分類結果一致。
2. 2 大刺鰍LH基因的組織表達分布情況
實時熒光定量PCR檢測結果(圖4)顯示,大刺鰍LH基因在其腦組織中的相對表達量最高,顯著高于在其他組織中的相對表達量(P<0.05,下同);在卵巢、心臟、肝臟和精巢中的相對表達量次之,且在這4種組織中的相對表達量無顯著差異(P>0.05,下同);大刺鰍LH基因在其他組織中的相對表達量較低。
2. 3 大刺鰍LH基因在性腺不同發育期的表達情況
在雌性大刺鰍中,隨著卵巢的不斷發育成熟,從II期開始LH基因的相對表達量隨之增加,但仍處于較低水平;至IV期顯著升高,V期的相對表達量達峰值,顯著高于其他發育期;至VI期LH基因的相對表達量顯著降低,與II期和III期的相對表達量無顯著差異(圖5)。在雄性大刺鰍中,隨著精巢的不斷發育成熟,從II期開始LH基因的相對表達量也隨之增加,但仍處于較低水平;至IV期顯著升高,V期的相對表達量最高,顯著高于其他發育期;至VI期LH基因的相對表達量也顯著降低,但仍高于II期和III期的相對表達量(圖6)。可見,大刺鰍LH基因在卵巢和精巢的表達變化趨勢一致。
3 討論
本研究成功克隆獲得大刺鰍LH基因全長cDNA序列,并對其推導氨基酸序列進行同源性比對分析,結果顯示,大刺鰍LH氨基酸序列與合鰓目中的黃鱔、鱸形目中的赤點石斑魚和花鱸的同源性較高,但與鯉形目中的青魚和草魚的同源性較低;基于LH氨基酸序列同源性構建的系統發育進化樹也顯示,大刺鰍與合鰓目中的黃鱔、鱸形目的赤點石斑魚和花鱸等魚類聚為一支,與傳統的形態學分類結果一致。大刺鰍LH基因的ORF包含12個半胱氨酸(Cys)殘基和1個N-糖基化位點(第42~44位氨基酸),與中華鱘(Cao et al.,2009)、南方鯰(Southern catfish)(Wu et al.,2009)、半滑舌鰨(柳學周等,2014)和撫仙金線鲃(楊國坤等,2016)的研究結果相似;與其他物種的LH氨基酸序列比對分析結果顯示,大刺鰍LH氨基酸序列C-末端區域高度保守,說明大刺鰍LH與其他脊椎動物的LH具有相似功能。
運用熒光實時定量PCR檢測LH基因在大刺鰍各組織中的表達情況,結果顯示,大刺鰍LH基因在所有組織中均有所表達,與金頭鯛(Wong and Zohar,2004)和斑馬魚(Danio rerio)(So et al.,2005)的研究結果相似。大刺鰍LH基因在其腦組織中的相對表達量最高,其次是在卵巢、心臟、肝臟和精巢中。在性腺和腦組織中高表達,暗示LH的靶基因可能在腦—垂體—性腺軸上,參與大刺鰍的性腺發育調控。本研究還對大刺鰍LH基因在不同發育期卵巢和精巢中的表達情況進行分析,結果發現大刺鰍的卵巢和精巢發育至II期時,LH基因的相對表達量還很低,隨后的相對表達量逐漸穩步上升,直到IV~V期其相對表達量急劇增加,在V期時達峰值。這與虹鱒魚(Natio et al.,1991;Prat et al.,1996;Gomez et al.,1999)和許氏平鲉(Sebastes schlegeli)(Kim et al.,2005)的研究結果一致,說明LH主要促進卵母細胞和精子成熟并刺激排精或排卵。半滑舌鰨LH基因在卵巢VI期的表達量顯著低于其他發育期(柳學周等,2014),而大刺鰍LH基因的最低表達量出現在卵巢Ⅱ期。由此可見,LH基因在性腺中的表達模式具有種間差異性。
本研究通過RACE克隆得到大刺鰍LH基因全長cDNA序列,對其進行氨基酸序列比對分析,并通過熒光實時定量PCR檢測大刺鰍LH基因在不同組織中的特異性表達及在性腺不同發育期的表達變化情況,為進一步闡明LH基因的生理功能打下了基礎,同時為揭示大刺鰍性腺發育調控機理提供了理論依據。
4 結論
大刺鰍LH氨基酸序列具有高度保守區域,其基因在各組織中廣泛表達,尤其在腦組織和性腺中具有較高表達量,提示LH的靶基因可能在腦—垂體—性腺軸上,參與大刺鰍的性腺發育調控,主要促進卵母細胞和精子成熟并刺激排卵或排精。
參考文獻:
曹洪濤. 2010. 齊口裂腹魚(Schizothorax prenanti)FSHβ亞基與LHβ亞基cDNA全序列克隆及生物信息學分析[D]. 雅安:四川農業大學. [Cao H T. 2010. Molecular cloning cDNAs and Bioinformation analysis of follicle-stimula-ting hormone(FSH)-β subunit and luteinizing hormone (LH)-β subunit of Schizothorax prenanti[D]. Ya?an:Sichuan Agricultural University.]
初慶柱,陳剛,張健東,潘傳豪,周暉. 2009. 大刺鰍消化系統的組織學研究[J]. 淡水漁業,39(2):14-18. [Chu Q Z,Chen G,Zhang J D,Pan C H,Zhou H. 2009. Histological studies on digestive system of Mastacembelus armatus[J]. Freshwater Fisheries,39(2):14-18.]
黃永春. 1999. 汀江大刺鰍食性和繁殖生物學[J]. 水產學報,23(S):1-6. [Huang Y C. 1999. Feeding habit and reproductive biology of Mastacembelus armatus in Tingjiang river[J]. Journal of Fisheries of China,23(S):1-6.]
江小璐. 2018. 華南及鄰近地區不同群體大刺鰍的遺傳多樣性及親緣地理研究[D]. 廣州:廣州大學. [Jiang X L. 2018. Genetic diversity and phylogeography of different populations of Mastacembelus armatus in Southern China and its adjacent areas[D]. Guangzhou:Guangzhou University.]
林婷婷. 2017. 大刺鰍(Mastacembelus armatus)微衛星標記開發及野生群體遺傳多樣性分析[D]. 廣州:廣州大學. [Lin T T. 2017. Isolation of microsatellite markers and population genetic diversity analysis in Mastacembelus armatus[D]. Guangzhou:Guangzhou University.]
柳學周,史寶,王珊珊,徐永江,李曉曉. 2014. 半滑舌鰨促黃體激素基因克隆和表達分析及其血清濃度測定[J]. 中國工程科學,16(9):50-60. [Liu X Z,Shi B,Wang S S,Xu Y J,Li X X. 2014. Full length cDNA cloning and expre-ssion of luteinizing hormone(LH) and which serum concentration was measured in half smooth tongue sole Cynoglossus semilaevis Günther[J]. Engineering Sciences,16(9):50-60.]
舒琥,江小璐,楊華強,林婷婷,周惠強,張明清,查廣才. 2017. 華南地區7個大刺鰍野生群體的形態差異分析[J]. 廣州大學學報(自然科學版),16(3):8-14. [Shu H,Jiang X L,Yang H Q,Lin T T,Zhou H Q,Zhang M Q,Zha G C. 2017. Analysis of morphological variations among seven wild populations of Mastacembelus armatus in South China area[J]. Journal of Guangzhou University(Natural Science Edition),16(3):8-14.]
薛凌展. 2016. 大刺鰍胚胎發育觀察[J]. 淡水漁業,44(2):101-104. [Xue L Z. 2016. Observation on the embryonic development of Mastacembelue armatus[J]. Freshwater Fisheries,44(2):101-104.]
楊國坤,關佳佳,孫彩云,王曉愛,潘曉賦,楊君興,李文笙. 2016. 撫仙金線鲃促性腺激素亞基基因克隆及組織表達分析[J]. 四川動物,35(5):686-690. [Yang G K,Guan J J,Sun C Y,Wang X A,Pan X F,Yang J X,Li W S. 2016. Gonadotropin subunits cDNA cloning and tissue expression in Sinocyclocheilus tingi[J]. Sichuan Journal of Zoology,35(5):686-690.]
楊華強,李強,舒琥,岳磊,林婷婷,劉遠波. 2016. 華南及鄰近地區大刺鰍遺傳多樣性的ISSR分析[J]. 水生生物學報,40(1):63-70. [Yang H Q,Li Q,Shu H,Yue L,Lin T T,Liu Y B. 2016. Genetic diversity of Mastacembelus armatus in Southern China and surrounding areas based on ISSR analysis[J]. Acta Hydrobiologica Sinica,40(1):63-70.]
曾慶祥,方園,曾學平,劉斌,劉德亭,張建銘,張家海,黃雅貞. 2016. 大刺鰍的生物學特性與人工繁養殖技術[J]. 中國水產,(3):70-73. [Zeng Q X,Fang Y,Zeng X P,Liu B,Liu D T,Zhang J M,Zhang J H,Huang Y Z. 2016. Bio-logical characteristics and artificial breeding technology of Mastacembelus armatus[J]. China Fisheries,(3):70-73.]
趙子明,劉美劍. 2017. 我國刺鰍生物學研究進展[J]. 江蘇農業科學,45(4):9-12. [Zhao Z M,Liu M J. 2017. Research progress of biology of Mastacembelus aculeatus in China[J]. Jiangsu Agricultural Sciences,45(4):9-12.]
周惠強,李芬,舒琥,鐘東明,何佩瑩,黃小琪,陳忠凱. 2019. 大刺鰍雌雄個體形態差異分析[J]. 廣東海洋大學學報,39(1):1-6. [Zhou H Q,Li F,Shu H,Zhong D M,He P Y,Huang X Q,Chen Z K. 2019. Analysis on morphological indexes and discrimination of male and female Mastacembelus armatus[J]. Journal of Guangdong Ocean University,39(1):1-6.]
周惠強. 2019. 大刺鰍(Mastacembelus armatus)繁殖生物學研究[D]. 廣州:廣州大學. [Zhou H Q. 2019. Reproductive biology of Mastacembelus armatus[D]. Guangzhou:Guangzhou University.]
Cao H,Zhou L,Zhang Y Z,Wei Q W,Chen X H,Gui J F. 2009. Molecular characterization of Chinese sturgeon gonadotropins and cellular distribution in pituitaries of mature and immature individuals[J]. Molecular and Cellular Endocrinology,303(1-2):34-42.
Elizur A,Zmora N,Rosenfeld H,Meiri I,Hassin S,Gordin H,Zohar Y. 1996. Gonadotropins β-GtH I and β-GtH II from the gilthead seabream,Sparus aurata[J]. General and Comparative Endocrinology,102(1):39-46.
Gen K,Okuzawa K,Senthilkumaran B,Tanaka H,Moriyama S,Kagawa H. 2000. Unique expression of gonadotropin-I and -II subunit genes in male and female red seabream (Pagrus major) during sexual maturation[J]. Biology of Reprodution,63(1):308-319.
Gomez J M,Well C,Ollitrault M,Le Bail P Y,Breton B,Le Gac F. 1999. Growth hormone(GH) and gonadotropin subunit gene expression and pituitary and plasma changes during spermatogenesis and oogenesis in rainbow trout (Oncorhynchus mykiss)[J]. General and Comparative En-docrinology,113(3):413-428.
Hassin S,Elizur A,Zohar Y. 1995. Molecular cloning and sequence analysis of striped bass(Morone saxatilis) gona-dotrophin-I and -II subunits[J]. Journal of Molecular Endocrinology,15(1):23-35.
Hurvitz A,Degani G,Goldberg D,Din S Y,Jackson K,Sivan B L. 2005. Cloning of FSHβ,LHβ,and glycoprotein α subunits from the Russian sturgeon(Acipenser gueldenstaedtii),β-subunit mRNA expression,gonad development,and steroid levels in irnrnature fish[J]. General and Comparative Endocrinology,140(1):61-73.
Kim D J,Cho Y C,Sohn Y C. 2005. Molecular characterization of rockfish(Sebastes schlegeli) gonadotropin subunits and their mRNA expression profiles during oogenesis[J]. General and Comparative Endocrinology,141(3):282-290.
Livak K J,Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2?△△Ct method[J]. Methods,25(4):402-408.
Natio N,Hyodo S,Okumoto N,Urano A,Nakai Y. 1991. Di-fferential production and regulation of gonadotropins (GTH I and GTH II) in the pituitary gland of rainbow trout, Oncorhynchus mykiss,during ovarian development[J]. Cell and Tissue Research,266(3):457-467.
Prat F,Sumpter J P,Tyler C R. 1996. Validation of radioimmunoassay for two salmon gonadotropins(GTH I and GTH II) and their plasma concentrations throughout the reproductive cycle in male and female rainbow trout(Oncorhynchus mykiss)[J]. Biology of Reproduction,54(6):1375-1382.
Schulz R W,Miura T. 2002. Spermatogenesis and its endocrine regulation[J]. Fish Physiology and Biochemisty,26(1):43-56.
Schulz R W,Viseher H F,Cavaco J E,Santos E M,Tyler C R,Goos H J,Bogerd J. 2001. Gonadotropins,their receptors,and the regulation of testicular functions in fish[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry & Molecular Biology,129(2-3):407-417.
So W K,Kwok H F,Ge W. 2005. Zebrafish gonadotropins and their receptors:II. Cloning and characterization of zebrafish follicle-stimulating hormone and luteinizing hormone subunits—Their spatial-temporal expression patterns and receptor specificity[J]. Biology of Reproduction,72(6):1382-1396.
Swanson P,Dickey J T,Campbell B. 2003. Biochemistry and physiology of fish gonadotropins[J]. Fish Physiology and Biochemistry,8(1-4):53-59.
Wong T T,Zohar Y. 2004. Novel expression of gonadotropin subunit genes in oocytes of the gilthead seabream(Sparus aurata)[J]. Endocrinology,145(11):5210-5220.
Wu F R,Zhang X Y,Zhang W L,Huang B F,Liu Z H,Hu C J,Wang D S. 2009. Expression of three gonadotropin subunits in Southern catfish gonad and their possible roles during early gonadal development[J]. Comparative Biochemistry and Physiology. Part A:Molecular & Integrative Physiology,153(1):44-48.
Yoshiura Y,Kobayashi M,Kato Y,Aida K. 1997. Molecular cloning of the cDNAs encoding two gonadotropin beta subunits(GTH-I beta and -II beta) from the goldfish,Cara-ssius auratus[J]. General and Comparative Endocrinology,105(3):379-389.
(責任編輯 蘭宗寶)

