豬USP18基因表達規律及其與產仔數性狀的關聯分析
周泉勇 萬明春 季華員 劉晨龍 方紹培 黃江南


摘要:【目的】明確泛素特異性蛋白酶18基因(USP18)在豬不同妊娠時期子宮內膜中的表達規律及其與雌激素和孕激素的關系,并分析其多態性與產仔數性狀的關聯性,為揭示USP18基因在豬妊娠過程中的作用機理提供參考依據。【方法】PCR擴增豬USP18基因編碼區(CDS)序列及開展相關生物信息學分析,利用實時熒光定量PCR檢測USP18基因在梅山豬和大白豬妊娠15、26和50 d子宮內膜中的表達水平,通過體外細胞試驗檢測分析雌二醇和孕酮聯合處理對子宮內膜上皮細胞USP18基因表達的影響,并采用PCR-RFLP和SPSS 19.0檢測豬USP18基因多態性與產仔數性狀的關聯性。【結果】豬USP18基因CDS序列為966 bp,共編碼322個氨基酸殘基,編碼蛋白分子量為37 kD,理論等電點(pI)為6.74;豬USP18氨基酸序列與牛USP18氨基酸序列的同源性為82%,二者的遺傳距離最近。USP18基因在妊娠15和26 d梅山豬和大白豬子宮內膜中的相對表達量均明顯高于妊娠50 d,且在妊娠26和50 d,USP18基因在梅山豬子宮內膜組織中的相對表達量顯著高于在大白豬子宮內膜組織中的相對表達量(P<0.05,下同)。以10-10 mol/L雌二醇和10-8 mol/L孕酮聯合處理子宮內膜上皮細胞,USP18基因在子宮內膜上皮細胞中的相對表達量呈上調趨勢,且顯著高于激素處理前的相對表達量。在豬USP18基因CDS序列953 bp處存在1個SNP位點(T/G錯義突變),其不同基因型與產仔數性狀的關聯分析結果表明,在經產母豬中,TG基因型母豬產活仔數最多,GG基因型母豬產活仔數最少,且差異顯著。【結論】豬USP18基因在附植期子宮內膜中高水平表達,且在子宮內膜上皮細胞中的表達受雌激素和孕激素誘導,表明USP18基因在妊娠早期建立過程中發揮著重要作用。USP18基因在梅山豬和大白豬間的差異表達可能是導致梅山豬產仔數高于大白豬的一個重要因素。
關鍵詞: 豬;USP18基因;子宮內膜;上皮細胞;妊娠;激素
中圖分類號: S828.81? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼: A 文章編號:2095-1191(2020)07-1714-07
Abstract:【Objective】The aim of study was to clarify the expression of porcine ubiquitin specific peptidase 18 gene(USP18) in Meishan pig and Yorkshire pig endometrium during different gestation stages, examine the relationship between its expression and estrogen and progesterone,analyze the association between USP18 gene polymorphism and li-tter size, and thus to provide important data for revealing the role of USP18 gene in the process of pregnancy. 【Method】The PCR was used to amplify protein coding region(CDS) of USP18 gene, and bioinformatics analysis was conducted. Real-time fluorescence quantitative PCR was used to analyze the USP18 gene expression level in endometrium of Meishan pig and Yorkshire pig on 15 d, 26 d and 50 d of pregnancy. The cell transfection technology was used to detected the effect of estradiol and progesterone on the USP18 gene expression in endometrial epithelial cells. The polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP) and SPSS 19.0 software were used to analyze the association between the gene polymorphism of USP18 and reproductive traits. 【Result】The CDS sequence of pig USP18 gene was 966 bp. It encoded 322 amino acids, and the molecular weight and the isoelectric point(pI) were 37 kD and 6.74 respectively. Amino acid sequence of USP18 protein had 82% similarity with cattle, and their genetic distance was the nearest.? The expression level of USP18 gene on day 15 and day 26 of pregnancy were higher compared with day 50 of pregnancy both in Meishan and Yorkshire endometriums, and the expression in Meishan pig endometrium was significantly higher than in Yorkshire pig endometriums both on day 26 and day 50 of pregnancy(P<0.05, the same below). Moreover, treating with 10-10 mol/L estradiol and 10-8 mol/L progesterone in endometrial epithelial cells, the expression of USP18 was induced and was significantly higher than that before hormone treatment. Gene polymorphism analysis indica-ted that USP18 CDS sequence had a SNP site(T/G missense mutation) at 953 bp. The association analysis between various genotypes and litter size traits indicated that among multiparous sows, TG genotpye sows had the largest litter size and GG genotpye sows had the smallest litter size, and with significant difference. 【Conclusion】USP18 gene has high level expression in endometriums during implantation and is induced by estrogen and progesterone. This results indicates that USP18 may play important roles in the establishment of early pregnancy. And the differential expression in endometrium between Meishan pig and Yorkshire pig may be an important reason which leads to the litter size of Meishan pig higher than Yorkshire pig.
Key words: pig; USP18 gene; endometrium; epithelial cells; gestation; hormone
Foundation item: Jiangxi Pig Industry Technology System Construction Project(JXARS-01); Agricultural Research Collaborative Innovation Special Funds of Jiangxi(JXXTCX2015004-001)
0 引言
【研究意義】豬附植期胚胎死亡數通常占整個妊娠期胚胎死亡總數的50%以上,且很大程度上決定了實際窩產仔數(Tayade et al.,2007)。梅山豬是我國優良的地方品種,也是目前世界公認的高產品種(尹洛蓉等,2011;周艷紅等,2015),在附植期間其胚胎死亡率約11%,而大白豬的胚胎死亡率高達31%(Bazer et al.,1988;Ashworth et al.,1997)。胎兒對于母體而言是半同種異基因移植物,其成功附植且不被排斥導致死亡與附植期子宮內膜容受性的建立密切相關(Simón et al.,2000)。妊娠早期,子宮在雌激素和孕激素的協同調控下,通過一系列信號分子的表達變化,促使子宮內膜形態及其功能發生改變,從而促進子宮內膜與胎兒相互作用,是胎兒成功附植的關鍵(Daikoku et al.,2011;付言峰等,2018)。因此,加強附植期子宮內膜相關基因表達及調控研究,可為提高胚胎存活率和母豬窩產仔數提供理論依據。【前人研究進展】已有研究顯示,干擾素在哺乳動物的妊娠識別和維持過程中發揮著重要作用,是通過調控妊娠信號識別、子宮內膜血管發育及免疫基因表達等方式,促使子宮內膜形成一個可接受的植入環境(Bazer et al.,2008,2009)。泛素特異性蛋白酶18(Ubiquitin specific peptidase 18,USP18)是泛素特異性蛋白酶家族成員之一,是一種Ι型干擾素誘導調控因子(姚敏,2018)。USP18基因轉錄啟動子位于干擾素刺激應答反應元件內,因此干擾素可強烈誘發機體表達USP18基因。對多種疾病和癌癥的研究發現,USP18通過不同信號通路反向調節Ι型干擾素在先天免疫中發揮重要作用(Kim et al.,2005;Yan et al.,2007);尤其在癌細胞中,USP18基因下調表達可抑制體外腫瘤細胞增殖及體內腫瘤生長,顯著降低癌細胞的轉移和侵襲能力(Cai et al.,2017)。此外,USP18基因表達下調能抑制血管生成(Burkart et al.,2013)。胚胎附植與腫瘤發生具有極高的相似性,均是細胞發生增殖、遷移及生理性侵襲的生物學過程。在敲除USP18基因的小鼠中,USP18基因缺失使得胎兒植入位點子宮內膜的血管大量減少,胚胎發育中止,進而導致胎兒死亡(Rempel et al.,2007)。在哺乳動物的正常妊娠過程中,USP18基因在妊娠早期子宮內膜中的表達水平明顯高于非妊娠期(Bauersachs et al.,2006;Forde et al.,2011),而在致病性腹瀉病毒感染導致的妊娠期胚胎死亡及子宮內膜異位癥導致的繁殖障礙中,均發現子宮內膜中的USP18基因表達水平顯著降低(Kiba et al.,2015;Cheng et al.,2017)。說明妊娠期間子宮內膜中USP18基因的表達變化可能與胎兒存活密切相關。【本研究切入點】目前,有關USP18基因的研究主要集中在人類、鼠和牛等物種,而針對豬的研究鮮見報道。【擬解決的關鍵問題】PCR擴增豬USP18基因編碼區(CDS)序列,利用實時熒光定量PCR檢測USP18基因在梅山豬和大白豬不同妊娠時期子宮內膜中的表達變化,通過體外細胞試驗分析雌激素和孕激素對子宮內膜上皮細胞中USP18基因表達的影響,并開展與產仔數性狀的關聯分析,為揭示USP18基因在豬妊娠過程中的作用機理提供參考依據。
1 材料與方法
1. 1 試驗材料
選取梅山豬和大白豬初產母豬各6頭,配種后于妊娠15、26和50 d分別進行屠宰。妊娠15 d母豬采用PBS沖洗子宮法確認是否懷孕,然后隨機選取位置收集子宮內膜組織,妊娠26和50 d母豬收集附植點子宮內膜組織,采集的樣本經液氮冷凍后置于-80 ℃冰箱保存。收集廣東華農溫氏畜牧股份有限公司水臺豬場277頭產6胎以上生產母豬的產活仔數(NBA)、總產仔數(TNB)及初生重(BW)等信息,并采集耳組織樣品,浸泡于75%乙醇中備用。用于細胞試驗的子宮內膜上皮細胞由計劃生育生殖生物學國家重點實驗室惠贈;RNA提取試劑盒購自天根生化科技(北京)有限公司,反轉錄試劑盒購自美國Promega公司,PCR純化試劑盒購自北京百特生物科技有限公司,內切酶Bcc I購自MBI Fermentas公司,雌二醇和孕酮購自Sigma公司,SYBR Green Real-time PCR Master Mix試劑盒購自日本TOYOBO公司。
1. 2 組織DNA和RNA提取
采用苯酚—氯仿法提取組織DNA,以總RNA提取試劑盒(DP431)提取總RNA。提取的DNA和RNA采用Thermo Scientific公司的NanoDrop 2000核酸蛋白測定儀測定其濃度。
1. 3 基因表達檢測樣本制備
向DEPC處理無RNase污染的0.2 mL離心管中加入2.0 μg總RNA、0.4 μg Oligo(dT)引物和0.1 μg隨機引物,70 ℃溫育5 min,迅速置于冰上,然后依次加入10.0 μL 5×反轉錄緩沖液、2.5 μL 10 mmol/L dNTP Mix、1.0 μL RNase Inhibitor及1.5 μL M-MLV反轉錄酶(200 U/μL)。樣品混勻離心后37 ℃溫育10 min,42 ℃孵育50 min,85 ℃溫育5 min。反轉錄合成的cDNA置于-20 ℃保存備用。
1. 4 引物設計與合成
在GenBank中搜索豬USP18基因核苷酸序列,使用Primer Premier 5.0設計USP18基因檢測用引物(表1),委托上海英駿生物技術有限公司合成。
1. 5 PCR擴增、測序及生物信息學分析
PCR反應體系25.0 ?L:cDNA模板1.0 ?L(約50 ng),上、下游引物(10 ?mol/L)各1.0 ?L,dNTPs(10 mmol/L)2.0 ?L,10×PCR Buffer 2.5 ?L,Taq DNA聚合酶(5 U/?L)0.2 ?L,滅菌水17.3 ?L。擴增程序:95 ℃預變性5 min;94 ℃ 40 s,56 ℃ 40 s,72 ℃ 30 s,進行38個循環;72 ℃延伸10 min。擴增產物經凝膠電泳檢測后進行回收測序,對測序結果進行拼接,通過NCBI網站的ORF Finder搜索豬USP18基因CDS序列,并進行同源性比對分析。在NCBI網站中搜索人類、小鼠、大鼠、牛、狗及黑猩猩的USP18氨基酸序列,利用DNASTAR中的MegAlign構建系統發育進化樹。
1. 6 實時熒光定量PCR檢測USP18基因表達情況
實時熒光定量PCR反應體系20.0 ?L:cDNA模板0.8 ?L,SYBR Green I Mix 10.0 ?L,上、下游引物各0.4 μmol/L,以無核酸水補足至20.0 ?L。混勻離心后使用ABI 7300實時定量PCR儀同時擴增USP18基因和TBP1基因(內參),擴增程序:95 ℃預變性10 s;95 ℃ 15 s,60 ℃ 30 s,進行40個循環;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s,60 ℃ 1 min。使用USP18基因與TBP1基因的平均Ct差值ΔCt計算USP18基因的相對表達量,再以ΔCt減去ΔCt最大值得到ΔΔCt,通過2-ΔΔCt法分析USP18基因的差異表達情況。
1. 7 細胞培養及轉染
常規方法培養細胞至良好狀態,用含Hyclone胎牛血清(去激素血清)的無酚紅培養基繼續培養3 d后,傳代至6孔板。分別設試驗組和對照組,每組設3個重復,其中,對照組添加0.03%乙醇,試驗組添加10-10 mol/L雌二醇和10-8 mol/L孕酮。培養12、24和48 h后,收集細胞并提取RNA,采用實時熒光定量PCR檢測USP18基因的表達量。
1. 8 PCR-RFLP基因分型及產仔數性狀關聯分析
擴增產物檢測合格后,65 ℃下酶切消化過夜。酶切體系10.0 ?L:擴增模板3.0 ?L,內切酶(10 U/?L)1.5 ?L,滅菌水5.5 ?L。酶切產物經3%瓊脂糖凝膠電泳檢測分型后,統計基因型數據,使用SPSS 19.0中的一般線性模型(GLM)對母豬產仔數性狀與SNP位點分型結果進行最小二乘法分析。一般線性模型為:yi=μ+αi+pk+ei,式中,yi為性狀值,μ為總體平均數,αi為基因型效應值(i=GG,TG,TT),pk為胎次效應(按初產和經產劃分),ei為隨機誤差。
2 結果與分析
2. 1 豬USP18基因序列分離及氨基酸同源性分析結果
利用引物U-CDS1和U-CDS2分別擴增豬USP18基因cDNA序列,克隆測序后拼接得到完整的CDS序列(966 bp),編碼322個氨基酸殘基,編碼蛋白分子量為37 kD,理論等電點(pI)為6.74。與人類及鼠、牛等其他哺乳動物進行USP18氨基酸同源性比對分析,結果(表2)發現豬USP18氨基酸序列與牛和狗的USP18氨基酸序列同源性最高,均為82%;與人類和猩猩的USP18氨基酸序列同源性分別為76%和75%;與小鼠和大鼠的USP18氨基酸序列同源性均為68%。利用MegAlign進行系統發育進化分析,結果(圖1)也顯示豬與牛的遺傳距離最近。
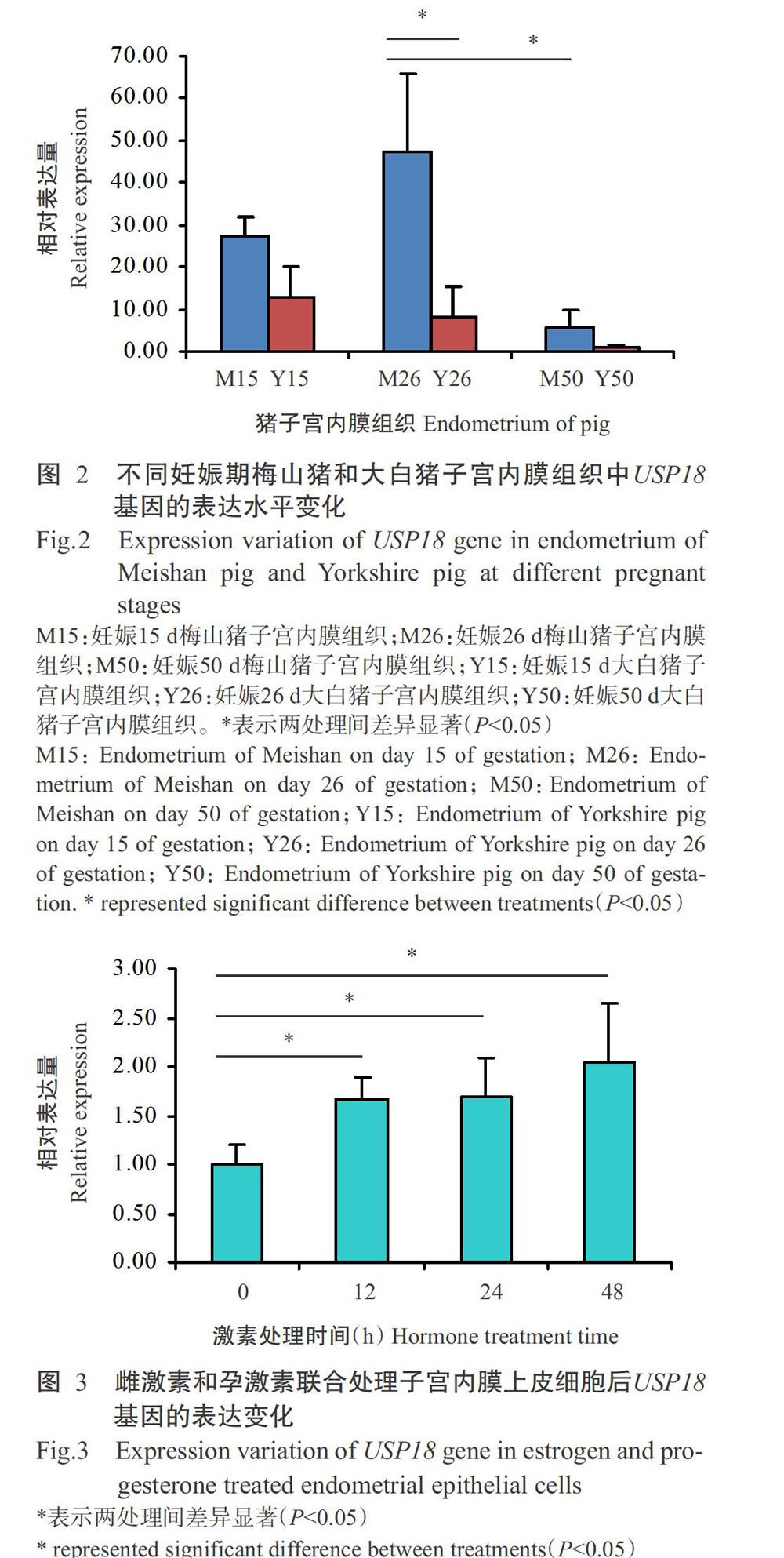
2. 2 豬妊娠期子宮內膜組織中USP18基因表達水平檢測結果
利用實時熒光定量PCR檢測妊娠15、26和50 d梅山豬和大白豬子宮內膜組織中USP18基因的表達水平,結果(圖2)顯示,USP18基因在妊娠15和26 d梅山豬和大白豬子宮內膜中的相對表達量均明顯高于妊娠50 d,且在妊娠26和50 d,USP18基因在梅山豬子宮內膜組織中的相對表達量顯著高于在大白豬子宮內膜組織中的相對表達量(P<0.05,下同)。
2. 3 激素處理子宮內膜上皮細胞后USP18基因的表達變化情況
以10-10 mol/L雌二醇和10-8 mol/L孕酮聯合處理子宮內膜上皮細胞,在處理0、12、24和48 h后分別收集上皮細胞,提取其RNA,再利用實時熒光定量PCR檢測USP18基因的表達水平。結果(圖3)顯示,激素處理12、24和48 h后USP18基因在子宮內膜上皮細胞中的相對表達量呈上調趨勢,且顯著高于激素處理前的相對表達量。
2. 4 豬USP18基因SNP位點驗證及其與產仔數性狀的關聯分析結果
對豬USP18基因測序結果進行比對分析,結果(圖4)發現在豬USP18基因CDS序列953 bp處存在1個SNP位點(T/G錯義突變),導致氨基酸序列第318位由甲硫氨酸(Met)突變為精氨酸(Arg),且被內切酶Bcc I所識別。利用引物U-Bcc I擴增包含SNP位點的基因序列并進行酶切,GG基因型的酶切產物大小為150 bp,TT基因型的酶切產物大小為127 bp(圖5)。進一步利用PCR-RFLP檢測USP18基因T953G位點在277頭長白母豬中的基因型,并以SPSS 19.0分析不同基因型與產仔數性狀的關聯性,結果表明,在初產母豬中,USP18基因T953G位點不同基因型母豬在總產仔數、產活仔數和初生重性狀中不存在顯著差異(P>0.05);而在經產母豬中,TG基因型母豬產活仔數最多,GG基因型母豬產活仔數最少,且差異顯著(表3)。
3 討論
胎兒在附植過程中會導致子宮內膜產生免疫反應。正常妊娠狀態下,子宮內膜中的淋巴細胞由Th1型向Th2型轉換,對胎兒存活并成功附植極其關鍵(Raghupathy et al.,2000)。Th1細胞誘導超敏反應,抑制胚胎在子宮內附植;而Th2細胞促進抗體形成,抑制免疫炎癥,有利于胚胎著床和發育(Aluvihare et al.,2004)。USP18基因是動物體內免疫調節的重要功能基因。在乳腺上皮細胞中,USP18基因缺失會導致Th1細胞趨化因子基因Cxcl10表達增加,從而募集Th1型T淋巴細胞(Burkart et al.,2013)。Tnf-α是Th1型細胞分泌的細胞因子之一,其過量表達會抑制胚胎著床,導致妊娠終止(Li et al.,2017)。USP18基因表達水平上升,可有效抑制Tnf-α表達(MacParland et al.,2016;Shaabani et al.,2018)。說明附植期間USP18基因在子宮內膜中的高水平表達可能有利于胚胎附植。在牛的相關研究中也發現,USP18基因在附植期子宮內膜中的表達水平明顯高于非妊娠時期(Bauersachs et al.,2006;Forde et al.,2011)。本研究利用實時熒光定量PCR檢測分析USP18基因在母豬妊娠15、26和50 d子宮內膜中的表達變化,結果發現USP18基因在妊娠15和26 d梅山豬和大白豬子宮內膜中的相對表達量均明顯高于妊娠50 d。在妊娠過程中,USP18基因在附植時期子宮內膜中的高水平表達是胎兒附植和妊娠建立的關鍵。
豐富的血管有助于子宮內膜對胎兒胎盤的營養供給,從而提高胚胎存活率(Argente et al.,2006)。相對于大白豬等外來品種,梅山豬在妊娠26和50 d的胚胎正常附植點血管豐度明顯更高,可能是導致梅山豬產仔數高于大白豬的一個重要因素(張高英,2009)。已有研究表明,USP18基因可通過抑制Ι型干擾素信號通路而促進血管生成(Hsu et al.,2017)。本研究結果也表明,USP18基因在梅山豬和大白豬附植期子宮內膜中的相對表達量均高于附植完成期,且在妊娠26和50 d梅山豬子宮內膜組織中的相對表達量顯著高于在大白豬子宮內膜組織中的相對表達量。由此推測,USP18基因通過參與妊娠早中期子宮內膜血管發育從而影響胎兒存活。
雌激素和孕激素在妊娠建立過程中發揮著重要作用。在母豬妊娠早期,雌激素和孕激素分泌階段性增加,且梅山豬附植期高胚胎存活率與雌激素和孕激素的高分泌水平密切相關(Hunter et al.,1996)。已有研究顯示,雌激素和孕激素通過協同作用,可有效誘導子宮內膜中Th1型細胞向Th2型細胞轉化,且在妊娠期間雌激素和孕激素水平的增加與血管形成密切相關(Liu et al.,2002;Salem,2004)。Satterfield等(2009)通過體外注射孕酮,發現在羊妊娠12 d的子宮內膜組織中USP18基因表達水平顯著增加。本研究通過體外細胞試驗檢測雌二醇和孕酮聯合處理對子宮內膜上皮細胞USP18基因表達的影響,結果顯示,雌二醇和孕酮聯合作用可有效誘導子宮內膜上皮細胞中USP18基因的表達。可見,在妊娠早期,雌激素和孕激素的高分泌水平有助于提高子宮內膜中USP18基因的表達,但是否存在劑量依賴性還有待進一步探究。
Bauersachs等(2006)、Forde等(2011)研究發現,牛USP18基因在附植期子宮內膜中的表達水平明顯高于非妊娠時期,故推測USP18基因在牛子宮內膜中可作為檢測子宮內膜容受性的分子標記。Shen等(2014)同樣發現在豬妊娠14 d外周血中USP18基因的表達量顯著高于非妊娠狀態,說明其與早期妊娠密切相關。本研究也發現USP18基因在豬附植期子宮內膜中呈高水平表達,且在梅山豬中的表達水平高于大白豬,表明USP18基因在豬妊娠早期發揮著重要作用。基于此,本研究進一步對測序篩選獲得的USP18基因T953G位點進行產仔數性狀關聯分析,結果發現在經產母豬中USP18基因T953G位點TG基因型母豬的產仔數和產活仔數均最多,且在產活仔數性狀方面存在顯著差異。但本研究的豬個體數量較少,因此還需加大樣本數量進一步驗證結果的可靠性。
4 結論
豬USP18基因在附植期子宮內膜中高水平表達,且在子宮內膜上皮細胞中的表達受雌激素和孕激素誘導,表明USP18基因在妊娠早期建立過程中發揮著重要作用。USP18基因在梅山豬和大白豬間的差異表達可能是導致梅山豬產仔數高于大白豬的一個重要因素。
參考文獻:
付言峰,李蘭,Knox R V,李碧俠,方曉敏,任守文. 2018. 豬脂肪沉積和胚胎附植期FTO基因的表達及堿基突變檢測[J]. 江蘇農業學報,34(3):591-598. [Fu Y F,Li L,Knox R V,Li B X,Fang X M,Ren S W. 2018. Detection of FTO expression and SNPs during fat deposition and embryo implantation in pigs[J]. Jiangsu Journal of Agricultural Sciences,34(3):591-598.]
姚敏. 2018. 泛素特異性蛋白酶USP18在HBV病毒感染中的作用及其機制研究[D]. 北京:中國醫學科學院北京協和醫學院. [Yao M. 2018. The role of ubiquitin specific protease 18 in hepatitis B virus infection and its under-lying mechanism[D]. Beijing:Chinese Academy of Me-dical Sciences & Peking Union Medical College.]
尹洛蓉,李學偉,呂學斌,朱漢春,應三成. 2011. 梅山豬多產性研究[J]. 西南大學學報(自然科學版),33(8):37-41. [Yin L R,Li X W,Lü X B,Zhu H C,Ying S C. 2011. Investgation of ptolificacy of Meishan pigs[J]. Journal of Southwest University(Natural Science Edition),33(8):37-41.]
張高英. 2009. 妊娠早中期大白豬與梅山豬子宮免疫特征研究[D]. 武漢:華中農業大學. [Zhang G Y. 2009. Study on the uterine immune character of Large White and Meishan pigs at early and midgestation[D]. Wuhan:Huazhong Agricultural University.]
周艷紅,付言峰,趙為民,劉紅林,任守文. 2015. 胚胎附植期梅山豬EphrinA1全編碼區克隆及生物信息學分析[J]. 江蘇農業學報,31(2):350-356. [Zhou Y H,Fu Y F,Zhao W M,Liu H L,Ren S W. 2015. Coding sequence cloning and bioinformatics analysis of EphrinA1 during embryo implantation in Meishan swine[J]. Jiangsu Journal of Agricultural Sciences,31(2):350-356.]
Aluvihare V R,Kallikourdis M,Betz A G. 2004. Tolerance,suppression and the fetal allograft[J]. Journal of Molecular Medicine(Berlin),83(2):88-96.
Argente M J,Santacreu M A,Climent A,Blasco A. 2006. Influence of available uterince space per fetus on fetal development and prenatal survival in rabbits selected for uterine capacity[J]. Livestock Science,102(1-2):83-91.
Ashworth C J,Pickard A R,Miller S J,Flint A P,Diehl J R. 1997. Comparative studies of conceptus-endometrial interactions in Large White×Landrace and Meishan gilts[J]. Reproduction,Fertility,and Development,9(2):217-225.
Bauersachs S,Ulbrich S E,Gross K,Schmidt S E M,Meyer H H D,Wenigerkind H,Vermehren M,Sinowatz F,Blum H,Wolf E. 2006. Embryo-induced transcriptome changes in bovine endometrium reveal species-specific and common molecular markers of uterine receptivity[J]. Reproduction,132(2):319-331.
Bazer F W,Burghardt R C,Johnson G A,Spencer T E,Wu G. 2008. Interferons and progesterone for establishment and maintenance of pregnancy:Interactions among novel cell signaling pathways[J]. Reproductive Biology,8(3):179-211.
Bazer F W,Spencer T E,Johnson G A. 2009. Interferons and uterine receptivity[J]. Seminars in Reproductive Medicine,27(1):90-102.
Bazer F W,Thatcher W W,Martinat-Botte F,Terqui M. 1988. Conceptus development in Large white and prolific Chinese Meishan pigs[J]. Journal of Reproduction and Fertility,84 (1):37-42.
Burkart C,Arimoto K,Tang T D,Cong X L,Xiao N M,Liu Y C,Kotenko S V,Ellies L G,Zhang D E. 2013. Usp18 deficient mammary epithelial cells create an antitumour environment driven by hypersensitivity to IFN-λ and elevated secretion of Cxcl10[J]. EMBO Molecular Medecine,5(7):1035-1050.
Cai J,Liu T D,Jiang X L,Guo C K,Liu A W,Xiao X L. 2017. Downregulation of USP18 inhibits growth and induces apoptosis in hepatitis B virus-related hepatocellular carcinoma cells by suppressing BCL2L1[J]. Experimental Cell Research,358(2):315-322.
Cheng Z R,Chauhan L,Barry A T,Abudureyimu A,Oguejiofor C F,Chen X,Wathes D C. 2017. Acute bovine viral diarrhea virus infection inhibits expression of interferon tau-stimulated genes in bovine endometrium[J]. Biology of Reproduction,96(6):1142-1153.
Daikoku T,Cha J,Sun X F,Tranguch S,Xie H R,Fujita T,Hirota Y,Lydon J,DeMayo F,Maxson R,Dey S K. 2011. Conditional deletion of Msx homeobox genes in the uterus inhibits blastocyst implantation by altering uterine receptivity[J]. Developmental Cell,21(6):1014-1025.
Forde N,Carter F,Spencer T E,Bazer F W,Sandra O,Mansouri-Attia N,Okumu L A,McGettigan P A,Mehta J P,McBride R,O'Gaora P,Roche J F,Lonergan P. 2011. Conceptus-induced changes in the endometrial transcriptome: How soon does the cow know she is pregnant? [J]. Biology of Reproduction,85(1):144-156.
Hsu K S,Zhao X,Cheng X W,Guan D Y,Mahabeleshwar G H,Liu Y,Borden E,Jain M K,Kao H Y. 2017. Dual regulation of Stat1 and Stat3 by the tumor suppressor protein PML contributes to interferon α-mediated inhibition of angiogenesis[J]. The Journal of Biological Chemistry,292(24):10048-10060.
Hunter M G,Picton H M,Biggs C,Mann G E,McNeilly A S,Foxcroft G R.1996. Periovulatory endocrinology in high ovulating Meishan sows[J]. The Journal of Endocrinology,150(1):141-147.
Kiba A,Banno K,Yanokura M,Asada M,Nakayama Y,Aoki D,Watanabe T. 2015. Differential mRNA expression profiling in ovarian endometriotic tissue with versus without leuprolide acetate treatment[J]. The Journal of Obstetrics and Gynaecology Research,41(10):1598-1606.
Kim K I,Malakhova O A,Hoebe K,Yan M,Beutler B,Zhang D E. 2005. Enhanced antibacterial potential in UBP43-deficient mice against Salmonella typhimurium infection by up-regulating type I IFN signaling[J]. Journal of Immunology,175(2):847-854.
Li L,Tu J,Jiang Y,Zhou J,Schust D J. 2017. Regulatory T cells decrease invariant natural killer T cell-mediated pregnancy loss in mice[J]. Mucosal Immunology,10(3):613-623.
Liu H Y,Buenafe A C,Matejuk A,Ito A,Zamora A,Dwyer J,Vandenbark A A,Offner H. 2002. Estrogen inhibition of EAE involves effects on dendritic cell function[J]. Journal of Neuroscience Research,70(2):238-248.
MacParland S A,Ma X Z,Chen L,Khattar R,Cherepanov V,Selzner M,Feld J J,Selzner N,McGilvray I D. 2016. Lipopolysaccharide and tumor necrosis factor alpha inhibit interferon signaling in hepatocytes by increasing ubiquitin-like protease 18(USP18) expression[J]. Journal of Virology,90(12):5549-5560.
Raghupathy R,Makhseed M,Azizieh F,Omu A,Gupta M,Farhat R. 2000. Cytokine production by maternal lymphocytes during normal human pregnancy and in unexplained recurrent spontaneous abortion[J]. Human Reproduction,15(3):713-718.
Rempel L A,Austin K J,Ritchie K J,Yan M,Shen M F,Zhang D E,Henkes L E,Hansen T R. 2007. Ubp43 gene expression is required for normal Isg15 expression and fetal development[J]. Reproductive Biology and Endocrinology,5:13. doi:10.1186/1477-7827-5-13.
Salem M L. 2004. Estrogen,a double-edged sword:Modulation of TH1- and TH2-mediated inflammations by differen-tial regulation of TH1/TH2 cytokine production[J]. Current Drug Targets. Inflammation and Allergy,3(1):97-104.
Satterfield M C,Song G,Kochan K J,Riggs P K,Simmons R M,Elsik C G,Adelson D L,Bazer F W,Zhou H J,Spencer T E. 2009. Discovery of candidate genes and pathways in the endometrium regulating ovine blastocyst growth and conceptus elongation[J]. Physiological Geno-mics,39(2):85-99.
Shaabani N,Honke N,Nguyen N,Huang Z,Arimoto K I,Lazar D,Loe T K,Lang K S,Prinz M,Knobeloch K P,Zhang D E,Teijaro J R. 2018. The probacterial effect of type I interferon signaling requires its own negative regulator USP18[J]. Science Immunology,3(27):eaau2125. doi:10.1126/sciimmunol.aau2125.
Shen J Y,Zhou C L,Zhu S,Shi W P,Hu M S,Fu X W,Wang C D,Wang Y C,Zhang Q,Yu Y. 2014. Comparative transcriptome analysis reveals early pregnancy-speci-fic genes expressed in peripheral blood of pregnant sows[J]. PLoS One,9(12):e114036.
Simón C,Martín J C,Pellicer A. 2000. Paracrine regulators of implantation[J]. Baillieres Best Practice and Research,14(5):815-826.
Tayade C,Fang Y,Croy B A. 2007. A review of gene expression in porcine endometrial lymphocytes,endothelium and trophoblast during pregnancy success and failure[J]. The Journal of Reproduction and Development,53(3):455-463.
Yan M,Luo J K,Ritchie K J,Sakai I,Takeuchi K,Ren R B,Zhang D E. 2007. Ubp43 regulates BCR-ABL leukemogenesis via the type 1 interferon receptor signaling[J]. Blood,110(1):305-312.
(責任編輯 蘭宗寶)

