疏葉駱駝刺與花花柴互作對氮素固定和根際微生物的影響
郭平林,劉 波,張志浩,荊瑞雪,張 波,曾凡江,*
1 中國科學院新疆生態與地理研究所荒漠與綠洲生態國家重點實驗室,烏魯木齊 830011 2 山東省水土保持與環境保育重點實驗室,臨沂大學資源環境學院,臨沂 276005 3 中國科學院新疆生態與地理研究所新疆荒漠植物根系生態與植被修復實驗室,烏魯木齊 830011 4 新疆策勒荒漠草地生態系統國家野外科學觀測研究站,策勒 848300 5 中國科學院大學,北京 100049
植物的種間互作以及植物與土壤間的養分循環直接或間接地影響著土壤微生物的群落結構[1],合理的種間搭配也可提高互作植物的生物量和對各種資源的利用效率[2-3]。這種植物之間的相互作用與土壤的性質、土壤微生物和植物的生理可塑性密切相關[4-7]。植物之間以及植物與土壤微生物群落之間的資源交換是生態系統功能、演替和干擾恢復的基礎,是生態系統應對全球變化至關重要的驅動力。
土壤微生物群落演替在調節生態系統發展的各種變化中發揮著重要作用[8-10]。以往關于植物微生物與生態系統演替相互作用的研究多集中于土壤微生物群落如何受到早期演替物種的制約,以及同一或不同演替階段的同種或異種植物對土壤微生物后續定殖過程的影響[11-13]。相關研究已經確定了植物微生物的正反饋和負反饋對驅動植物群落組成中的重要性[14-16],并發現植物間的相互作用主要表現在土壤細菌群落結構和氮素循環上[17]。然而,這類研究還需要明確植物之間的相互作用在不同區域、植被之間的差異,以及與氮素轉移相關的節點是如何變化的。
植物的根系對于植物間、植物-土壤、植物-微生物的相互關系至關重要[18]。植物根系具有不同的功能模塊[19],其中細根(1—2級根)的吸收功能較強,粗根(3—5級根)承擔著營養運輸的功能[20]。植物細根對環境變換敏感,溫度、水分和氮素等都會影響細根的特征[21-22]。因此,在研究植物之間、植物與土壤微生物之間的相互關系時,有必要考慮根系不同功能模塊在其中所發揮的作用。
豆科和非豆科之間的相互作用是研究植物相互作用的理想模式[23]。氮素在株間的轉移是豆科和非豆科植物互作的顯著特征,氮素的轉移量是衡量兩者之間互作強度的有效指標。豆科植物將大氣中的14N以生物固氮的方式固定到生物體內。植物體內的15N/14N比值越低,表明該植物的固氮能力越強。這些氮素最終以植物凋落物或分泌物的形式在土壤中流動,通過微生物的作用,優先分解輕氮(14N),而將重氮(15N)留在土壤中[24]。而非豆科植物只能通過根系對土壤氮素的吸收來滿足其生長發育需要,從而導致其體內的15N/14N比值偏高。因此,可以利用15N/14N比值來評判植物固氮能力的強弱[25-26]。δ15N以非固氮植物的15N/14N比值為標準,來計算豆科植物的固氮能力,δ15N值越小固氮能力越強,計算公式如下:δ(‰)=(Rsq/Rst-1)×1000,其中Rsq為樣品的15N/14N比值,Rst為標準植物的15N/14N比值。
豆科植物疏葉駱駝刺(Alhagisparsifolia Shap.)和非豆科植物花花柴(Kareliniacaspia(Pall.)Less)是塔克拉瑪干沙漠荒漠地區的主要建群種,在生態穩定和防治綠洲沙漠化中起到屏障作用,兩者常相伴而生,廣泛分布于沙漠-綠洲過渡帶上。因此,揭示疏葉駱駝刺和花花柴互作機理對塔克拉瑪干沙漠植被保護與恢復具有重要意義。為此,本研究在自然和小區(控制土壤水分)兩種試驗條件下,擬研究:(1)疏葉駱駝刺對氮素的固定和利用特性;(2)花花柴各器官的氮素利用特性;(3)疏葉駱駝刺和花花柴互作對不同根際土壤微生物的影響。
1 研究區域和方法
1.1 研究區域概況
研究區位于塔克拉瑪干沙漠南緣的策勒綠洲外圍(地理位置:80°03′24″—82°10′34″E,35°17′55″—39°30′00″ N),平均海拔1360 m,年均降雨量34 mm,主要是夏季降雨,年平均氣溫11.9℃,極端最高氣溫41.9℃,植被覆蓋度低,以荒漠灌叢為主。實驗小區已被利用20多年,間斷種植過疏葉駱駝刺,紅柳,鹽生草等植物。在本實驗開始前2年(2015—2016年)小區種植疏葉駱駝刺,2016年底清除。
1.2 實驗設計
本實驗依托策勒國家沙漠研究站,于2017年7月至2018年9月,設置9個4 m×4 m的試驗小區,每個小區之間有1.5 m的間隔帶,依次為疏葉駱駝刺單作、疏葉駱駝刺與花花柴互作、花花柴單作各3個小區。為了避免1年疏葉駱駝刺幼苗的生物量小和根系不發達對實驗結果的影響,我們在疏葉駱駝刺種植1年后種植花花柴。2017年4月底播種(種子采集于距離實驗區1 km的荒漠區)于育苗杯中,待長勢穩定后,移栽到其中6個小區,行間距1 m×1 m。花花柴采用塊根育苗,于2018年3月20日,挖掘荒漠區自然生長的花花柴的塊根,切成5 cm的小塊,分別栽培6個小區(其中一部分單獨種植,另一部分與疏葉駱駝刺種在一起)。4月到9月間,統一管理,充分灌溉,及時清除雜草。
1.3 樣品采集與指標測定
1.3.1植物
2018年9月,采集自然和小區內疏葉駱駝刺和花花柴的健康成熟葉片,低溫烘干(60℃),粉碎后使用Mat253 同位素比率質譜儀(德國Finnigan公司)測定并計算出δ15N。在小區實驗,移除花花柴的地上部分,將莖和葉分開收集,再分層挖掘采集疏葉駱駝刺和花花柴的根系,直到60 cm土深(自然疏葉駱駝刺和花花柴的根系在3 m以下,無法采集到)。從上到下對根進行編號,未分級的主根記為1號,每分一級,編號加1,最后將編號一樣的混合到一起。所有植物樣放入75℃的烘箱24 h,經球磨儀粉碎后,使用元素分析儀測定C、N含量。
1.3.2微生物
在采集根系之前(新鮮挖出來的10—30 cm處的根系),采用抖土法收集疏葉駱駝刺和花花柴根際土,立即放入放有冰袋的保溫箱中,帶回實驗室無菌條件下過2 mm篩,零下20℃保存,用于16S rRNA擴增子測序。DNA提取步驟參照OMEGA試劑盒E.Z.N.ATM Mag-Bind Soil DNA Kit的試劑盒使用說明書(網址鏈接:http://omegabiotek.com/store/product/soil-dna-kit/)。使用Miseq 2×300bp測序平臺測序(上海生物工程有限公司),細菌擴增區域為V3—V4,正向引物為341F, 序列為CCTACGGGNGGCWGCAG;反向引物為805R,序列為GACTACHVGGGTATCTAATCC;真菌擴增區域為NS1—fung,正向引物NS1,序列為GTAGTCATATGCTTGTCTC;反向引物為Fung,序列為ATTCCCCGTTACCCGTTG。將配對序列用FLASH(V1.2.3)進行合并,然后用QIIME[27]進行質量檢測。去除嵌合sequences[28]后,其余序列使用UPARSE以97%的相似性分配給OTUs[29]。RDP分類器以80%的置信度為每個OTU的一個代表性序列標注分類信息[30]。并對細菌的功能在基于GenBank的功能基因數據庫(http://fungene.cme.msu.edu/)下,采用PICRUSt功能分析,預測細菌功能。
1.3.3土壤
2018年9月采集自然和小區內的10—30 cm處土壤樣品,混勻后分成3份,一份測定土壤含水量;風干后,一份過1 mm的篩后,測定土壤速效磷和全氮含量,剩余部分過2 mm的篩,用于測定土壤pH。采集小區內花花柴和疏葉駱駝刺根系附近2—5 cm的土壤。測定土壤的C、N、P的含量,以及pH和含水量(處理方法同上)。
1.4 數據處理分析
使用SAS 9.4軟件對不同條件下的土壤性質,植物C、N及δ15N進行統計分析。采用OriginPro 8軟件繪圖。
2 結果與分析
2.1 氮素固定與利用
表1為不同條件下兩種植物的δ15N值比較。從表中可以看出,單獨生長的疏葉駱駝刺葉片的δ15N值均顯著高于其與花花柴互作的情況。自然生境下與花花柴互作的駱駝刺葉片δ15N值相比單獨的降低了37%,而在小區中只降低了10%。說明疏葉駱駝刺的固氮能力在互作條件下更強,且在自然生境中促進了疏葉駱駝刺的固氮能力。自然生境與小區生境相比駱駝刺葉片δ15N平均降低30%,互作和單獨種植分別增加了42%和18%(圖1)。
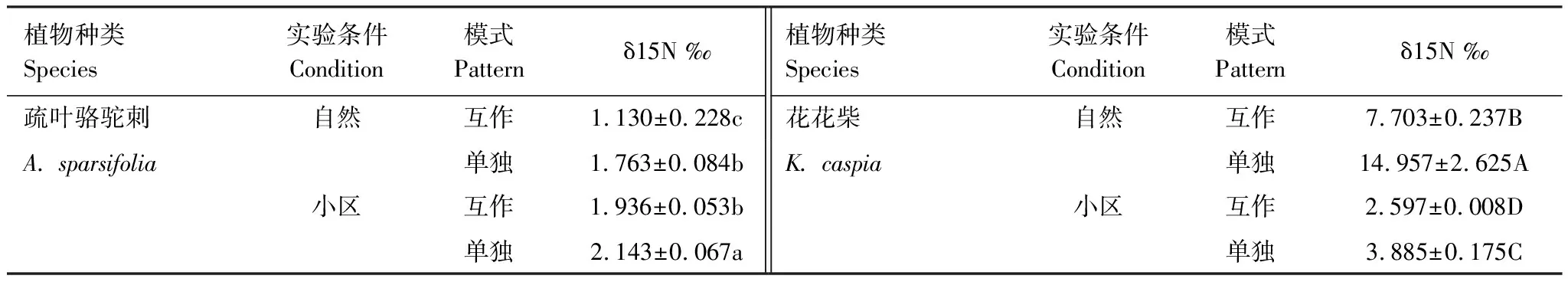
表1 不同條件下兩種植物的δ15N值比較
花花柴與疏葉駱駝刺互作是其獲取氮素的另一重要途徑,自然條件下花花柴通過與疏葉駱駝刺互作獲取氮素更多。無論是在自然或是小區生境下,單獨存在的花花柴葉片δ15N值均顯著高于互作的花花柴葉片δ15N值。在自然生境下花花柴葉片的δ15N值顯著高于小區生境中的花花柴葉片的δ15N值。自然生境下互作花花柴葉片的δ15N值相比單獨的降低了49%,而在小區中互作花花柴葉片的δ15N值只降低了33%。自然生境與小區生境相比δ15N平均降低了71%,互作和單獨種植分別降低了66%和74%(圖1)。以上結果說明花花柴和駱駝刺互作受環境因素和生物因素的共同調節,且環境因素對氮素轉移的影響大于生物因素。
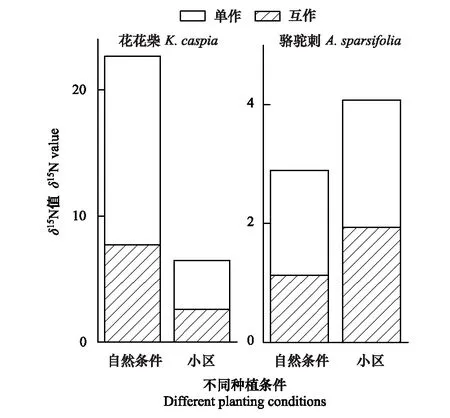
圖1 兩種植物葉片的 δ15N值變化
2.2 互作對營養元素分配的影響
疏葉駱駝刺和花花柴葉片δ15N值的分析結果表明,疏葉駱駝刺將固定下來的部分氮素轉移給了花花柴,但是這部分氮素被花花柴吸收后對花花柴的影響還不清楚。
因此對比分析兩種種植模式下花花柴不同器官的C、N營養元素(圖2)。結果表明花花柴與疏葉駱駝刺互作顯著改變了花花柴各個組織的氮素含量。花花柴各部分氮含量依次是根的氮含量<莖的氮含量<葉的氮含量。互作種植的花花柴葉片氮含量顯著高于單獨種植的;互作種植的花花柴莖的氮含量顯著低于單獨種植的,兩種種植模式下的花花柴根系氮含量沒有顯著差異。互作花花柴葉片的碳含量顯著高于單獨的花花柴,但是根系碳含量顯著低于單獨花花柴根系碳含量。花花柴根:莖:葉的氮含量比值,由單種的1∶2.4∶6.6變為互作的1:2:7,互作花花柴的碳含量也向葉片有轉移趨勢。研究結果表明,從疏葉駱駝刺轉移到花花柴的氮素影響了花花柴的元素分配,向葉片中運輸的氮素增多。
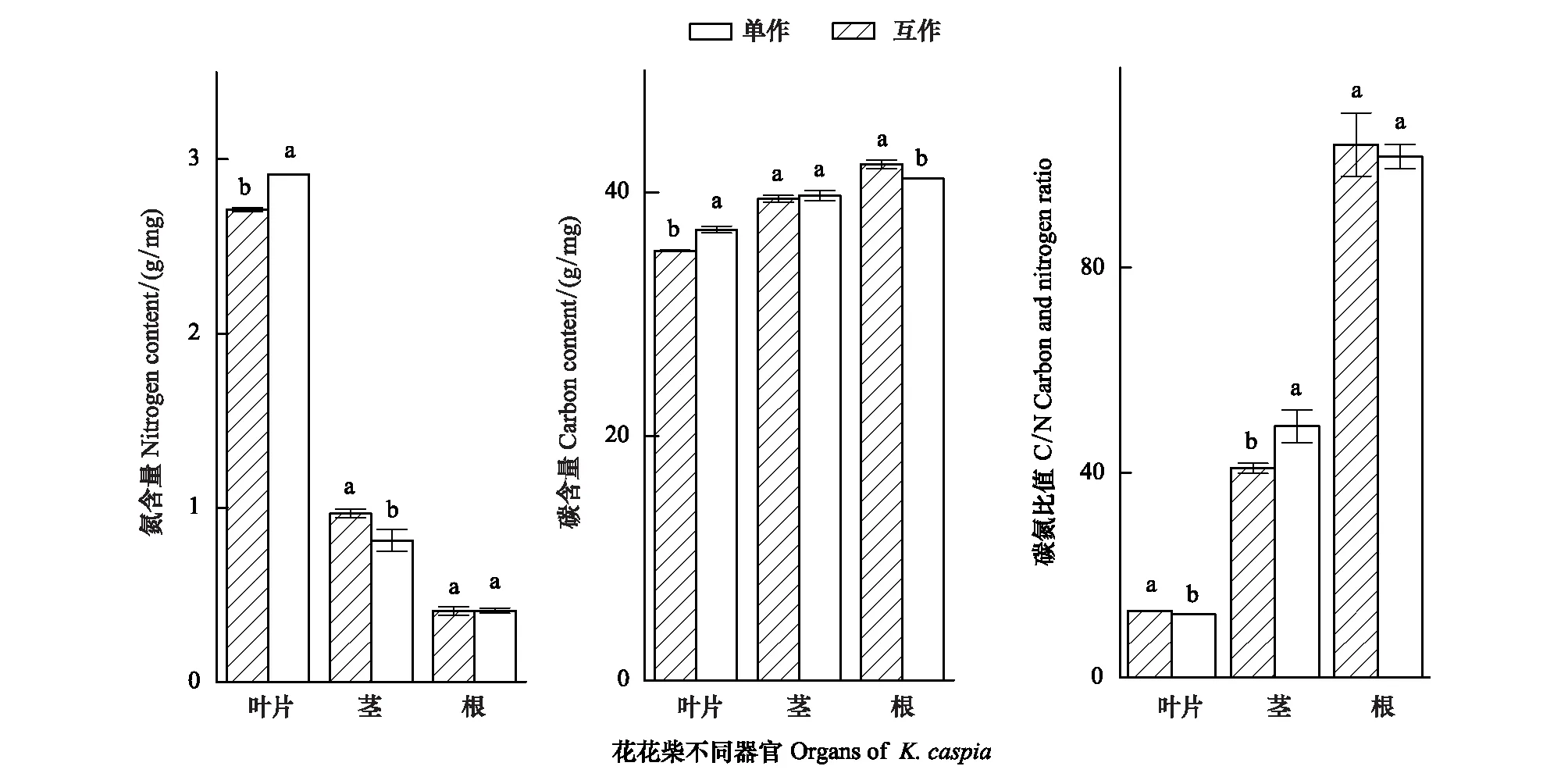
圖2 不同種植模式下花花柴各組織的碳氮元素含量變化
互作降低了疏葉駱駝刺根系的氮含量,促進了碳元素向細根的運輸(圖3)。疏葉駱駝刺細根(1—2級根)的氮含量最高,顯著高于3—5級根的氮含量。互作對疏葉駱駝刺不同級根氮含量都有影響,對4—5級根的氮含量影響最大,互作能夠降低疏葉駱駝刺細根20%的氮含量,4—5級根30%以上的氮含量。疏葉駱駝刺單獨種植的4—5級根的碳含量顯著高于其他根系,互作增加了細根的碳含量,降低了4—5級根的碳含量。疏葉駱駝刺細根的C/N比值低于30,顯著低于3—5級根的C/N比值。
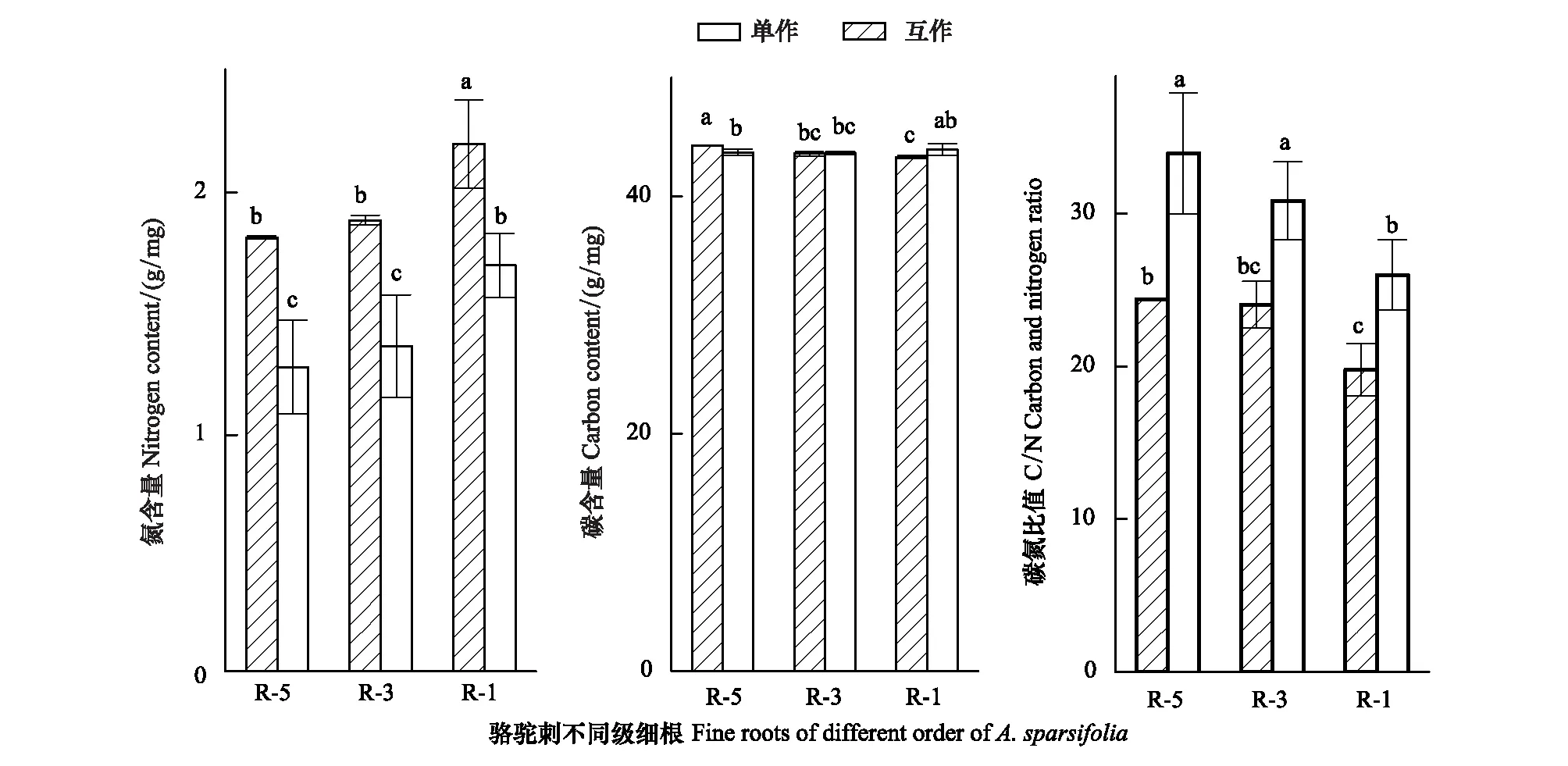
圖3 不同種植模式下疏葉駱駝刺根系的碳氮元素含量變化
2.3 互作對根際細菌群落結構與功能特征的影響
疏葉駱駝刺根際細菌群落主要由變形菌門(Proteobacteria)61.44%、厚壁菌門(Firmicutes)9.86%、放線菌(Actinobacteria)13.64%、擬桿菌門(Bacteroidetes)4.01%、酸桿菌門(Acidobacteria)3.04%和芽單胞菌門(Gemmatimonadetes)1.5%組成。其中變形菌門以α,γ變形菌為主;花花柴根際細菌群落主要由變形菌門(Proteobac teria)71.88%、厚壁菌門(Firmicutes)8.59%、放線菌(Actinobacteria)10.95%、擬桿菌門(Bacteroidetes)2.52%、酸桿菌門(Acidobacteria)1.44%和芽單胞菌門(Gemmatimonadetes)0.62%組成。
2.3.1互作對疏葉駱駝刺和花花柴根際細菌多樣性的影響
互作改變了疏葉駱駝刺根際細菌α多樣性,但是對花花柴根際細菌α多樣性無顯著影響。Simpson指數是指示微生物群落的α多樣性的,Simpson 指數值越大,說明群落多樣性越低。疏葉駱駝刺與花花柴互作顯著增加了Simpson指數(表2)。花花柴根際細菌多樣性在單種和互作條件下沒有顯著差異,這可能與花花柴根系較為光滑,土壤不易附著且根毛極少等特性有關。
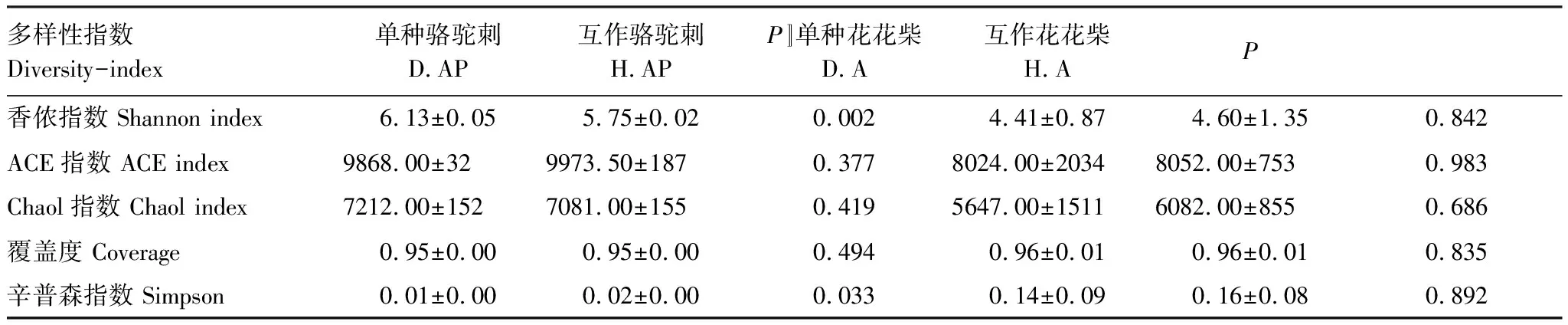
表2 不同處理下疏葉駱駝刺和花花柴根際細菌α多樣性指數
互作改變了疏葉駱駝刺細根(1—2級)根際細菌的α多樣性,對4—5級根沒有顯著影響。疏葉駱駝刺細根,3級根和4—5級根的根際土壤細菌群落多樣性指數Shannon index逐漸減少,3級根的物種豐富度指數ACE index最高。疏葉駱駝刺與花花柴互作,整體上降低了疏葉駱駝刺不同根級的根際土壤微生物α多樣性,但是沒有改變多樣性變化的規律。互作顯著降低了細根根際細菌的Shannon index,增加了細根根際細菌的Simpson指數。綜上所述,駱駝刺與花花柴互作改變了細根根際土壤細菌群落的α多樣性指數,對粗根沒有顯著影響(圖4)。
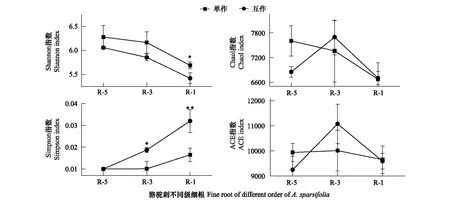
圖4 疏葉駱駝刺根際土壤細菌的α多樣性
疏葉駱駝刺根際細菌群落與環境因子的CCA分析結果表明(圖5),互作改變了疏葉駱駝刺不同根際細菌群落組成。單獨種植的疏葉駱駝刺細菌群落與土壤氮含量和C/N比值關系密切;而植物的C、N以及C/N比值與互作條件下的疏葉駱駝刺根際細菌群落關系密切。不同種植模式下疏葉駱駝刺細根,3級根和4—5級根的根際微生物的主導環境因子不同。互作條件下,1—3級根的根際微生物主要與根系的C/N比值關聯較大,而在單獨種植模式下,受土壤的有機碳含量和C/N比值的影響較大;粗根與土壤含水率,以及土壤和根系的氮含量相關性在單種種植時更大。
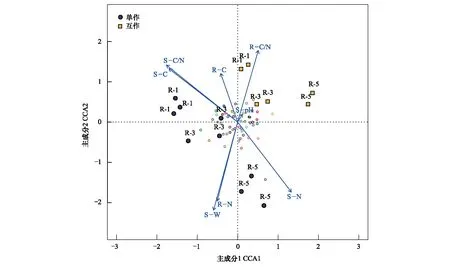
圖5 不同種植模式下疏葉駱駝刺根際細菌群落的CCA分析
2.3.2互作對疏葉駱駝刺根際細菌群落基因功能的影響
采用COG基因功能注釋法預測疏葉駱駝刺根際細菌的基因功能特性,結果表明互作顯著改變了疏葉駱駝刺根際細菌的基因功能。互作與單種的基因功能的差異主要體現在與運輸氮素物質相關的基因上,如氨基酸和碳水化合物轉運與代謝的相關基因在互作條件下顯著高于單獨種植的疏葉駱駝刺;而單獨種植的疏葉駱駝刺的核苷酸轉運與代謝相關基因顯著高于互作的(圖6)。我們知道以游離氨基酸的形式轉移氮素是植物體內轉移氮素的重要途徑,在轉移氮素的同時,轉運碳水化合物為氮素提供碳骨架。因此,可以看出與花花柴互作的疏葉駱駝刺根際微生物群落的結構和功能都發生了變化,向著更有利于運轉氮素的微生物群落在演替。
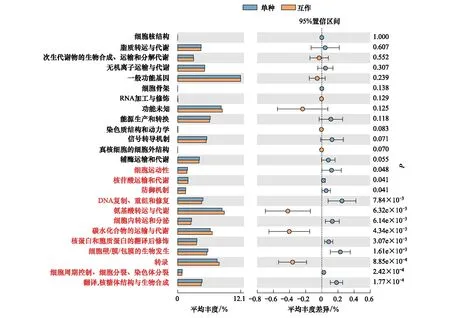
圖6 不同種植模式下疏葉駱駝刺根際細菌群落的功能預測
疏葉駱駝刺不同根系的根際土壤細菌的基因功能不同(圖7)。疏葉駱駝刺細根的氨基酸和碳水化合物轉運與代謝的相關基因豐度顯著高于4—5級根,核苷酸轉運與代謝相關基因顯著低于4—5級根。分析單獨和互作條件下細根根際土壤細菌的基因功能,結果表明,互作條件下細根的氨基酸和碳水化合物轉運與代謝的相關基因顯著高于4—5級根。
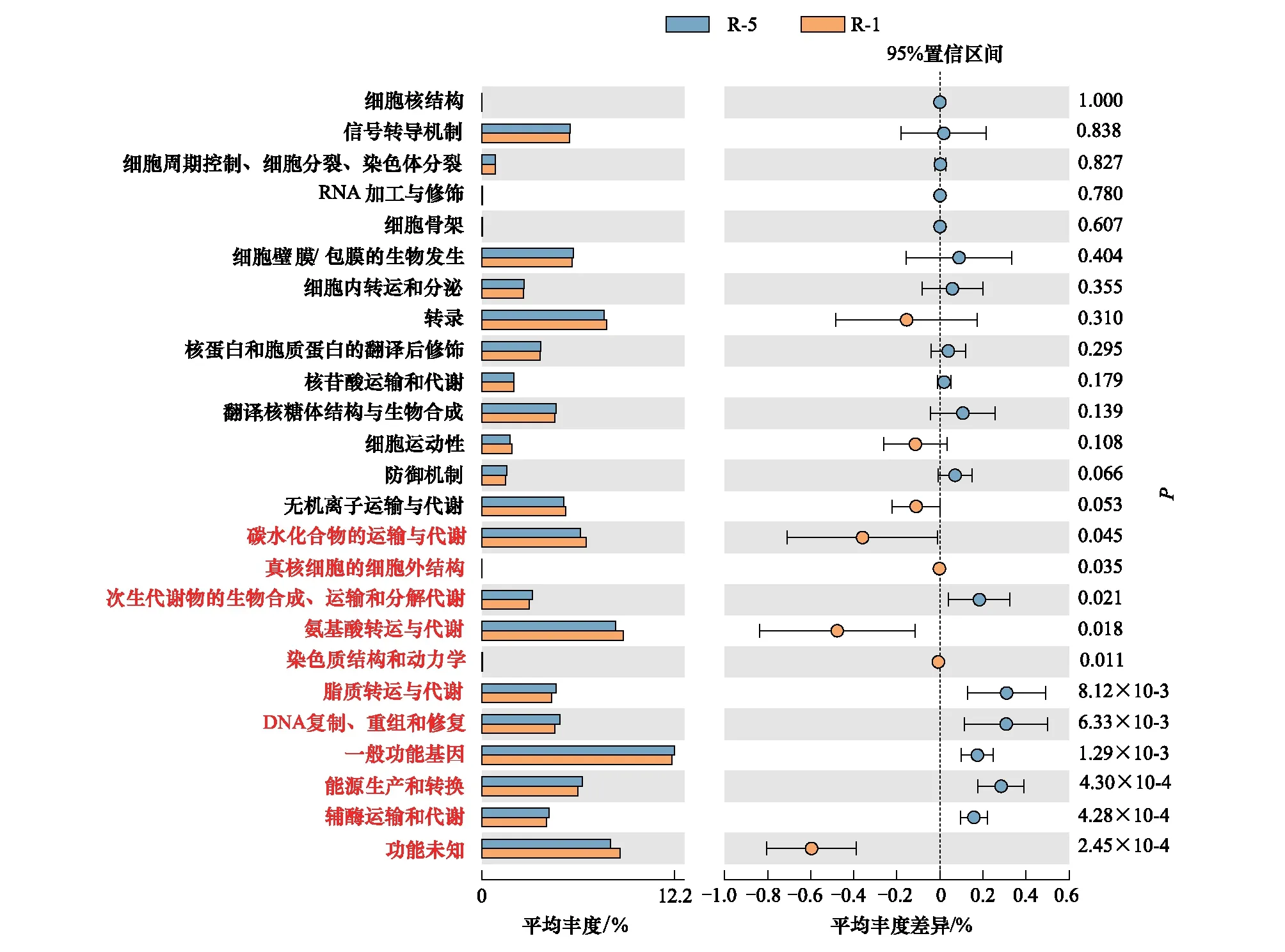
圖7 疏葉駱駝刺不同根際土壤細菌基因功能
3 討論
3.1 互作對豆科植物氮素固定和利用的影響
氮素的利用與分配直接影響著植物的生長[31]。大多數植物的生長都受到土壤氮素有效性的限制[32],在氮限制系統中,豆類植物通過減少對氮的競爭[33]或氮素轉移來促進其他植物物種的生長。豆科植物可以利用生物固氮為植物提供氮素,非豆科植物通過與豆科植物互作也可獲得氮素[34],從豆科植物轉移到鄰近植物的氮量可能占非豆科植物總氮的8%—39%[32]。本研究結果表明疏葉駱駝刺與花花柴在自然和小區兩種生存環境下都有氮素轉移特征,自然生境下疏葉駱駝刺和花花柴的互作關系更為緊密。疏葉駱駝刺和花花柴的δ15N值在不同生境下變化幅度更大。這是因為小區土壤含水率,速效磷和土壤氮含量要高于自然荒漠土壤,pH低于自然條件,小區的土壤環境更有利用植物生長(表3),非生物因子決定了植物互作關系的強弱[35-37],氮素及水分脅迫可能決定了疏葉駱駝刺和花花柴的互作。在互作條件下,花花柴各組織的氮含量更多的向葉片轉移。觀察花花柴的物候發現,與疏葉駱駝刺互作的花花柴的生長季要比單種的長,互作的花花柴更高的葉片氮含量可能與之相關[38-40]。

表3 土壤主要性質的差異
3.2 土壤微生物與植物互作
植物的相互作用通過相關微生物直接或間接的影響來實現[41]。研究表明豆科植物與禾本科植物互作能提高生物量、增加土壤微生物多樣性和功能多樣性[42-44],而紫云英(豆科)與油菜互作,降低了油菜根際土壤細菌多樣性[45]。本研究發現疏葉駱駝刺與花花柴互作降低了疏葉駱駝刺根際細菌群落的Shannon index,但對駱駝刺根際真菌群落以及花花柴根際微生物群落沒有顯著影響(表2和表4)。可能原因是互作改變了疏葉駱駝刺氮素的獲取方式,使疏葉駱駝刺從大氣固氮,減少從土壤中吸收氮素的比例,形成了氮素“節約”型的氮素獲取方式[46],改變了疏葉駱駝刺根際的微環境。由于花花柴根系與疏葉駱駝刺根系相距較遠,且小區土壤水分狀況良好,對花花柴根際微環境影響不大。植物互作關系,主要反映在細菌群落和氮素水平上[17]。豆科植物通過根系分泌物(氨基酸)將氮素轉移到土壤之后,被非豆科植物吸收利用[35]。本研究發現互作改變了疏葉駱駝刺根際細菌中與氮素運轉相關的基因,包括氨基酸和碳水化合物的轉運與代謝基因。這可能說明在疏葉駱駝刺和花花柴相互作用下,土壤微生物作為一個智能媒介將氮素從疏葉駱駝刺轉移到了花花柴中,并進一步被運輸到葉片中。
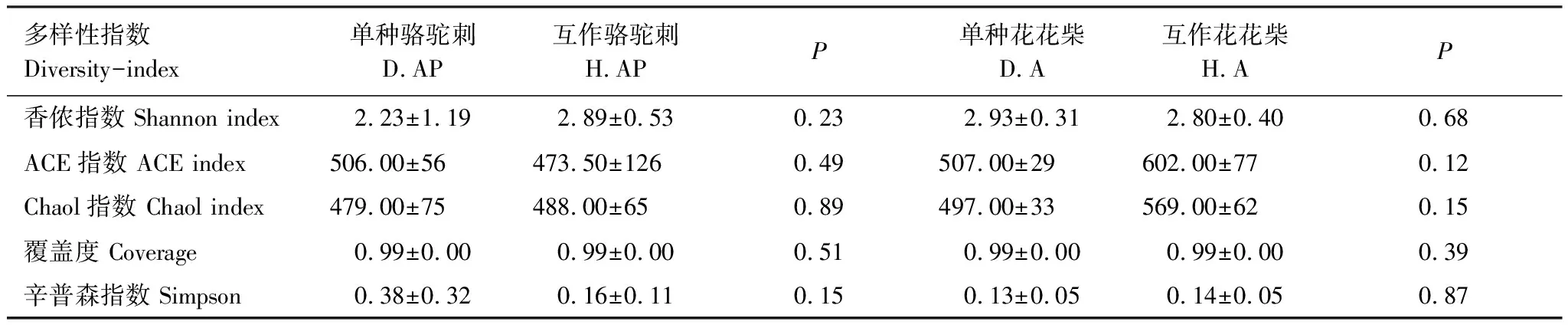
表4 駱駝刺和花花柴根際土壤真菌群落的α多樣性
3.3 植物互作對細根的影響
植物根系有兩種不同的功能模塊,包括1—3級具有吸收功能的細根和三級以上的運輸根[47-48],細根一般具有較高的氮素含量,較短的壽命,在資源利用方面具有可塑性[19,49]。疏葉駱駝刺細根的氮含量顯著高于3級根和4—5級根,與花花柴互作顯著降低了疏葉駱駝刺細根的氮含量,細根氮含量的減少幅度小于粗根的,保證了細根生命活動對氮素的需求。互作降低了疏葉駱駝刺根際土壤細菌的多樣性,使駱駝刺細根根際微生物向著專一性的功能群落演替。基因功能預測發現,互作改變了疏葉駱駝刺細根根際土壤細菌的基因功能,細根中參與轉運氮素的相關基因在互作條件下顯著高于單獨種植。因此,細根可能是疏葉駱駝刺和花花柴互作的關鍵部位。
4 結論
疏葉駱駝刺與花花柴在自然和小區兩種生存環境下都有氮素轉移特征,自然生境下疏葉駱駝刺和花花柴的互作關系更為明顯。環境因素對駱駝刺固氮,駱駝刺和花花柴互作的影響更大。在自然生境中,從疏葉駱駝刺轉移到花花柴的氮素占花花柴總氮50%左右。小區互作種植的疏葉駱駝刺固氮作用降低,轉移到花花柴的氮素降低到30%左右,花花柴各組織的氮含量更多地向葉片轉移。疏葉駱駝刺與花花柴互作降低了疏葉駱駝刺根際細菌群落的Shannon index,改變了疏葉駱駝刺細根根際土壤細菌的基因功能,細根中參與轉運氮素的相關基因在互作條件下顯著高于單獨種植,但對花花柴根際微生物群落沒有顯著影響。互作降低了疏葉駱駝刺細根氮含量和細根根際土壤細菌多樣性及其基因功能,疏葉駱駝刺細根可能是疏葉駱駝刺和花花柴互作的關鍵部位。綜上所述,駱駝刺和花花柴互作增加了固氮量,有利用荒漠生態系統的穩定。

