新型冠狀病毒刺突蛋白及其受體的結構與功能
江明金,溫金華,潘德城,周 健,呂燕妮,魏筱華
(南昌大學第一附屬醫院藥學部,江西 南昌 330006)
目前,全球大流行的新型冠狀病毒感染疾病(corona virus disease 2019,COVID-19),其病原體經分離鑒定為新型冠狀病毒,命名為“嚴重急性呼吸綜合征冠狀病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)”[1-4]。根據世界衛生組織最新情況報告,截至2020年5月12日,全球累計報告-COVID-19確診病例數超400萬例,死亡超28萬例,涉及200多個國家和地區。COVID-19疫情已成為全球各國共同面臨的公共衛生安全挑戰。盡管SARS-CoV-2與SARS相關冠狀病毒具有遺傳相似性,但其傳播方式及所致疾病特點有顯著差異,SARS-CoV-2的傳染源、致病機制、傳染性及毒性仍不清楚。
冠狀病毒是具有囊膜的單股正鏈核糖核酸(ribonucleic acid,RNA)病毒,基因組大小為27~32 kb,是目前已知RNA病毒中基因組最大的病毒[5]。冠狀病毒分為α、β、γ、δ 4個屬,其中β屬冠狀病毒又分為A、B、C、D 4個亞群[6]。SARS-CoV-2是目前發現的第7種可感染人類的冠狀病毒,與SARS-CoV同屬β屬冠狀病毒B亞群(Tab 1)[7]。SARS-CoV-2傳染性強、傳播速度快,刺突蛋白(spike protein,S蛋白)的裂解活化對病毒入侵能力以及毒力起到關鍵作用[8-9]。血管緊張素轉化酶2(angiotensin-converting enzyme 2,ACE2)已被證實是SARS-CoV-2感染宿主細胞的功能性受體[2, 8, 10-12]。盡管SARS-CoV-2 S蛋白[13]、ACE2[14]及S蛋白受體結合結構域(receptor binding domain,RBD)-ACE2復合物[14-15]的三維晶體結構逐漸被解析,但對其入侵機制仍所知甚少,處于起步階段。本文主要針對SARS-CoV-2 S蛋白及其與ACE2相互作用的現階段研究進展進行綜述,旨在闡明SARS-CoV-2 S蛋白、ACE2及RBD-ACE2復合物的結構與功能,為進一步研究提供參考。
1 SARS-CoV-2 S蛋白的結構與功能
1.1 SARS-CoV-2 S蛋白的組成及三維結構SARS-CoV-2 S蛋白是一個I型三聚體跨膜糖蛋白,分子量約180 ku,由1273個氨基酸殘基組成,包含22個N-糖基化位點[8-9]。S蛋白伸出囊膜呈棒-球狀,在病毒粒子表面形成酷似“王冠”的結構,冠狀病毒因此而得名。S蛋白由N端的S1(球狀)和C端的S2(棒狀)2個部分組成。其中S1包含2個相對獨立的結構域:N-和C-端結構域(N/C-terminal domain,N/CTD)(Fig 1)[16]。RBD、受體結合基序(receptor binding motif,RBM)分別是S蛋白與宿主細胞受體直接結合的結構域及結構域中最核心的結合區段,SARS-CoV-2、SARS-CoV RBD及RBM都位于CTD中[9, 16-17]。S2包含連接區、融合肽(fusion peptide,FP)、2個保守的七肽重復區(heptad repeat region,HR)HR1和HR2、跨膜區及胞內區(Fig 1)[16]。冠狀病毒主要依靠S蛋白完成與宿主細胞受體結合以及膜融合過程。S1特異性地識別和結合宿主細胞表面受體;S2將整個S蛋白固定到病毒外膜,介導病毒外膜與細胞膜的膜融合和病毒遺傳物質的進入;相比S2氨基酸序列的相對保守,S1的變異性更大,即使是同一病毒的不同毒株也存在差異[16]。
Wrapp等[13]通過冷凍電鏡(cryo-electron microscopy,Cryo-EM)技術,成功構建出分辨率為3.5埃的SARS-CoV-2 S蛋白胞外域三聚體融合前構象的首個三維結構圖,發現SARS-CoV-2較SARS-CoV的S蛋白RBD更偏向三聚體中心部位,其3個RBD有1個向上螺旋突出使S蛋白形成易與宿主表面受體結合的空間構象(Fig 2)。Walls等[9]也構建了1個融合前穩定的S蛋白胞外域的三聚體三維結構,觀察到結構域B(即CTD)的多種構象,包括1個單一打開的結構域B的三聚體和3個關閉的結構域B的封閉三聚體。與SARS-CoV、中東呼吸綜合征冠狀病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)S蛋白結構相類似,SARS-CoV-2 S蛋白RBD在三聚體的頂點處打開,引起三聚體的多種構象變化,這些結構變化對于這3種病毒的受體結合是必需的,并導致膜融合構象變化的啟動[9]。這3種病毒的RBD均可發生“鉸鏈”樣的構象運動,當其向上時,S蛋白與宿主受體結合;向下時,與受體結合的部位被隱藏,即向上結合,向下隱藏。對于其他4種感染人類的冠狀病毒,目前僅檢測到封閉的S蛋白三聚體。
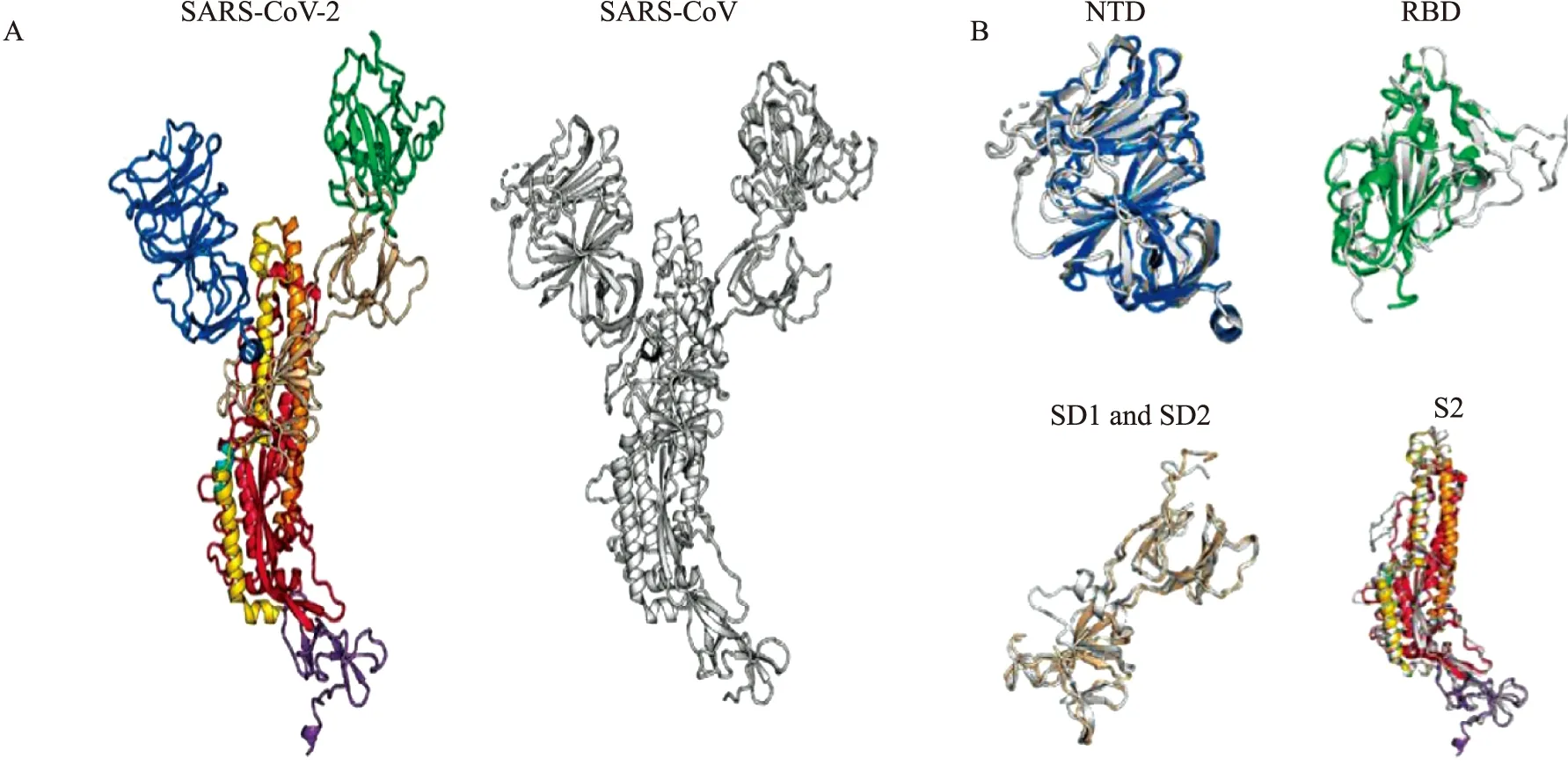
Fig 2 Structural comparison between SARS-CoV-2 and SARS-CoV S proteins[13]A: The monomers of SARS-CoV-2 and SARS-CoV S proteins are shown in ribbons; B: The following structural domains from SARS-CoV-2 S protein have been aligned to their counterparts from SARS-CoV S protein; NTD (top left), RBD (top right), SD1 and SD2 (bottom left) and S2 (bottom right). SARS-CoV-2: colour ribbons, SARS-CoV: white ribbons.
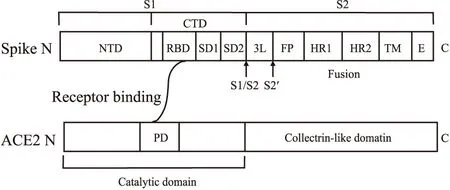
Fig 1 The schematic diagram of SARS-CoV-2 spike protein and its receptor ACE2Spike protein contains two subunits, S1 and S2; NTD: N-terminal domain; CTD: C-terminal domain; RBD: receptor binding domain; SD1: subdomain 1; SD2: subdomain 2; L: linker region; FP: fusion peptide; HR1: heptad repeat region 1; HR2: heptad repeat region 2; TM: transmembrane region; E: intracellular region; S1/S2 and S2′ represent two cleavage sites; PD: peptidase domain.
1.2 SARS-CoV-2和SARS-CoV的S蛋白結構比較整體看,SARS-CoV-2和SARS-CoV的S蛋白結構相似度很高,有超過959個對應的Cα原子的均方根偏差值為3.8埃,序列相似性87.2%(Tab 1)[13, 18]。二者RBD有174個對應的Cα原子的均方根偏差為1.2埃,序列相似性82%(Tab 1),RBM也高度相似(均方根偏差為1.3埃)[13, 15]。二者S2部分結構保守,有超過417個對應的Cα原子的均方根偏差值為1.2埃,序列相似性達88%(Tab 1)[9]。SARS-CoV-2 RBD位于333~527位氨基酸,其核心區由包含短連接螺旋和環(loop)的扭曲的4個反平行的β-折疊片層(β1、β2、β3和β6)組成;RBM位于438~506位氨基酸,其在核心區的β3-與β6-折疊之間,由短的β4-和β5-折疊、α4-和α5-螺旋以及loop組成,包含SARS-CoV-2與ACE2結合的大部分氨基酸殘基[15]。SARS-CoV-2 RBD共發現9個半胱氨酸殘基,其中6個形成3對二硫鍵:核心區2對(Cys336-Cys361、Cys379-Cys432)用來固定β-折疊結構,另1對(Cys480-Cys488)連接RBM遠端的loop[15]。SARS-CoV RBM有13~14個氨基酸區域形成一個獨特的loop結構,該結構通過2個半胱氨酸殘基之間的二硫鍵穩定。與SARS-CoV比較,盡管SARS-CoV-2 RBM的loop結構的氨基酸序列有很大不同,但這2個半胱氨酸殘基是保守的[19]。
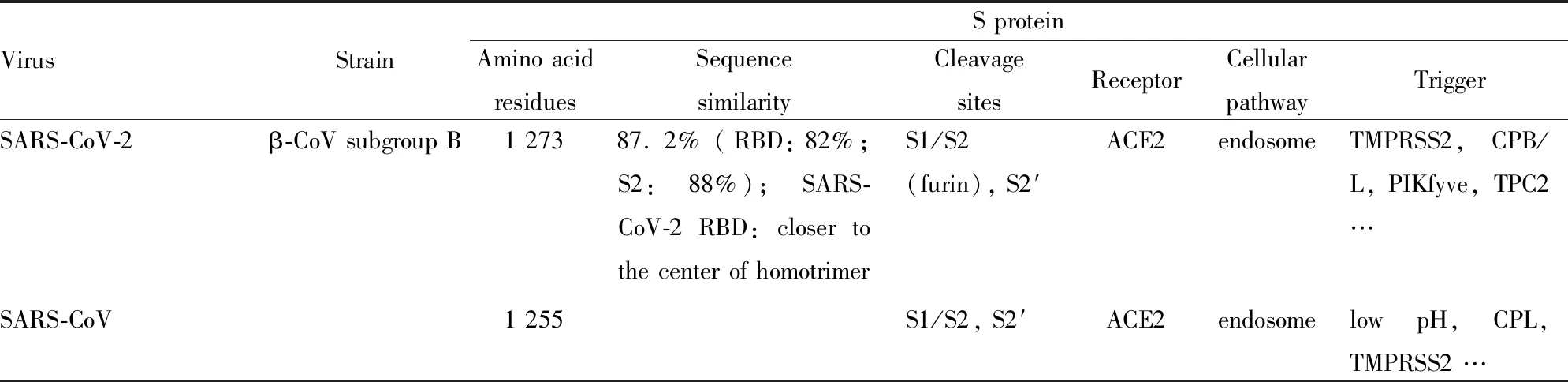
Tab 1 Comparison of structure and function of SARS-CoV-2 and SARS-CoV S proteins
1.3 SARS-CoV-2 S蛋白具有弗林蛋白酶(furin)識別位點冠狀病毒含S1/S2和S2′兩個酶切位點,宿主蛋白酶通過在這兩個位點剪切以激活S蛋白是影響病毒宿主嗜性和致病性的重要因素[5]。多個研究發現[9, 13, 19-22],與其他SARS相關冠狀病毒相比,SARS-CoV-2 S蛋白在S1和S2交界處(S1/S2位點)有1個獨特的4個氨基酸殘基插入(681-PRRA-684,或核苷酸位置為23619~23632),形成了1個“RRAR”多堿性furin酶切位點。這個特征在多種禽流感和人類流感病毒中常見,但在冠狀病毒中少見[13]。SARS-CoV-2 S蛋白同時具備furin(R685)和胰蛋白酶(R815)酶切位點,分別對應SARS-CoV的胰蛋白酶切位點(R667和R797)[20]。酶切效率預測顯示,SARS-CoV-2比SARS-CoV在S1/S2位點有更高的剪切效率[21]。相對于SARS-CoV,furin的廣泛表達可能參與擴大SARS-CoV-2的宿主嗜性,增加其傳播性,甚至改變其致病性。同時,蛋白三維結構預測顯示,S1/S2位點4個插入的氨基酸殘基在SARS-CoV-2 S蛋白表面形成一個延伸的loop,該loop結構易于被跨膜絲氨酸蛋白酶2(transmembrane protease serine 2,TMPRSS2)識別[21]。
1.4 SARS-CoV-2 S蛋白表面的糖基化修飾及功能冠狀病毒S蛋白被從三聚體表面伸出的非均相N-連接聚糖密集地修飾,這些低聚糖參與S蛋白折疊,影響宿主蛋白酶的啟動,還可能調節抗體識別[5]。SARS-CoV-2和SARS-CoV S蛋白分別包含22和23個N-連接糖基化位點。SARS-CoV-2 S蛋白的22個N-連接糖基化位點有20個在SARS-CoV中保守,其中包含S1部分13個中的9個及S2部分僅有的9個[9]。Shajahan等[23]通過高分辨率質譜技術對SARS-CoV-2糖基化修飾進行表征,在22個N-連接糖基化位點觀察到17個N-連接聚糖。與其他SARS相關冠狀病毒相比,SARS-CoV-2 S蛋白表面的furin酶切位點附近有3個獨特的O-連接聚糖位點(S673、T678和S686)[24]。此外,Shajahan等[23]在SARS-CoV-2 S蛋白RBD區域內觀察到2個O-連接聚糖修飾(T323和S325)。盡管O-連接聚糖結構的潛在功能尚不清楚,但其可產生1個“粘蛋白樣結構域”,以保護SARS-CoV-2 S蛋白上的某些潛在表位或關鍵氨基酸殘基[24]。
2 ACE2及RBD-ACE2復合物的結構與功能
2.1 ACE2是SARS-CoV-2感染宿主細胞的功能性受體金屬肽酶ACE2是具有單一胞外催化結構域的I型跨膜糖蛋白[25]。人ACE2蛋白分子量約120 ku,由805個氨基酸殘基組成,廣泛分布于腎臟、肺臟、心血管及胃腸道系統,在調節心、腎功能及控制血壓中起關鍵作用[25]。ACE2由1個N端催化結構域和1個C端Collectrin樣結構域組成(Fig 1)。先前SARS-CoV已被證實通過結合ACE2感染人體細胞[26]。SARS-CoV的S蛋白三聚體通過識別ACE2催化域的疏水區位點與ACE2結合,隨后細胞內化作用導致病毒顆粒內吞,繼而造成SARS-CoV感染[26]。最近多個研究[2, 8, 10-12]表明,ACE2也是SARS-CoV-2感染宿主細胞的功能性受體,并且宿主蛋白酶如TMPRSS2可能參與入侵過程。Zhou等[2]使用來自人、中華菊頭蝠、果子貍、豬及小鼠表達或不表達ACE2的HeLa細胞進行病毒感染研究,發現SARS-CoV-2能夠利用除小鼠外所有其他物種的ACE2作為進入細胞的受體。Hoffmann等[10]使用了一種SARS-CoV-2不易感的BHK-21細胞進行研究,發現只有在ACE2表達的情況下,SARS-CoV-2才能有效入侵細胞,表明ACE2是SARS-CoV-2入侵細胞需結合的受體。進一步研究發現,TMPRSS2和內體組織蛋白酶B/L能協同激活SARS-CoV-2 S蛋白,引發病毒受體結合和膜融合,且TMPRSS2的作用更為關鍵[10]。
2.2 RBD-ACE2復合物的結構及功能Yan等[14]通過Cryo-EM技術解析了人ACE2全長蛋白與中性氨基酸轉運載體B0AT1(ACE2-B0AT1)復合物的三維結構,發現ACE2-B0AT1以二聚體形式存在,隨著ACE2肽酶結構域(peptidase domain,PD)的移位而呈現開放和關閉2種構象,PD的爪狀結構提供了冠狀病毒S蛋白的直接結合位點。結構建模顯示,ACE2-B0AT1二聚體可同時和2個S蛋白三聚體結合,并且無論開放還是關閉狀態下,S蛋白都位于ACE2-B0AT1的外側。他們又進一步解析了RBD-ACE2-B0AT1三元復合物的三維結構,發現SARS-CoV-2 S蛋白RBD與ACE2 PD主要通過極性殘基相互作用介導識別,這與SARS-CoV相似[14]。與ACE2-B0AT1不同,僅觀察到RBD-ACE2-B0AT1關閉的構象。RBD一段延長的loop區域像一座橋跨越在ACE2的拱形α1螺旋上,橋的兩端主要附著在α1的N-(稱為右側)和C-(稱為左側)終端,α1的中間段參與增強兩極殘基的相互作用。在左側,RBD的Gln498、Thr500、Asn501與ACE2的Tyr41、Gln42、Lys353、Arg357形成氫鍵網絡;在中間,RBD的Lys417、Tyr453分別與ACE2的Asp30、His34相互作用;在右側,RBD的Gln474與ACE2的Gln24氫鍵結合,而Phe486則通過范德華力與ACE2的Met82相互作用。比較SARS-CoV-2、SARS-CoV與ACE2結合界面,發現了大量的序列變化和構象差異,其中最顯著的變化是位于SARS-CoV RBD中間位置的Val404在SARS-CoV-2中被替換為Lys417,這可能改變RBD與ACE2的親和力。Lan等[15]利用X射線衍射技術對SARS-CoV-2 RBD-ACE2復合物晶體結構進行解析,發現RBD-ACE2組成包括RBD的Cys336-Glu516位殘基、PD的Ser19-Asp615位殘基及63個溶劑分子。SARS-CoV-2 RBM的凹面型外表面容納ACE2的N端螺旋結構,形成一個主要的連接界面。SARS-CoV RBD-ACE2界面共發現16個RBD殘基與20個ACE2殘基連接,而SARS-CoV-2 RBD-ACE2界面有18個RBD殘基和20個ACE2殘基連接,二者20個ACE2殘基中有17個一致并且大部分位于N端螺旋結構上。二者界面的1個突出和共同的特征是親水相互作用網絡,SARS-CoV-2 RBD-ACE2界面有17個氫鍵和1個鹽橋,SARS-CoV RBD-ACE2界面有12個氫鍵和2個鹽橋;另1個共同特征是多個酪氨酸殘基參與形成與極性羥基的氫鍵相互作用,這些包括來自SARS-CoV-2 RBD的Tyr449、489、495、505及來自SARS-CoV RBD的Tyr436、475、491。在二者RBM與ACE2相互作用的14個共有殘基中有8個殘基相同;6個不同的殘基中,SARS-CoV的Tyr442、Leu472、Asn479和Thr487已被證實是參與ACE2結合的關鍵殘基。另一研究顯示,參與SARS-CoV RBD與ACE2結合的6個關鍵氨基酸殘基(Tyr442、Leu472、Asn479、Asp480、Thr487、Tyr4911)在SARS-CoV-2中均被替換,這可能改變病毒與ACE2的結合親和力[24]。Wrapp等[13]利用表面等離子共振技術對S蛋白胞外域與ACE2的親和力進行分析,發現SARS-CoV-2 S蛋白與ACE2的親和力約是SARS-CoV的10~20倍,推測這種高親和力可能是SARS-CoV-2比SARS-CoV更容易人傳人的原因之一。
3 SARS-CoV-2的入胞途徑
冠狀病毒入侵宿主細胞的過程主要包括受體結合、S蛋白裂解、膜融合三個步驟,它們相互協調,遵循一定的時空模式。在整個過程中,一些相關的宿主細胞蛋白酶如furin、TMPRSS-2、組織蛋白酶或胰蛋白酶等可通過不同途徑對S蛋白或受體進行酶切,促進病毒的入侵。冠狀病毒RBD對宿主細胞膜表面受體進行識別并與之結合后,促使細胞膜內陷,導致病毒顆粒被內吞,隨后S1和S2分子間的結合力減弱,或者S蛋白被宿主蛋白酶剪切成S1和S2,S2從融合前構象轉變為融合后構象,S2上的疏水FP插入細胞的內體膜,HR1和HR2反向折疊形成六螺旋束,使得病毒囊膜與內體膜相互靠攏發生膜融合,進而釋放核衣殼或病毒基因組到細胞質中[27]。
SARS-CoV感染宿主細胞時,首先與細胞膜表面ACE2結合,隨后通過內吞途徑進入內體,內體的低pH環境和組織蛋白酶L、TMPRSS2等相關宿主蛋白酶可裂解活化S蛋白引發病毒囊膜與內體膜膜融合(Tab 1)[28-29]。此外,SARS-CoV S蛋白在胞外可被胰蛋白酶、嗜熱菌蛋白酶、彈性蛋白酶等活化,促進合胞體的形成。與SARS-CoV一致,SARS-CoV-2可通過內吞途徑進入細胞(Tab 1)。Ou等[8]發現SARS-CoV-2主要通過內吞作用進入穩定表達ACE2的人胚胎腎細胞HEK 293細胞,磷脂酰肌醇3-磷酸5-激酶、雙孔通道2蛋白和組織蛋白酶L對于病毒進入細胞至關重要。然而,SARS-CoV-2 S蛋白可以非依賴外源性蛋白酶而觸發合胞體,提示在沒有外源性蛋白酶啟動或激活的情況下,受體結合可觸發SARS-CoV-2 S蛋白,這與SARS-CoV不同[8]。研究還發現SARS-CoV-2 S蛋白的穩定性比SARS-CoV的S蛋白低,提示SARS-CoV-2 S蛋白可通過降低其熱穩定性來降低其能量屏障,這可能有助于提高SARS-CoV-2的傳播效率[8]。
4 小結與展望
作為冠狀病毒重要的結構蛋白,S蛋白是位于病毒囊膜表面的同源三聚體蛋白,介導受體結合和膜融合過程,是決定病毒宿主嗜性、入侵能力和毒力的關鍵因素以及藥物研發的重要靶點。S蛋白的三維結構解析揭示,SARS-CoV-2 S蛋白三聚體存在多種不同的構象狀態,其自發地采取封閉和開放的構象對于受體的結合和膜融合構象變化的啟動至關重要。這與具有高致病性的SARS-CoV、MERS-CoV的S蛋白結構類似,而在其他4種可感染人類的低致病性冠狀病毒中僅觀察到S蛋白的封閉構象。ACE2是SARS-CoV-2感染宿主細胞的功能性受體,TMPRSS2等相關宿主蛋白酶可能參與激活S蛋白,引發病毒入侵細胞。RBD-ACE2復合物的三維結構解析揭示,SARS-CoV-2和SARS-CoV的RBD-ACE2結合界面在包埋區域、相互作用殘基及親水作用網絡等方面有很大相似性,但表面靜電勢存在差異,6個關鍵氨基酸殘基的突變可能導致病毒與ACE2結合親和力的改變。SARS-CoV-2 S蛋白中獨特furin酶切位點的插入以及RBD與ACE2更高的結合親和力可能是導致其比SARS-CoV傳染性更強的重要原因。盡管SARS-CoV-2可通過內吞途徑進入細胞,但其具體的入侵過程和機制仍需進一步研究闡明。總之,SARS-CoV-2 S蛋白、ACE2及RBD-ACE2復合物結構的解析與功能的闡明將為抗SARS-CoV-2的入侵機制和抗病毒藥物的設計提供有力的線索。
(致謝:本文在南昌大學第一附屬醫院臨床藥理研究室完成,感謝全體實驗室人員對文章相關工作的指導和建議!)

