桔梗皂苷D對MH7A細胞遷移和侵襲的影響及其機制的研究
王菊 李龍 曾家順
(貴州醫科大學,貴州 貴陽 550004)
類風濕關節炎(rheumatoid arthritis,RA)是一種以持續性滑膜炎和進行性關節破壞為特征的慢性炎癥性自身免疫疾病,最終導致關節畸形和肢體殘疾[1]。成纖維樣滑膜細胞(fibroblast-like synoviocytes,FLS)是關節滑膜細胞中主要的一種細胞類型,在RA慢性炎癥環境中被激活時,具有腫瘤樣細胞的某些特征,致使RA滑膜炎和關節破壞不斷進展,在RA發病過程中起著至關重要的作用[2-4]。桔梗皂苷D(platycodin D,PD)是常用傳統中藥桔梗的主要活性成分之一,具有抗炎、抗氧化、免疫調節、抗腫瘤等多種生物學和藥理學作用[5]。PD能有效抑制人類風濕關節炎成纖維樣滑膜細胞株MH7A細胞的增殖并誘導其凋亡,但PD對MH7A細胞遷移和侵襲的影響尚不清楚。因此,本實驗采用人類風濕關節炎成纖維樣滑膜細胞株MH7A細胞,建立RA體外細胞模型[6-7],觀察PD對MH7A細胞遷移和侵襲的影響,初步探討PD治療RA的作用機制。
1 材料與方法
1.1材料 人類風濕關節炎成纖維樣滑膜細胞株MH7A,購自北納生物科技有限公司。PD(純度≥98%,上海源葉生物科技有限公司);二甲基亞砜(DMSO,美國Sigma公司);DMEM高糖培養基,胎牛血清,胰蛋白酶,雙抗(美國Gibco公司);CCK-8試劑盒(貴州泰思騰生物科技有限公司);Transwell小室(8 μm孔徑)和基質膠(美國Thermo公司);ECL Plus發光試劑盒、SDS-PAGE蛋白上樣緩沖液(5×)、PMSF、BCA蛋白濃度測定試劑盒(上海碧云天生物技術有限公司);WB抗體P-PI3K、PI3K、P-PAKT、AKT,β-Actin,WB二抗(Genetex,貴州泰思騰生物科技有限公司)等。
1.2方法
1.2.1PD的制備 取20 mg PD,加適量的DMSO溶解,用直徑為0.22 μm的無菌濾器進行過濾,放入無菌小瓶中,密封后避光置于4℃冰箱保存。用時取出,加適量DMEM培養基,配成所需濃度,最終濃度的DMSO含量為0.05%。
1.2.2體外細胞培養 將MH7A細胞接種于含15%胎牛血清和1%雙抗的DMEM高糖培養基中,置于37℃、飽和濕度、5%CO2恒溫培養箱中培養,當細胞融合到70%~80%時,用PBS洗3次,用含0.25%胰蛋白酶消化細胞,用DMEM完全培養基終止消化,按1∶2 傳代,進行實驗。
1.2.3Wound-healing實驗檢測細胞遷移的影響 取正常培養的對數生長期的MH7A細胞,消化、離心收集細胞,計數板下計數,制成3×105個/mL的單細胞懸液,每孔2 mL接種于6孔板,每板接種4個孔,放入培養箱中靜置過夜。待MH7A細胞生長融合到80%~90%,棄原培養基,用200 μL槍頭劃傷細胞,用1×PBS洗2遍后加入無血清培養基培養,拍照記錄為0 h時的細胞劃痕狀態。隨后加入含PD藥物(濃度分組為5、10、15 mg/L)的無血清DMEM培養基,同時設置空白對照組(無PD,含0.05%DMSO的無血清DMEM培養基),藥物作用12 h,在顯微鏡下觀察和計數,并評價細胞遷移能力,放大倍數為100×,拍照記錄為12 h時的細胞劃痕狀態。實驗獨立重復3次。
1.2.4Transwell實驗檢測細胞侵襲的影響 實驗前,在冰浴下,取10 mg/mL的基質膠與等體積的無血清培養基輕輕混勻,加入到Transwell小室的上層,37 ℃孵育4~6 h。待基質膠凝固后進行侵襲實驗。細胞鋪板同劃痕實驗。待MH7A細胞生長融合到80%~90%,棄原培養基,加入含PD的DMEM培養基(實驗分組同劃痕實驗),藥物作用24 h。取各組細胞,消化、離心并重懸,計數板計數,取1×105個細胞/well種于Transwell小室的上室,下室加入10%血清的培養基500 μL,繼續培養24 h。取出小室,固定,染色,計數;顯微鏡下拍照,放大倍數為200×,并評價細胞侵襲能力。實驗獨立重復3 次。
1.2.5Western blotting檢測PI3K/AKT信號通路蛋白表達 取正常培養的對數生長期的MH7A細胞,將原培養基更換為含PD藥物(濃度分組為5、10、15 mg/L)的DMEM培養基,同時設置空白對照組(無PD,含0.05%DMSO的DMEM培養基),繼續培養24 h后,消化、離心收集細胞,將各組細胞樣收集到1.5 EP管中,每管加入細胞裂解液200 μL,提取各組細胞總蛋白,根據BCA法測定蛋白濃度,加入5×上樣緩沖液混勻,100 ℃煮沸10 min,迅速冰浴中冷卻,上樣量為每泳道約30 μg。15%的SDS-PAGE凝膠電泳后,轉移至PVDF膜上,5%脫脂牛奶室溫水平搖床上封閉1 h,TBST洗膜3次,10 min/次,分別加相應一抗p-AKT、AKT、p-PI3K、PI3K,稀釋比為1:1 000,β-Actin稀釋比為1∶5 000,4 ℃ 孵育過夜,洗膜后加入二抗,稀釋比為1∶5 000,室溫水平搖床上孵育1 h。洗膜后加入ECL發光劑,用凝膠成像系統拍照成像。用ImageJ軟件分析條帶灰度值,以內參β-actin作對照,計算各組目的蛋白的相對表達量。實驗獨立重復3 次。
1.3統計學方法 采用GraphPad Prism5軟件進行統計分析作圖,所有實驗數據進行方差齊性和正態性檢驗,組間差異兩兩比較采用t檢驗,P<0.05為差異有統計學意義。
2 結 果
2.1PD對MH7A細胞遷移的影響 實驗結果回示,PD為0 mg/L,細胞遷移率(63.49±7.76)%;PD為5 mg/L,細胞遷移率(40.70±3.59)%;PD為10 mg/L,細胞遷移率(16.45±1.68)%;PD為15 mg/L,細胞遷移率(3.66±2.97)%。與空白對照組比較,隨著PD濃度的不斷增加,MH7A細胞遷移運動能力減弱,跨越劃痕的細胞明顯減少,細胞遷移百分比顯著減小,差異有統計學意義(P<0.01)。見圖1。說明PD能減弱MH7A細胞的遷移能力。
2.2PD對MH7A細胞侵襲的影響 實驗結果回示,PD為0 mg/L,細胞數目(26.87±0.61)個;PD為5 mg/L,細胞數目(20.93±0.83)個;PD為10 mg/L,細胞數目(15.33±0.58)個;PD為15 mg/L,細胞數目(9.67±0.23)個。與空白對照組比較,隨著PD藥物濃度的增加,MH7A細胞侵襲能力明顯減弱,穿過小室的細胞數顯著減少,差異有統計學意義(P<0.01)。見圖2。說明PD能減弱MH7A細胞的侵襲能力。
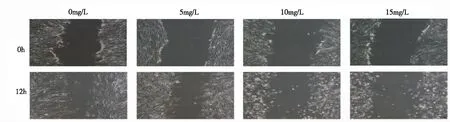
圖1 PD對MH7A細胞遷移的影響(100×)
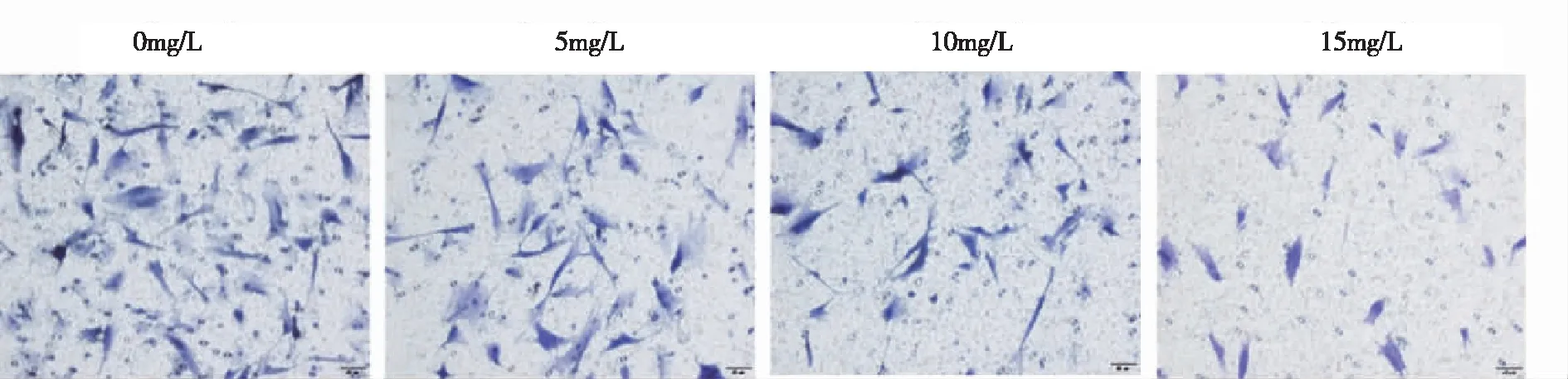
圖2 PD對MH7A細胞侵襲的影響(200×)
2.3PD對MH7A細胞內PI3K/AKT信號通路蛋白的影響 見圖3,與空白對照組比較,PD各濃度組細胞內p-PI3K蛋白表達水平均顯著降低,差異有統計學意義(P<0.01);PD各濃度組細胞內p-AKT蛋白表達水平降低,其中15 mg/L濃度組下降顯著,差異有統計學意義(P<0.05),見表1。說明PD能抑制MH7A細胞內PI3K/AKT信號通路。
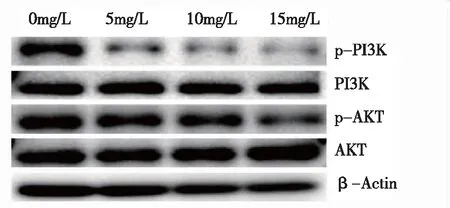
圖3 PD對MH7A細胞內PI3K/AKT信號通路蛋白表達的影響
表1 PD對MH7A細胞內PI3K/AKT信號通路蛋白表達的影響
3 討 論
RA的基本病理改變主要為滑膜組織增生、血管翳形成,早期炎癥環境刺激滑膜組織遷移,侵入關節內結構,破壞軟骨和軟骨下骨,最終導致不可逆的關節破壞和功能喪失[8]。目前臨床上的治療藥物僅能使RA病情緩解,仍無法治愈疾病,RA已逐漸成為造成人類喪失勞動力和殘疾的主要原因之一[9]。近年來,研究[3-4,10]表明,RA滑膜襯里層的FLS在炎癥環境中被激活,并向腫瘤樣細胞轉化,表現出增生活躍、凋亡缺失、遷移和侵襲能力增強的特征,是RA發病過程中的重要環節。研究[11-12]表明PD能有效抑制腫瘤細胞增殖、誘導細胞凋亡、抑制細胞遷移和侵襲的攻擊行為。本研究結果表明,PD能明顯減弱MH7A細胞遷移運動能力和侵襲能力,說明PD能有效抑制MH7A細胞遷移和侵襲的腫瘤樣細胞行為。為進一步探索其作用機制,本研究檢測了PD對MH7A細胞內PI3K/AKT信號通路蛋白表達的影響。
PI3K/AKT信號通路是重要的細胞內信號通路,調節多種細胞過程,如細胞增殖、分化、遷移、侵襲等,在多數腫瘤細胞中處于活躍狀態[13]。在RA的發病機制中,PI3K/AKT信號通路被異常激活,導致FLS出現過度增殖、遷移和侵襲的生物學行為,與RA的發生發展密切相關,抑制該信號通路已成為一種有用的治療RA的方法[14]。據PD抗腫瘤作用的相關研究表明,PD能通過抑制PI3K/AKT信號通路發揮抗癌作用[7]。C.Jaemoo[15]等的研究證明PD可以通過阻斷PI3K/AKT信號通路有效抑制乳腺癌中高轉移性MDA-MB-231細胞活力、遷移和侵襲的行為。本研究發現細胞內p-PI3K、p-AKT蛋白表達水平隨著PD濃度的升高而降低,說明PD能抑制MH7A細胞內PI3K/AKT信號通路。
綜上,通過本實驗,初步證明PD能抑制MH7A遷移和侵襲的行為,推測其可能的作用機制是通過抑制細胞內PI3K/AKT信號通路發揮作用,為PD用于治療RA提供了理論依據。而PD是否通過直接作用于PI3K/AKT信號通路或其他通路影響細胞遷移和侵襲的行為,我們將在本研究的基礎上,進一步深入探索。
(本文圖1,圖2見封三)

