黃酮及生物堿類成分體外吸收轉運機制研究進展
米 曉 張建霞 王艷艷(通訊作者)
(黑龍江中醫藥大學,黑龍江哈爾濱,150040)
Caco-2細胞系是由Fogh及其同事通過克隆人類的結腸癌細胞建立的,最初用于篩選抗腫瘤藥物的細胞毒性作用,并用于耐藥機制研究。研究發現Caco-2細胞在滲透性濾膜上可自發進行上皮樣分化,形成與正常的小腸上皮相似的單層膜,也具有緊密連接和微絨毛,該模型亦含有多種轉運蛋白、受體和代謝酶,如細胞色素P450 1A(CYP1A)、硫轉移酶(SULTs)、UDP-葡萄糖醛糖基轉移酶(UGTs)和谷胱甘肽S-轉移酶(GSTs)等。因而,Caco-2細胞模型是最佳的模擬腸上皮細胞的體外替代模型,常用于體外藥物跨細胞轉運機制的研究,從而可進一步預測藥物在人小腸中吸收情況。國內外研究顯示,采用Caco-2細胞模型來研究中藥中的生物堿類和黃酮類化合物的應用最廣泛[1]。
本文旨在通過檢索國內外文獻,總結黃酮類及生物堿類化合物在Caco-2細胞模型中的吸收轉運的特點。其中,中文文獻資料來源于中國知網,采用主題詞“Caco-2”搭配“黃酮”或“生物堿”及“吸收”、“轉運”等副主題詞,在全部文獻范圍內進行模糊檢索。英文文獻來源于Pubmedplus課題輔助分析與智能選刊投稿系統(醫知網),采用“Caco-2”和“flavone”或“alkaloid”及“absorb”、“transport”等搭配,在全部文獻范圍內檢索。
1 黃酮類化合物在Caco-2細胞模型中的吸收轉運特點
1.1 常見中藥中黃酮類成分的吸收轉運特點:研究表明黃酮類化合物主要通過主動轉運、被動轉運以及擴散的方式進入Caco-2細胞。[2]時間、藥物濃度、溫度及pH均可影響Caco-2細胞對黃酮類物質的吸收與轉運。部分黃酮類化合物在生物條件下,可自發轉化為酚酸和醛,其中多酚在人體內進行生物轉化過程中,第一階段包括氧化、還原和水解,這些轉變發生的頻率較低,第二相轉變包括不同形成的共軛反應(甲基,葡萄糖醛酸),此過程比肝臟和腸道發生的生物轉化更強烈。表1主要選取了一支蒿、水飛薊、葒草、葛根、丹參、仙茅、紅花、燈盞細辛、旱芹、補骨脂、短葶飛蓬、黃芩、甘草、金蓮花14種藥物[3-12],總結了Caco-2細胞對不同中藥中黃酮類化合物吸收的研究。
在所涉及的中藥中,除一枝蒿的主要成分6-去甲氧基-4′-O-甲基菌陳色原酮、仙茅中的仙茅苷轉運方式為主動轉運外,其他均以被動轉運為主,包括水飛薊賓水飛薊賓葡甲胺、槲皮素、山柰酚、葛根中的大豆苷元和芒柄花素、旱芹中的芹菜素、甘草 中 的 licochalcone B、licochalcone C、echinatin、liquiritigenin。補骨脂中的新補骨脂異黃酮轉運方式既有主動轉運,也有被動轉運,其轉運蛋白為P-gp、MRP2、BCRP底物,金蓮花中的成分其轉運方式均受P-gp、MRP2蛋白的影響,葒草素、牡荊素、2’-O-β-L-galactopyranosylorientin、2’-O-β-L-galactopyranosylvitexin轉運方式包括主動轉運和被動轉運 ,isoswertisin、isoswertiajaponin、2’-O-(2’’’-methylbutanoyl)轉運方式為被動轉運。
在分析過程中發現,黃酮類化合物在Caco-2細胞模型中轉運方式主要為被動轉運,呈現時間以及濃度依賴性,在所涉及的外排轉運蛋白中,受P-gp影響的黃酮類化合物居多,在37℃、酸性條件下吸收較好。黃酮類化合物的吸收非常復雜,早期主要認為其吸收程度與分子的親脂性和糖基化有關,但最近大量研究表明,黃酮類化合物的吸收與膜表明面的轉運體蛋白及酶的作用密切相關。用具有緊密聯結的Caco-2細胞單層可系統地評價化合物穿過小腸最主要的轉運屏障——小腸上皮細胞的各個步驟,有效的分析各種影響藥物透過小腸上皮轉運的物理化學和生化因素,從而預測黃酮類化合物的生物利用度。
1.2 化學結構對黃酮類化合物吸收轉運的影響:Tian等[13]人為了研究黃酮類化合物結構-滲透性關系,進行了36種黃酮類化合物(包括黃酮,黃酮醇,二氫黃酮,二氫黃酮醇,異黃酮,查爾酮等)在Caco-2細胞模型中的的跨膜轉運和細胞攝取研究。結果表明,親脂性結構結構,游離羥基的數量和位置,Caco-2細胞的積聚和外排等因素在黃酮類化合物跨Caco-2細胞單層的轉運中起關鍵作用。Zhu等[14]人利用Caco-2細胞模型和大鼠血腦屏障細胞對葛根素,蘆丁,橙皮苷,槲皮素,染料木黃酮,山奈酚,芹菜素和異甘草素8種對心腦血管有益的黃酮類化合物進行了滲透性研究,結果發現,糖苷和羥基數目的增加不利于黃酮類化合物的在細胞中的滲透,且羥基位置對細胞滲透性也有一定影響,鄰羥基苯的滲透性要高于間羥基苯。Deprez,S[15]等人用Caco-2細胞滲透模型研究了proanthocyanidins(PAs)和(1)-catechin monomer的腸吸收特性,結果發現,相對于槲皮素和白楊素這種羥基化程度較低而以被動轉運方式透過腸上皮細胞的化合物,proanthocyanidins(PAs)和(1)-catechin monomer 主要通過細胞旁路途徑進行轉運。Fang[16]等人在有或無維拉帕米的情況下對27種黃酮類化合物在Caco-2細胞中的攝取和排出進行了研究,結果表明在存在 4′-OCH3,3′-OCH3,并且不存在 3′-OH、3-OH和4′-OH的情況下黃酮類化合物與P-gp結合較為困難,更有利于對黃酮類化合物的攝取。Liu[17]等人利用Caco-2細胞研究金線蓮中其中黃酮類化合物的腸道吸收機制,結果發現C-7處的羥基或甲氧基決定了外排轉運蛋白的參與,C-2''存在游離態羥基的是P-糖蛋白(P-gp)的底物,此外,C-2'處的游離羥基還決定了是多重耐藥蛋白2(NRP2)的底物。
1.3 外排蛋白對黃酮類化合物吸收轉運的影響:Caco-2細胞含有許多與藥物轉運有關的酶或載體,如肽酶 、酯酶,P-gp、肽、有機陽離子轉運體和有機陰離子轉運體等。P-gp是一種外排轉運體,其在Caco-2細胞中高度表達。李素云等[18]人利用Caco-2細胞研究了P-gp對槲皮苷腸道吸收過程中跨膜轉運和代謝轉化的影響,結果發現,P-gp會將進入腸上皮細胞的槲皮苷泵出到腸腔,從而影響槲皮苷的腸道吸收,但其對槲皮苷在腸道吸收過程中的動態吸收特征和代謝轉化沒有影響。
1.4 pH對黃酮類化合物吸收轉運的影響:陳浩等[19]人研究了葒草花中提取的5種黃酮類化合物在pH為5.0、6.0和7.4在Caco-2細胞中的吸收特性,實驗結果表明,黃酮類化合物在酸性條件下更有利于吸收,這可能與其化合物本身含有酚羥基酸性基團有關。當化合物呈酸性時,在中性和偏堿性的環境中以電離形式存在,導致其提取物在細胞膜的滲透性降低。郭閃[20]等人研究了芹菜素在Caco-2細胞中的攝取研究,對PH考察的結果顯示當pH<7.4時,其攝取量隨著pH值升高而增加,pH>7.4時攝取量下降,表明中性條件下攝取較好,酸性條件下不利于其攝取,芹菜素在小腸中的吸收可能較胃中好。
2 生物堿類化合物在Caco-2細胞模型中的吸收轉運特點
生物堿類化合物是科學家研究最早的一類具有多種生物活性的重要天然有機化合物,常用中藥的該類有效成分主要具有鎮痛、止痙、抗高血壓、抗心律失常、抗腫瘤以及抗菌消炎等作用。2009年至2015年間,基于Caco-2模型研究生物堿類成分的吸收轉運機制的相關研究較多,但近年來逐漸減少。
現將數據庫中篩選罌粟、麻黃、北豆根、苦參、苦參、黃連、延胡索、烏頭、漢防己、烏頭、吳茱萸、黑順片、藜蘆等13種藥物,介紹了Caco-2細胞對其黃酮類化合物吸收的研究[21-26]:表2所示,生物堿類化合物在Caco-2細胞模型中轉運方式主要為被動轉運,多數化合物P ratio值偏低。與黃酮類化合物相比,生物堿類化合物的吸收轉運受時間、溫度、Ph以及轉運蛋白的影響較小。該類成分已發表的文章較少,期待對此類化合物有更多的研究發現。
3 小結與展望
Caco-2細胞模型被認為是最常見的考察藥物體外吸收轉運的模型,該模型對中藥黃酮類和生物堿類化合物腸吸收的研究具有重要意義。通過對兩類成分的腸代謝和轉運途徑的研究,為指導、設計、遴選口服中藥及其劑型和評估其在體內安全性的奠定基礎。[27-31]然而,該模型仍然存在一些異質性和局限性,如Caco-2細胞與腸道細胞的主要區別是Caco-2細胞沒有黏液層,盡管有學者已經進行了與Caco-2細胞共培養粘蛋白分泌細胞系(HT-29)的研究,但沒有給出預期的結果。此外,Caco-2細胞模型的實驗結果在不同實驗室之間的重復性差也成為該模型推廣的壁壘。因此,有必要對該細胞起源、傳代數、孵化時間等重要參數進行標準化研究。
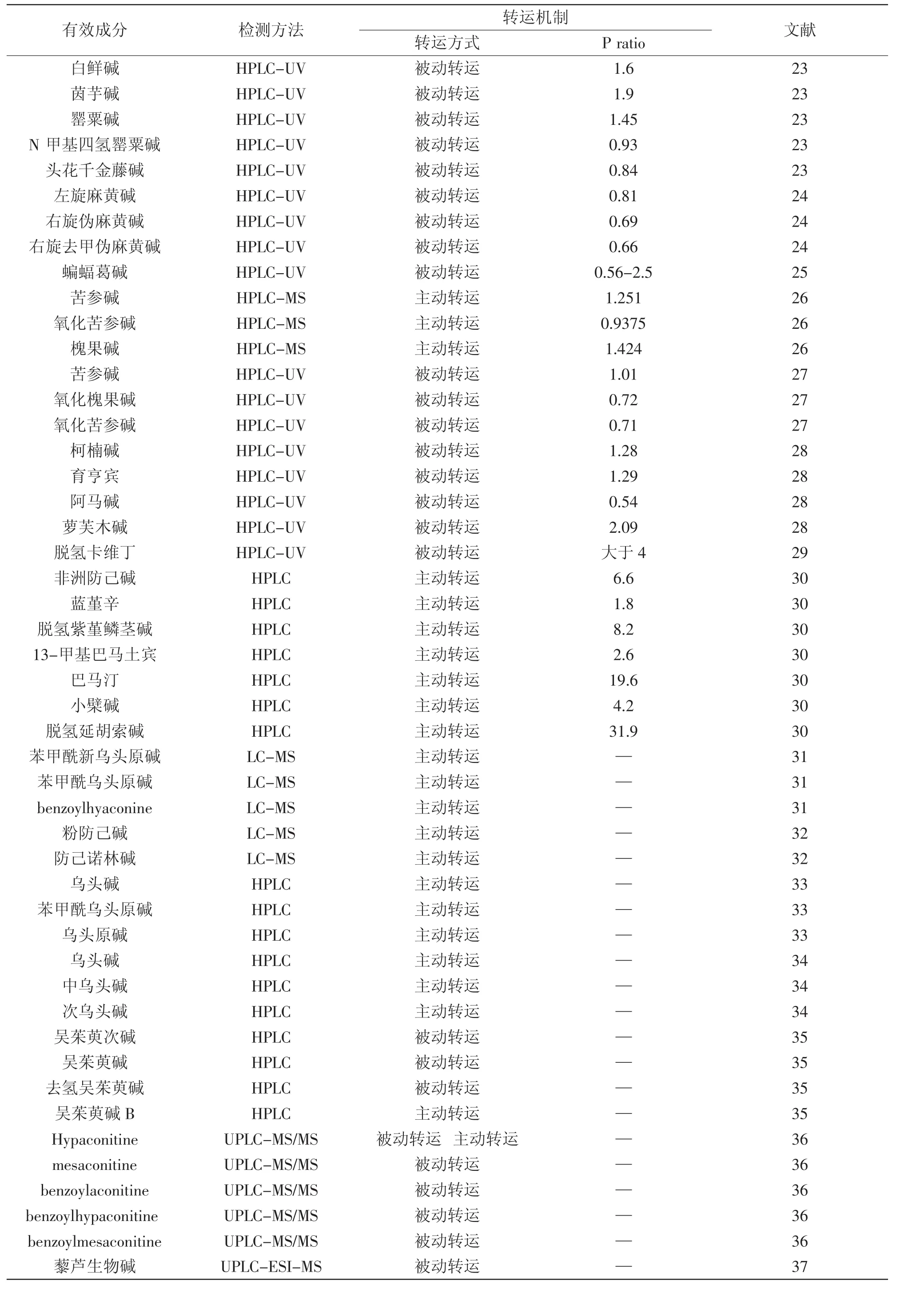
表1 Caco-2細胞模型中生物堿類化合物的吸收轉運

