高分子纖維及其集合體的拓撲結構對細胞行為的調控
武小童,何 兒,王 璐,劉來俊,李超婧,王富軍
(東華大學 a. 紡織學院;b. 紡織面料技術教育部重點實驗室,上海 201620)
由于高分子纖維基材料具有較高的強度、柔性、孔隙率以及比表面積等特點,與人體組織的結構和力學性能相似,因此,在植入修復型醫療器械中具有廣泛的應用和巨大的發展潛力。目前,高分子纖維基材料已經被應用于手術縫合線[1-3]、傷口敷料[4-6]、疝氣修復補片[7-9]與人工心臟瓣膜[10-12]等生物醫用材料中。特別是隨著再生醫學概念的提出與推廣,誘導組織再生成為生物醫用材料的重要發展方向。高分子纖維基材料能從物理結構上高度模擬細胞外基質[13],從而為細胞的生長繁殖提供有利環境,因此受到廣泛關注。目前,利用高分子纖維基材料誘導諸如皮膚[14-16]、血管[17-19]、韌帶[20-22]、肌腱[23-25]、膀胱[26-28]、神經[29-31]及軟骨[32-34]等組織再生的研究層出不窮。研究發現,通過構建纖維材料拓撲結構可達到提高材料和生物體整合的效果,且該效果可持續作用于材料的整個服役周期[35-40]。因此,研究拓撲結構對細胞行為的調控對于提升材料誘導組織再生的能力具有重要意義。
高分子纖維基材料的拓撲結構包括兩大層次:單纖維結構與纖維集合體結構。單纖維結構包括溝槽結構、多孔結構、串晶結構等;纖維集合體的結構參數包括纖維直徑、纖維取向、孔徑/孔隙率、孔形等,如圖1所示。高分子纖維及其集合體的拓撲結構對細胞行為有顯著影響。文獻[41-42]綜述了纖維直徑、取向與孔尺寸等結構參數對細胞行為的影響,但未對細胞的各項行為分類進行討論。Beachley等[43]綜述了纖維基支架結構對細胞形態、黏附、增殖和分化等行為的影響,但未對支架的多項結構參數進行分類討論。目前,鮮有針對單纖維形貌對細胞行為的調控作用的綜述文獻。

圖1 全文架構Fig.1 Article structure
本文從高分子纖維基材料的單纖維及其集合體這兩個結構層次出發,較全面地總結評述了拓撲結構對細胞的黏附鋪展、增殖、遷移與分化等行為的調控作用,并對纖維材料結構調控細胞行為的知識體系進行梳理,以期為誘導再生材料的設計提供參考。
1 單纖維結構
1.1 溝槽結構
1.1.1 溝槽結構對細胞黏附和鋪展的調控
具有適當溝槽結構的纖維或基于此類纖維的支架能夠在一定程度上改善細胞的黏附。例如,Sinclair等[44]研究發現,人皮膚成纖維細胞在具有溝槽結構的毛細管通道纖維支架上的黏附優于圓形截面纖維對照組。這是由于表面凹槽形成的二級結構提高了纖維與集合體的比表面積,使得細胞與纖維間的力學相互作用更加緊密。
1.1.2 溝槽結構對細胞增殖的調控
溝槽結構對于細胞增殖具有一定的促進作用,但并非起決定性作用。Park等[45]發現,成骨肉瘤細胞在十字形截面聚己內酯(polycaprolactone, PCL)纖維支架上的增殖量顯著高于圓形、三角形截面纖維支架;Williamson等[46]通過濕法紡絲聯合冷拉伸工藝制備了表面具有溝槽狀紋理的PCL纖維,發現該纖維能夠提升成纖維細胞和成肌細胞的增殖率;Lu等[47]發現,表面帶有微米級凹槽的纖維因其毛細作用而能夠瞬間移動流體,具有向三維支架內部進行物質輸送的潛力。對于貼壁細胞,黏附是增殖的先決條件[48],因此溝槽結構可通過促進細胞黏附間接促進增殖;同時,溝槽結構所增大的比表面積為細胞增殖提供了更多的可用表面;此外,特定尺寸的溝槽具有毛細作用,能夠顯著提升支架的流體輸送性能,提高三維支架內部營養物質與氧氣的遞送效率,從而促進三維支架內部細胞的增殖。
1.1.3 溝槽結構對細胞遷移的調控
溝槽結構能夠引導細胞的遷移方向,如圖2所示。Huang等[49]發現,溝槽結構能夠促進神經細胞的線性生長和細胞骨架的伸長;Lu等[47]將鼠皮膚成纖維細胞和鼠主動脈平滑肌細胞接種至毛細通道纖維支架上,4周后發現細胞在沿凹槽的方向高度對齊并沉積細胞外基質,證實細胞按照凹槽的方向進行遷移;Kang等[50]制備了具有縱向溝槽微結構的扁平帶狀海藻酸鈉纖維,證實溝槽纖維的表面拓撲特征可被成肌細胞和神經細胞感知,并能夠指導其遷移。溝槽結構纖維調控細胞遷移的表觀因素是高度有序的表面凹槽結構所給予細胞的各向異性力學刺激,內在機制是細胞的機械轉導[51],即通過黏著部位感知各向異性力學刺激,并從基因層面調整自身形態特征,沿溝槽方向延伸以適應基質形貌。
(a) 單根圓形纖維

(b) 單根溝槽纖維
溝槽的深度與寬度對細胞遷移有著重要影響,引導不同細胞發生遷移的最佳溝槽寬度并不統一,但基本都集中于微米及亞微米尺度[47, 49, 50, 52]。文獻[53]證實,細胞對于溝槽寬度的感知具有一定的閾值,超過閾值范圍將失去誘導效果。
此外,Andersson等[54]發現,具有連續規則邊緣的凹槽表面誘導細胞取向遷移排列的作用更加明顯。
1.1.4 溝槽結構對細胞分化的調控
文獻[55-56]證實表面溝槽機制對細胞分化存在調控作用,但這些研究都基于平面基質上的溝槽處,而尚未見到針對纖維表面溝槽結構影響細胞分化的研究報道。通過類比可知:在纖維表面設置類似尺度的溝槽同樣能夠對細胞分化產生特定作用;而纖維表面的溝槽結構與纖維的直徑、排列方式可能具有協同作用。因此,通過基于纖維的多尺度結構設計來實現對細胞分化的調控十分令人期待。
1.2 多孔結構
1.2.1 多孔結構對細胞黏附和鋪展的調控
與圓形纖維集合體相比,具有多孔表面結構的纖維集合體能夠顯著增大細胞的鋪展程度,促進細胞的黏附,如圖3(a)和3(b)所示。Jiang等[57]發現,成纖維細胞和內皮細胞在多孔PCL纖維支架上的鋪展程度顯著優于同尺寸圓形纖維支架;Yang等[58]提出細胞的偽足可以錨定在多孔纖維表面的孔隙中,從而改善細胞的黏附作用。多孔纖維有利于細胞黏附,這是因為多孔二級結構所帶來的高比表面積與表面粗糙度有利于黏附蛋白的吸附[59],可為細胞提供更多的結合位點,增大細胞的鋪展程度,進而促進細胞的黏附。
(a) 圓形纖維集合體
(b) 多孔纖維集合體

(c) 串晶纖維集合體
1.2.2 多孔結構對細胞增殖的調控
纖維表面的孔結構有利于細胞增殖。Pant等[60]制備了高度多孔PCL纖維,并使用成骨細胞評估基于該纖維制備的支架,發現相比同尺寸的光滑表面纖維基支架,其細胞增殖情況有顯著改善;Jiang等[57]研究發現,細胞在多孔纖維基支架上的增殖率明顯高于同尺寸的圓形纖維支架。這是由于多孔表面顯著提升了纖維及其集合體的表面粗糙度和比表面積,使得細胞黏附作用顯著增強,增殖空間擴大,進而促進細胞增殖。
1.2.3 多孔結構對細胞遷移的調控
纖維表面特定尺度的孔結構能夠提高細胞與纖維的結合緊密程度,從而加強纖維對細胞定向遷移的引導作用。周祺惠[61]制備了由多孔左旋聚乳酸(poly-L-lactide, PLLA)纖維組成的取向纖維支架,研究發現,隨著纖維表面孔徑的增大和孔隙率的提高,細胞沿纖維軸向的伸長率與取向程度均顯著增大。此外,纖維表面的多孔結構還有利于細胞向支架內部的快速遷移[60]。
1.3 串晶結構
1.3.1 串晶結構對細胞黏附和鋪展的調控
部分纖維表面具有的串晶結構有利于細胞黏附和鋪展,如圖3(c)所示。Jing等[62]將成纖維細胞接種至PCL串晶納米纖維支架上,發現細胞沿纖維鋪展程度高于圓形纖維支架,且可以明顯地看到細胞的絲狀偽足;Wang等[63]指出串晶纖維的高比表面積使其能夠吸附更多的玻連蛋白和纖連蛋白分子,從而進行細胞黏附。
1.3.2 串晶結構對細胞增殖的調控
在纖維表面構建串晶結構,能夠顯著提升細胞的增殖率。Li等[64]發現串晶PCL纖維支架上的豬髂動脈內皮細胞增殖顯著優于圓形PCL纖維支架,并且不同串晶尺寸對于細胞增殖的影響不同,片晶尺寸為100 nm的串晶PCL支架具有最佳的細胞增殖率。
1.3.3 串晶結構對細胞遷移的調控
串晶結構能夠促進細胞向支架內部的遷移。Jing等[65]制備了串晶PCL纖維三維支架并對成纖維細胞的遷移情況進行評估,發現與圓形纖維三維支架相比,串晶纖維三維支架上的細胞向支架內部遷移的深度明顯增大。
目前鮮有關于串晶對纖維細胞定向遷移的調控作用的文獻報道,但通過與多孔纖維類比可知,串晶結構可能會加強細胞與纖維結合的緊密程度,促進纖維對于細胞定向遷移的引導作用。
2 纖維集合體結構
2.1 纖維直徑
纖維直徑直接影響纖維集合體的比表面積及表面粗糙度,因此其對細胞行為有著重要的調控作用。表1總結了多種不同纖維直徑的纖維集合體對不同細胞的作用。
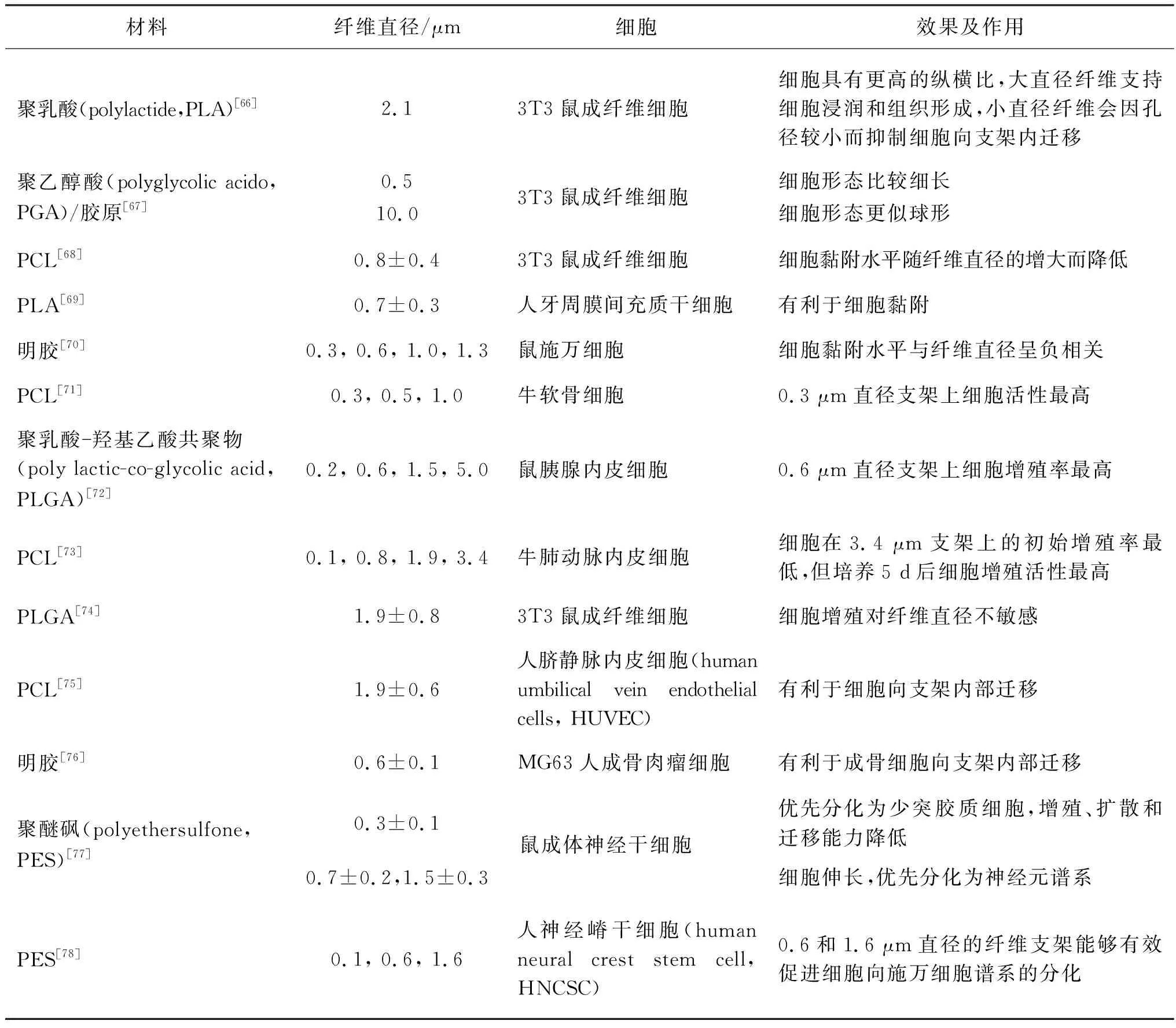
表1 不同纖維直徑的纖維集合體對不同細胞的作用
2.1.1 纖維直徑對細胞黏附和鋪展的調控
許多研究顯示直徑在亞微米尺度的纖維有利于細胞的黏附。Chen等[68]通過靜電紡絲制備了具有不同直徑的PCL纖維支架,研究發現,當直徑處于納米尺度(428~1 051 nm)時,細胞黏附速率隨纖維直徑的增大而降低,而纖維直徑處于微米尺度(1 051~1 647 nm)時,細胞黏附速率對直徑變化不敏感;Luis等[69]將間充質干細胞接種至直徑為0.704~0.880 μm的靜電紡絲支架上,發現纖維平均直徑為0.704 μm的支架最適宜細胞的黏附;Gnavi等[70]制備了直徑分別為300 nm、600 nm、1.0 μm和1.3 μm的明膠纖維支架,發現施萬細胞黏附水平與纖維直徑呈負相關,纖維直徑為300 nm的支架上的黏附最優。纖維直徑從微米尺度減小至亞微米尺度時,支架的比表面積明顯增加,并且比表面積的增加與纖維排列無關[79],而具有高比表面積的纖維更易吸附黏附蛋白,可為細胞附著提供許多黏著位點。
細胞的鋪展狀態與所黏附的纖維直徑有重要的關聯。文獻[62, 64]指出:細胞在小于或接近自身尺度的纖維上傾向于包裹纏繞纖維并沿著纖維伸長;細胞在顯著大于自身尺度的纖維上呈鵝卵形,類似于在平面基質上的形態,如圖4所示。Badami等[66]發現2.1 μm直徑的纖維支架上的成纖維細胞比光滑表面上的具有更高的縱橫比;Tian等[67]發現,成纖維細胞黏附到較小直徑(500 nm)的纖維上時更加細長,黏附到較大直徑(10 μm)的纖維上時形態更似球形。細胞包裹小直徑纖維的原因是,當細胞與纖維接觸時,細胞為保持膜表面的擴散性受體與纖維表面的配體的結合,自發產生細胞膜局部纏繞以減少相互作用的自由能。

(a) 直徑小于細胞尺度的纖維

(b) 直徑大于細胞尺度的纖維
2.1.2 纖維直徑對細胞增殖的調控
適當的纖維直徑能夠提高附著其上的細胞的增殖活性與增殖率。多數研究認為,亞微米尺度的纖維有利于細胞增殖。Ko等[72]制備了平均直徑分別為200 nm、600 nm、1.5 μm和5.0 μm的PLGA纖維支架,發現內皮細胞在纖維直徑為600 nm的支架上增殖率遠高于其他組;Noriega等[80]制備了平均直徑為300 nm、500 nm和1 μm的殼聚糖納米纖維支架,發現軟骨細胞在纖維直徑為300 nm支架上的增殖活性最高。
然而對于亞微米尺度纖維有利于細胞增殖這一觀點,有研究人員提出了不同看法。Kim等[73]發現內皮細胞在微米尺度纖維支架上的增殖活性最高;而Bashur等[74]發現,鼠成纖維細胞對PLGA纖維支架的直徑0.14~3.60 μm變化不敏感。
2.1.3 纖維直徑對細胞遷移的調控
纖維直徑能夠影響纖維對細胞遷移方向的引導能力。例如,Li等[75]指出,微米級纖維比亞微米級纖維更利于引導細胞的遷移方向,并提出較大尺度的拓撲結構可能具有更強的接觸引導效應。
不同細胞的遷移方向對纖維直徑的響應有所不同。Fioretta等[71]研究了不同纖維直徑的靜電紡PCL隨機取向支架對內皮細胞和內皮集落形成遷移方向的影響,在直徑為5~11 μm的纖維支架上培養時,內皮細胞沿纖維周向排列細胞骨架并沉積成膠原層,而內皮集落形成細胞沿著纖維軸向排列細胞骨架并沉積成膠原層。
Badami等[66]推測,大直徑纖維會使細胞浸潤并形成組織,而小直徑纖維會因孔徑較小而抑制細胞向支架內部的遷移。纖維集合體的孔徑很大程度上由纖維直徑決定[81],直徑大的纖維會產生較大的孔,纖維直徑較小則支架的孔徑往往也較小,使得細胞難以向集合體內部遷移。
2.1.4 纖維直徑對細胞分化的調控
纖維直徑對干細胞分化表型及分化水平有一定影響。Christopherson等[77]在具有不同纖維直徑的電紡PES隨機取向纖維支架上培養神經干細胞,發現細胞在纖維直徑為283 nm支架上優先分化為少突膠質細胞,在纖維直徑為749和1 452 nm支架優先分化為神經元譜系;Ren等[78]制備了直徑為160 nm、600 nm與1.6 μm的對齊取向纖維支架,發現直徑為600 nm和1.6 μm的纖維支架能夠有效促進神經嵴干細胞向施萬細胞譜系分化。分化依賴于細胞形態和細胞周期[82],細胞在纖維或支架上的形態與其分化趨勢與分化程度密切相關,推測細胞在不同直徑纖維上的分化行為很大程度上取決于細胞與纖維尺度的比例。例如,在不同直徑的隨機取向纖維基質上培養的大鼠成體神經干細胞,在直徑遠小于自身尺度的纖維基質上不受單根纖維引導,細胞的形態更圓,傾向于膠質細胞表型,而在直徑較大的纖維上沿單根纖維延伸,細胞傾向于分化為神經元譜系[77]。
2.2 纖維取向
2.2.1 纖維取向對細胞黏附和鋪展的調控
隨機取向支架比對齊取向支架更有利于細胞的黏附。Zhong等[83]分別在隨機取向與對齊取向的膠原蛋白電紡支架上培養成纖維細胞,發現對齊取向支架上的細胞黏附較差。導致該現象的原因是,對齊支架的表面與內部結構相對規整,而隨機支架的不規則表面結構增大了支架的比表面積,并且隨機支架內部孔與孔之間高度互連,細胞的絲狀偽足能夠在隨機纖維網絡內找到更多的攀附點,使得細胞對隨機支架的黏附作用顯著優于對齊支架。
細胞在對齊取向的纖維支架上往往沿著纖維的取向伸長,而在隨機取向的纖維支架上沿著周圍的纖維多極化鋪展,如圖5所示。Bashur等[74]通過靜電紡絲制備了取向度不同的PLGA纖維支架,發現成纖維細胞的長寬比和長軸長度隨纖維取向的增加而增加;Whited等[84]將PCL和I型膠原混合靜電紡絲形成支架,發現對齊取向支架上的人臍靜脈內皮細胞呈細長形,而隨機支架上的細胞呈多邊形。這是因為對齊取向纖維支架的高度有序的結構給予細胞各向異性的力學刺激,使細胞產生形態變化的響應;隨機取向的纖維支架能夠給予細胞比較均勻的物理支持,并且表面粗糙度更高,有利于細胞偽足的多向延伸攀附,因此細胞表現為多極鋪展形態。
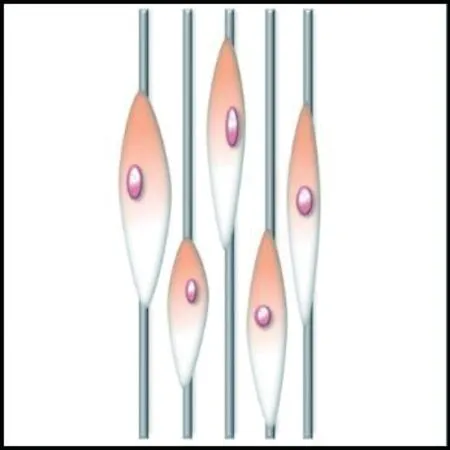
(a) 對齊取向纖維集合體

(b) 隨機取向纖維集合體
然而上述規律并非適用于所有情況,纖維取向與纖維直徑往往共同調控細胞行為,細胞對取向與直徑的響應具有更復雜的規律,此外,纖維排列的緊密程度影響細胞行為[79]。
2.2.2 纖維取向對細胞增殖的調控
目前已有許多研究指明了對齊取向或隨機取向纖維集合體對細胞增殖的作用,但不同細胞對纖維取向程度的偏好存在很大差異。Subramanian等[85]發現,相比隨機納米纖維支架,施萬細胞在對齊取向PLGA-PCL納米纖維支架上的增殖更好;Shafiee等[86]制備了對齊和隨機取向的PLLA/PCL靜電紡絲支架,接種細胞后進行培養,發現隨機支架上的人鼻中隔源干細胞增殖率較高;Mirzaei等[87]發現,在對齊的碳納米纖維支架上培養的人子宮內膜干細胞的增殖量顯著小于隨機纖維支架;也有研究人員提出,成纖維細胞的增殖對纖維取向并不敏感[74, 88]。上述各項研究表明,不同組織細胞對于纖維取向的響應并不統一。促進細胞增殖的關鍵在于纖維支架所提供的環境與組織細胞所在體內環境的相似程度,當從纖維取向上實現對天然細胞外基質的高度模擬時,可能最有利于細胞的增殖。
2.2.3 纖維取向對細胞遷移的調控
相比隨機取向纖維,對齊取向的纖維能夠引導細胞的遷移方向,提高細胞的遷移速度。Xu等[19]制備了對齊取向的電紡聚(L-丙交酯-己內酯)(poly(l-lactid-co-ε-caprolactone), P(LLA-CL))的納米纖維支架,發現平滑肌細胞沿著對齊的納米纖維附著遷移,細胞骨架蛋白的排布也與納米纖維的方向平行,證明細胞傾向于沿著纖維取向排列;Bouta等[89]將內皮細胞接種到具有對齊和隨機兩種取向的纖維支架上,發現細胞沿著對齊的纖維延伸與遷移,而隨機纖維對細胞定向遷移有明顯的抑制作用。
對于對齊取向纖維,其引導細胞定向遷移的原理與纖維表面溝槽結構對細胞遷移的引導機理類似:對齊取向的支架給予細胞各向異性力學刺激,影響了細胞肌動蛋白網絡與黏著斑的分布與接觸面積[66],細胞通過機械轉導感受力學刺激并從基因層面調整自身形態[51],沿著纖維方向伸長并遷移。此外,細胞所感知到的附著物剛度對細胞遷移的方向有重要影響[90],而對齊纖維的取向方向的有效纖維剛度比正交方向高,這將促使細胞沿纖維取向遷移。對于隨機取向纖維,接種在隨機纖維支架上的細胞:單個細胞可以在單根纖維上排列和遷移,但當細胞遇到交叉纖維時,其遷移會被阻礙;另一種情況是細胞可以附著在沿不同方向排列的多根纖維上,但不同取向的纖維給予細胞相互沖突的力學刺激可能會抑制細胞的排列和遷移[89]。
纖維取向與纖維直徑、排列緊密程度往往共同作用于細胞的遷移。例如,Liu等[91]制備了直徑為0.16~8.64 μm的電紡聚甲基丙烯酸甲酯(polymethy1 methacrylate, PMMA)纖維,發現成纖維細胞沿纖維軸取向時,具有直徑下限( 0.97 μm),在該值以下未觀察到細胞沿纖維軸向排列。Bouta等[89]認為,當纖維尺度較小且排列緊密時,由于細胞所接觸的纖維數量增多,細胞更牢固地附著于支架上,這可能使得細胞更難以遷移。
細胞向隨機取向纖維集合體內部的遷移優于對齊取向纖維集合體[92]。這可能是由于相比隨機取向支架,對齊取向支架內部的孔形狀比較規則,并且孔與孔之間相互隔離,使得細胞在支架內部不易攀附與移動。
2.2.4 纖維取向對細胞分化的調控
纖維的取向對于細胞的分化行為有著非常重要的調控作用。Lim等[93]發現,相比隨機纖維,對齊纖維上有更高比例的神經干細胞顯示出神經元分化的標志物;Kijenska-Gawronska等[94]制備了隨機和對齊取向的靜電紡絲P(LLA-CL)/膠原蛋白I /膠原蛋白III納米纖維支架,發現對齊的納米纖維支架促進神經干細胞的分化;Yin等[95]發現,肌腱干細胞在對齊取向PLA纖維支架上的肌腱特異性基因的表達明顯高于隨機取向纖維支架,并且隨機取向纖維支架能夠誘導成骨,而對齊取向纖維支架阻礙了成骨過程。
纖維取向對干細胞分化的影響源于底物選擇性[93],例如,對齊的纖維基質不利于少突膠質細胞的附著和持續存活,卻有利于神經元譜系細胞的附著和存活,因此細胞表現為向神經元譜系分化。同時,對齊取向纖維的各向異性力學刺激也對細胞的分化起到一定作用,細胞感受力學刺激并調整自身形態,而細胞形態與細胞的分化行為直接相關,故可通過對齊纖維的拓撲結構間接調控細胞的分化。
2.3 孔徑及孔隙率
孔徑與孔隙率是纖維集合體的重要特征,大量研究指出孔徑與孔隙率對細胞行為有著重要的調控作用。表2總結了多種不同孔徑與孔隙率的纖維集合體對不同細胞的作用。
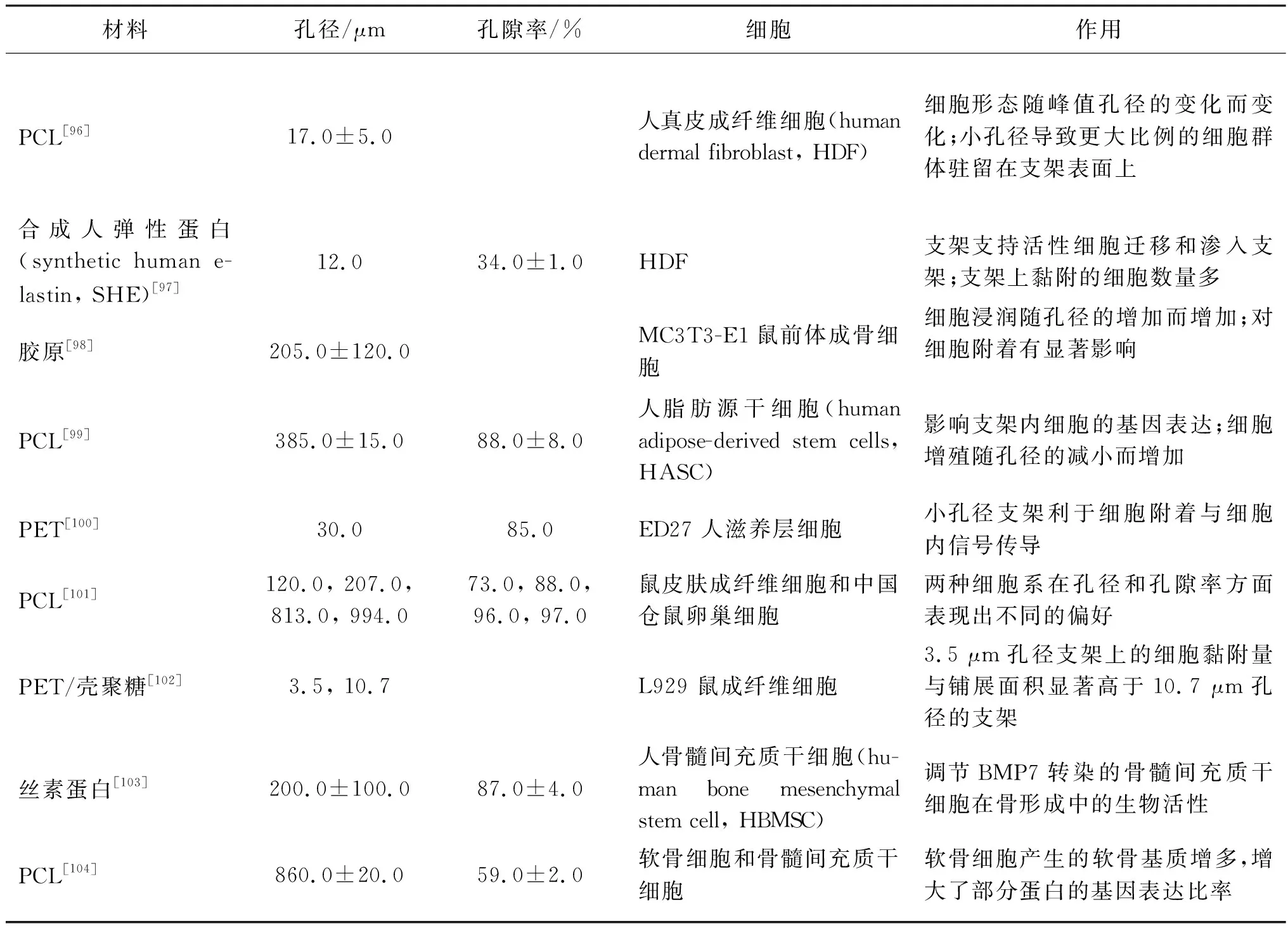
表2 不同孔徑與孔隙率的纖維集合體對不同細胞的作用
2.3.1 孔徑及孔隙率對細胞黏附和鋪展的調控
細胞在孔徑小于或接近自身尺寸的纖維集合體上往往呈多極鋪展,在孔徑顯著大于自身尺寸且孔隙率較高的纖維集合體上表現為雙極伸長形態。Lowery等[96]制備了孔徑為12~23 μm的靜電紡絲PCL支架,研究發現,較小孔徑支架上的細胞呈多極鋪展狀態,較大孔徑支架上的細胞包裹纏繞在單根纖維上。這是由于在纖維集合體中,孔徑與孔隙率的大小與纖維間距密切相關,而細胞能夠橋接的纖維間距有限,超過橋接閾值將使得細胞無法同時黏附在多根纖維上,則細胞可用的黏附位點大大減少。因此,過大的孔徑與過高的孔隙率不利于細胞的黏附。例如,Veleirinho[102]評估成纖維細胞在平均孔面積分別為9.4和89.3 μm2(孔徑分別為3.5和10.7 μm)的靜電紡絲聚對苯二甲酸乙二醇酯(polyethylene terephthalate, PET)/殼聚糖支架上的黏附情況,發現細胞在3.5 μm平均孔徑的支架上的黏附量與鋪展面積均更高。
2.3.2 孔徑及孔隙率對細胞增殖的調控
孔徑與孔隙率能夠調控細胞增殖。Rnjak-Kovacina等[97]將成纖維細胞接種至孔徑約為8.0和11.7 μm的支架上并培養8 d,發現孔徑較小的支架上的細胞增殖率高于孔徑較大的支架;Ma等[100]發現,相比大孔徑(35 μm)、高孔隙率(89.6%),小孔徑(30 μm)、低孔隙率(84.9%)的PET纖維支架中培養的ED27人滋養層細胞具有較高的初始細胞增殖率和代謝活性。這可能是由于小孔徑支架更利于細胞的附著與細胞間信號傳導。
研究發現,不同的細胞或組織對孔徑的偏好不同。Tang等[101]在研究纖維基質結構與鼠皮膚成纖維細胞和中國倉鼠卵巢細胞增殖關系的過程中發現,雖然兩種細胞系在基質中都能正常生長,但它們在孔徑和孔隙率方面表現出不同的偏好。因此,在設計組織工程支架時應當考慮種子細胞對孔徑及孔隙率的偏好,從而最大程度地誘導組織再生。
2.3.3 孔徑及孔隙率對細胞遷移的調控
細胞在小孔徑的支架上通常會橋接多根纖維而均勻擴散,而在大孔徑的支架上大多沿著單根纖維遷移。Lowery等[96]證實,較大的孔徑促使細胞沿著單根纖維排列。Ma等[100]發現,孔徑和孔隙率較低的支架上培養的細胞能夠更容易地在相鄰纖維上擴散。Kennedy等[42]指出,細胞可以跨越較小的孔橋接纖維,而在大于自身尺寸的孔內其會黏附在單根纖維上并沿著單根纖維生長。
細胞向大孔徑、高孔隙率纖維集合體內部的遷移程度更高,而小孔徑、低孔隙率集合體上的細胞往往駐留在表面。Rnjak-Kovacina等[97]發現,高孔隙率支架有利于細胞向支架內部遷移。Murphy等[98]發現,孔徑越大細胞向支架內部遷移程度越高。較大的孔徑使細胞向集合體內部遷移的阻礙減少,同時能更高效地實現氧氣、營養物質的輸送與代謝廢物的清除(如圖6所示),使得細胞能夠快速向內遷移;而小孔徑會將細胞屏蔽在支架表面,并且物質交換效率更低,使得細胞難以滲透。因此,Lowery等[96]提出,在組織工程用電紡支架的設計開發過程中,孔隙必須足夠大,以促進細胞快速滲透入支架內部,但不能大到阻止細胞快速構建細胞外基質時對纖維的橋接。
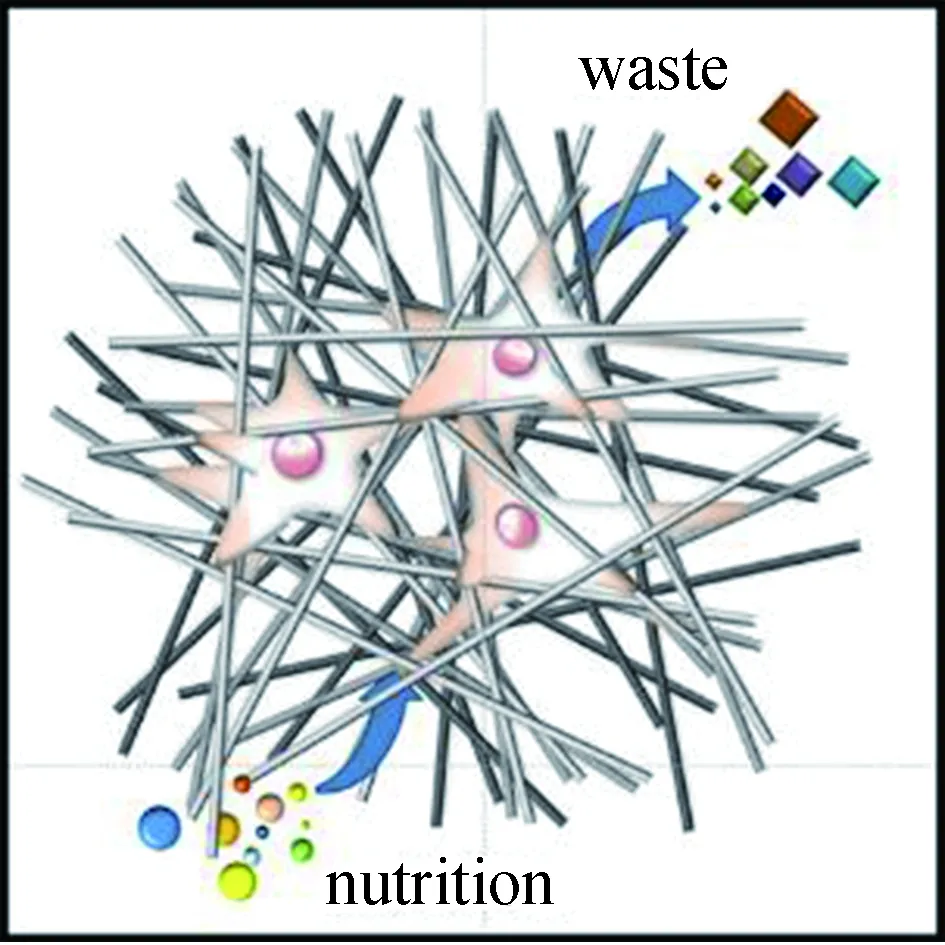
圖6 大孔徑、高孔隙率的纖維集合體有利于細胞滲透和物質交換Fig.6 Fiber aggregate with large pore size and high porosityfacilitates cell infiltration and material exchange
從另一個角度來看,小孔徑材料難以被組織細胞滲透的特點也可加以利用。例如,Sill等[105]提出,具有小孔徑的靜電紡納米纖維網的高比表面積能夠支持內皮細胞的良好黏附,而其納米尺度的孔徑能夠阻止微米尺度的平滑肌細胞向血管腔內的遷移,因此非常適合應用于血管組織工程,如圖7所示。
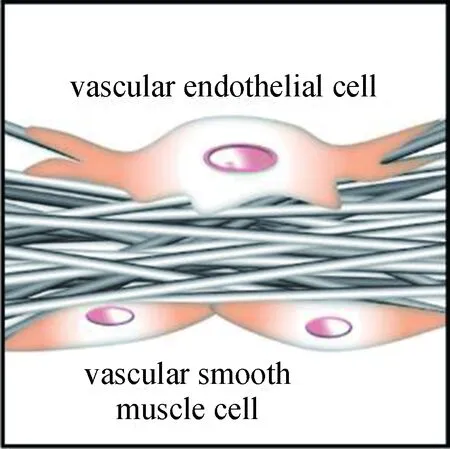
圖7 靜電紡絲網狀納米纖維集合體用于血管組織工程Fig.7 Reticular electrospun nanofiber aggregate usedfor vascular tissue engineering
2.3.4 孔徑及孔隙率對細胞分化的調控
纖維集合體的孔徑及孔隙率能夠調控細胞的分化方向與分化活力。Kennedy等[42]提出,孔徑能夠改變細胞的鋪展面積,從而影響細胞分化;Kemppainen等[104]發現,通過改變支架孔徑與孔隙率而改變支架通透性,能夠影響軟骨細胞的再分化進程;Zhang等[103]通過冷凍干燥技術制備了孔徑為50~300 μm的4種絲素蛋白纖維支架,研究發現,轉染了骨形態發生蛋白BMP7的骨髓間充質干細胞在100~300 μm孔徑的支架上的成骨分化標志物表達良好,分化活力最高;Oh等[99]在孔徑和孔隙率梯度分布(90~400 μm,80%~97%)的PCL纖維支架上接種脂肪干細胞,發現孔徑為380~405 μm的支架上細胞的軟骨分化標志物表達最高。
2.4 孔形
2.4.1 孔形對細胞黏附和鋪展的調控
目前已有研究表明,纖維集合體孔形能夠調控細胞黏附鋪展的形態。Di Luca等[106]將間充質干細胞接種在孔隙率相同而孔形不同的PCL纖維支架內研究細胞情況,結果顯示,不同孔形支架上的細胞黏附形態不同,在孔形較規則的支架上的細胞具有更均勻的形態。在纖維集合體中,孔形與纖維間距密切相關。規則的孔形意味著纖維間距具有更高的各向同性,因此細胞在支架上向四周鋪展更加均勻;而不規則的孔形反映纖維間距具有各向異性,細胞能在某一方向上向周圍的纖維上鋪展,而在另一方向上無法橋接多根纖維,只能在單根纖維上包裹纏繞,且形態不規則。
2.4.2 孔形對細胞增殖的調控
細胞增殖總量對孔形的變化并不敏感。文獻[106]指出,支架內的孔形對細胞增殖總數量基本無影響;Rumpler等[107]研究了幾何形狀(三角形、正方形、六邊形和圓形)對三維組織生長的影響,結果發現,MC3T3-E1鼠前體成骨細胞在人造三維基板中形成的新組織的總量與孔形無關,而是取決于孔周長。對于該研究使用的棱柱形孔,其孔周長與孔表面積成正比,由此推測,細胞增殖總量的決定性因素可能是材料所能夠提供的表面積。該研究同時發現,細胞在圓形孔道內表面的增殖速率處處相同;在其他孔形中,細胞首先在高曲率的角落區域快速增殖,直至相鄰角落的細胞集群相接觸而形成統一的界面,再以處處相同的速度繼續增殖,如圖8所示。這一現象產生的主要原因,可能是孔道內的曲率對細胞骨架產生了復雜的機械作用,進而影響細胞行為。Bidan等[108]提出,細胞在孔道中增殖的曲率驅動行為是為了使新生組織處于更加穩定的狀態,最終細胞會趨向于形成一個均勻圓形界面。雖然上述研究并非都基于高分子纖維及其集合體,但通過類比可知,細胞在纖維集合體內的局部增殖速率會受到不同孔形產生的復雜機械力的影響。

(a) 三角形孔

(b) 方形孔

(c) 圓形孔
2.4.3 孔形對細胞分化的調控
目前已有研究證實孔形對細胞分化存在一定的調控作用。Di Luca等[106]分析了間充質干細胞在孔形梯度分布的支架上的分化情況,發現細胞在菱形孔和方形孔區域內的分化趨勢存在明顯差異。然而,目前纖維集合體孔形對細胞分化的具體影響機理尚不明確,原因可能是纖維集合體的不同孔形給予細胞不同的力學刺激,而細胞通過力學傳導通路感受刺激并調節基因表達和干細胞分化[109-110]。
3 結論與展望
本文從單纖維形貌與纖維集合體結構2個層次上闡述了高分子纖維材料拓撲結構對細胞行為的調控作用。基于單纖維的溝槽結構、多孔結構與串晶結構能夠顯著增大纖維及其集合體的比表面積與表面粗糙度,有利于細胞的黏附與增殖;單纖維溝槽結構與纖維集合體的取向通過給予細胞各向異性力學刺激而改變細胞的鋪展形態,可調節細胞分化并引導細胞遷移方向;孔徑、孔隙率是細胞向纖維集合體內部遷移的決定性因素,同時也對集合體的物質交換能力有著重要的調控作用;而孔形能夠通過局部曲率的變化來調控細胞局部增殖速率。
不同組織細胞對于支架有著不同的結構偏好,當支架各項結構參數與天然細胞外基質相類似時,最適于細胞的生長繁殖。這將給予研究者們一定的啟示,即通過支架拓撲結構調控細胞行為的關鍵在于從孔徑、孔隙率、纖維形貌、纖維直徑與取向多個角度對細胞外基質進行高度模擬,給予細胞與天然組織類似的微觀環境,可促進細胞生長繁殖與組織迅速再生。
在開發用于誘導組織再生的新型高分子纖維基材料時,應當從所要調控的細胞行為出發,并從纖維與集合體兩個層次綜合設計材料拓撲結構。例如,為促進細胞黏附,選擇串晶纖維與較小的孔徑;為加強對細胞遷移方向的引導,選擇溝槽纖維與對齊的取向。未來應致力于,在不同細胞種類、細胞行為與多種材料及其拓撲結構之間建立一套完整細致的關系系統,這對于組織誘導性新型高分子纖維及其集合體材料的精細化設計與研究有著重要的指導意義。

