基于高通量測序分析四川辣椒醬自然發酵過程中細菌群落結構演替規律
劉 洋,丁 悅,孫勁松,潘 攀,劉力嘉,張雅琳,王新惠
(成都大學藥學與生物工程學院,四川成都 610106)
辣椒醬作為一種深受人們喜愛的調味品,在我國具有廣泛的市場,我國辣椒醬的年產量和年消費量均達500萬噸以上,且每年市場的規模仍穩定增長[1]。傳統辣椒醬的制作一般采用自然發酵,自然發酵指將新鮮辣椒去梗破碎后加入蒜、姜等配料,利用高鹽腌制或高油腌制罐裝發酵而成[2]。自然發酵辣椒醬由自然環境中的多菌種長時間發酵,形成特有的風味物質,但與此同時辣椒本身和加工處理過程都會帶來許多雜菌,導致其品質穩定性不佳,食用安全性得不到保障[3]。因此,研究辣椒醬自然發酵過程中細菌群落演替規律,有利于提高自然發酵辣椒醬的經濟效益和提升辣椒醬的食用安全性。
利用高通量測序技術分析環境樣品中細菌群體基因組,彌補了傳統微生物研究方法不能分離出環境中所有微生物的缺陷[4-5]。近年來,高通量測序技術在發酵食品行業中的運用越來越多。Hao等[6]通過對中國東北農家大豆醬發酵過程中細菌多樣性的探究,確定大豆醬在發酵過程中存在有害菌為四聯球菌(Tetragenococcus)和葡萄球菌(Staphylococcus),并確定乳桿菌為主要的菌群。利用高通量測序技術能夠探究細菌的多樣性,趙玲艷[7]通過對辣椒醬中細菌16S rRNA基因測序,發現線椒和米椒所制的辣椒醬在發酵過程中的細菌多樣性差別不大,且細菌多樣最大值均出現在發酵的中間時期。武亞婷等[8]采用高通量測序技術篩選出新疆不同地區的自然發酵辣椒醬的主要優勢菌,篩選出鏈形植物屬(Streptophytaspp.)和乳桿菌屬(Lactobacillusspp.)等新疆地區自然發酵辣椒醬的優勢菌屬。大量的研究表明,高通量測序技術檢測發酵食品中的微生物的技術已經比較成熟,通過此技術研究辣椒醬中的微生物具有一定的合理性。
川渝地區人們酷愛辣味,辣椒醬需求量巨大,研究該地區自然發酵辣椒醬中細菌群落結構的演替對于辣椒醬產業的發展具有重大意義。本研究以四川地區辣椒醬為材料,通過高通量測序技術,探究其在自然發酵過程中的細菌群落多樣性以及菌落結構變化規律,以期錨定發酵過程中的功能菌和有害菌,為提高自然發酵辣椒醬的安全性,優化辣椒醬的發酵工藝提供理論依據。
1 材料與方法
1.1 材料與儀器
新鮮二荊條紅辣椒、鹽、味精等 購自十陵友誼綜合市場;M2327-01Mag-Bind Plant DNA Kit(50)試劑盒 美國Omega Biotek Inc公司;無水乙醇 98%,成都科隆化學品有限公司。
Miseq測序儀 Illumina公司;5810R型高速冷凍離心機 德國Eppendorf公司;My Cycler型聚合酶鏈式反應儀(polymerase chain reaction,PCR)、瓊脂糖凝膠電泳儀 美國Bio-Rad公司;GR-500 型姜蒜切粒機 山東高然食品機械廠。
1.2 實驗方法
1.2.1 辣椒醬的工藝 新鮮二荊條辣椒→洗凈去梗→搗碎→添加輔料、調料→拌勻→裝壇發酵。
1.2.1.1 操作要點 辣椒選用辣度適中、辣椒紅色素豐富的雙流二荊條辣椒。
感官指標:呈鮮紅色、質地硬朗,個頭均勻、辣味強;椒把保留長度不得超過5 mm,不能脫帽。利用姜蒜切粒機對姜、蒜等進行切粒,粒徑均控制在2~3 mm左右。
1.2.1.2 取樣 利用無菌袋,分別對發酵期間第0、5、10、15、20、25、30、35、40 d的樣品進行取樣,每次在發酵缸內不同的位置取3個樣品作為重復,一個樣品10 g,共9次,取樣的樣品分別命名為CPS-1、CPS-2、CPS-3、CPS-4、CPS-5、CPS-6、CPS-7、CPS-8、CPS-9。
1.2.2 DNA提取 稱取適量辣椒醬樣品,嚴格按照M2327-01Mag-Bind Plant DNA Kit(50)試劑盒要求提取DNA。DNA濃度測定采用0.8%瓊脂糖凝膠電泳,檢測合格后進行進一步實驗。
1.2.3 PCR擴增以及測序 采用細菌16S rDNA V3~V4擴增通用引物:341F(5′-CCTACGGGRSGC AGCAG-3′)和806R(5′-GGACTACVVGGGTATC TAATC-3′)。
PCR反應體系為:10×KAPA Library Amplification ReadyMix 15 μL,引物(10 μmol/L)F和R各為1 μL和100 ng NDA模板,最后加ddH2O補足至40 μL。
細菌PCR反應條件:94 ℃預變性4 min;94 ℃變性1 min,50 ℃退火30 s,72 ℃延伸30 s,反應重復 30個循環;72 ℃最終延伸 5 min,-20 ℃保存[9]。對得到的PCR產物用2%瓊脂糖凝膠電泳檢驗,對符合要求的產物進行后續實驗。
1.3 數據處理
利用UPARSE軟件對所有樣本的全部Effective Tags進行聚類,默認以97%的一致性將序列聚類成為OTUs(Operational Taxonomic Units),篩選出現頻率最高的OTUs序列作為代表序列[10]。使用UCLUST分類法與SILVA數據庫進行注釋分析;使用Mothur軟件計算Alpha指數、稀釋曲線,使用Vegan package計算Beta多樣性距離矩陣,并對樣品進行PCA 3D主成分分析[11]使用R軟件(Version 2.15.3)和OriginPro 2018作圖。
2 結果與分析
2.1 Shannon稀釋曲線
用Shannon稀釋性曲線來表征測序方法的可行性,該曲線采用隨機抽樣的方法,以抽到的序列數和它們所能代表的OTU的數目構建稀釋性曲線。如圖1所示,曲線變得平坦,說明隨著序列數的增加,不會出現更多的OTU,表明測序量足夠[12]。

圖1 自然發酵辣椒醬9個樣本的Shannon稀釋曲線

表1 辣椒醬自然發酵過程中細菌多樣性指數
2.2 主成分分析
主成分分析(Principal component analysis,PCA)是對樣本中微生物多樣性相似性和差異性可視化的方法。樣本的PCA 3D如圖2所示,百分比表示該成分對樣品差異的貢獻值,樣本間的距離越近說明樣本之間越相似。樣品CPS-1、CPS-2和CPS-3在圖中較聚集,說明這三個樣品的相似度較高。同理,樣本CPS-4、CPS-5和CPS-6相似度較高,CPS-7、CPS-8和CPS-9相似度較高。根據發酵期間樣本的相似度的特點,將樣品CPS-1、CPS-2和CPS-3對應的發酵第0~10 d作為發酵前期,將CPS-4、CPS-5和CPS-6對應的發酵第10~25 d作為發酵中期,將CPS-7、CPS-8和CPS-9對應的發酵第25~40 d作為發酵后期。

圖2 9個自然發酵辣椒醬樣本的PCA 3D圖
2.3 Alpha多樣性分析
Alpha多樣性反應了樣品中微生物的豐富度和多樣性,在表1中,Chao1指數和ACE指數用于表示微生物的豐富度,其值隨著微生物豐富度的升高而增大;Shannon指數和Simpson指數用于表示微生物群落的多樣性,Shannon指數隨著群落多樣性的升高而增大,Simpson指數則隨著群落多樣性的升高而減小。Coverage值代表各樣品文庫的覆蓋率,測出的值越接近1,說明各樣品的覆蓋率也高,測序的結果越能代表真實的情況[13]。
如表1所示,所有樣本的Coverage指數都大于或等于0.99,說明測序的結果能夠真實反映樣本細菌豐度及細菌群落多樣性;通過OTU、Chao1指數、ACE指數、Shannon指數和Simpson指數的變化情況可以發現:在發酵過程中,細菌的豐富度和多樣性呈現先增大再減小的趨勢,細菌的豐度在15 d達到最大值,多樣性在20 d達到最大值。說明辣椒醬制作完成后存在多種細菌,由于辣椒醬中營養物質豐富,各種微生物在發酵的初期大量繁殖,產生大量的酸性物質并消耗發酵體系中的氧氣,這使不適應環境的微生物逐漸消減,適應環境的厭氧和耐酸能力好的細菌得到很好的生長,最后又由于細菌之間的競爭關系造成發酵后期細菌群落多樣性和豐富度減小。除此之外,溫度的變化、氧氣含量變化和取樣時帶入的外來細菌的影響等,對多樣性也存在一定的影響[14]。
2.4 自然發酵的細菌OTU花瓣圖
根據獲得的OTU豐度矩陣,使用R軟件計算樣品中共有的OTU的數量,并通過OTU花瓣圖直觀的展示出樣品的OTU數目組成相似性和重疊情況。如圖3所示,9個樣本中共有OTU數目僅為10,從樣本CPS-1~CPS-9中特有的OTU數分別為19、26、22、31、30、26、33、24、27,說明辣椒醬在發酵的整個過程中細菌群落變化較大。

圖3 辣椒醬自然發酵過程中的細菌OTU花瓣圖
2.5 細菌群落結構分析
2.5.1 門水平上的細菌群落結構分析 由圖4可知,發酵過程中的9個樣本中,門水平上相對豐度大于0.01%的菌門類有厚壁菌門(Firmicutes)、變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、放線菌門(Actinobacteria)、酸桿菌門(Acidobacteria)5種。其中變形菌門是發酵前期的優勢菌門,厚壁菌門是辣椒醬發酵中、后期的優勢菌門。厚壁菌門在發酵1~10 d其含量有小幅度增加的趨勢,但總量依然較小,相對豐度浮動范圍為0.52%~2.59%,發酵中期相對豐度的波動范圍為18.71%~28.56%,發酵后期相對豐度維持在75.30%~82.99%之間,對辣椒醬的發酵處于主導作用。變形菌門是前期的主要菌門,其在發酵前期的含量浮動在15.36%~18.04%之間,遠遠高于其他菌門,而發酵中期其生長受到抑制,相對豐度波動范圍為8.56%~12.02%,后期相對豐度波動范圍為2.57%~3.24%。相比之下擬桿菌門和放線菌門等含量較低,在整個發酵過程中相對豐度小于0.4%,且隨著發酵的進行,其生長更加受到抑制。除此之外在發酵前期還有少量醋桿菌門,平均相對豐度為0.09%,在發酵的中、后期樣本中均未檢測出。
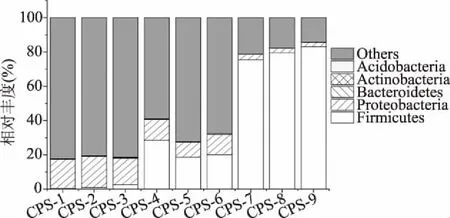
圖4 門水平下自然發酵辣椒醬的細菌群落結構分布圖
2.5.2 屬水平上的細菌群落結構分析 在屬水平上辣椒醬發酵過程中細菌群落結構如圖5所示,發酵過程中相對豐度大于0.01%的分別為:乳桿菌屬(Lactobacillusspp.)、片球菌屬(Pediococcusspp.)、魏斯氏菌屬(Weissellaspp.)、腸桿菌屬(Enterobacterspp.)、葡萄球菌屬(Staphyloccoccusspp.)、泛桿菌屬(Pantoeaspp.)、朗斯代拉菌屬(Lonsdaleaspp.)、假單胞菌屬(Pseudomonasspp.)、新根瘤菌屬(Neorhizobiumspp.)9種。其中腸桿菌屬、魏斯氏菌屬和乳桿菌屬分別為發酵前期、中期、后期三個階段的優勢菌。腸桿菌屬在發酵前、中、后期平均相對豐度分別為7.95%、4.24%、1.37%,一般腸桿菌屬在發酵食品中屬于條件致病菌,其致病性不可忽略[15]。魏斯氏菌屬在樣本中的豐度呈現先增加后減少的波動,在發酵前、中、后期平均相對豐度分別為0.73%、21.86%和3.66%。魏斯氏菌屬可以發酵蔗糖、葡萄糖、麥芽糖等產酸,是形成風味的重要菌屬。乳桿菌屬在發酵前期含量較少,在第30 d時相對豐度達到68.24%。這可能是因為隨著發酵的進行,發酵體系中理化性質如氧含量、酸含量等,達到乳桿菌屬生長的最佳值,因此其在短時間內快速增長,并在發酵后期占主導地位。乳桿菌屬在辣椒醬的風味物質形成方面起到主要的作用,此外乳桿菌屬還能減少真菌毒素的積累、降解農藥、阻止生物胺的積累、降低蛋白質過敏風險[16-18],還可以通過降解肌醇六磷酸來增加礦物質的利用率[19-20],是辣椒醬發酵的主要功能菌。除此之外,在發酵的后期出現少量的片球菌屬(平均相對豐度0.79%),它能有效的抑制食源性致病菌[21]、加快產酸和風味物質形成的速度等[22-23],對提高發酵速率、提升風味和提高安全性具有重要意義;泛桿菌屬、朗斯代拉菌屬、假單胞菌屬等都是可能引起疾病和食物腐敗的細菌[24],在發酵的初期和中期均存在于樣本中,但這幾種致病菌和致腐菌隨著發酵的進行,其生長受到環境因素和其他微生物的抑制,在發酵后期的樣本中基本未檢測出。

圖5 屬水平下自然發酵辣椒醬的細菌群落結構分布圖
對于整個發酵過程,發酵的前、中期細菌種類較多的同時雜菌也較多,隨著發酵的進行,發酵體系中理化性質的發生改變,對發酵罐中環境耐受能力差的細菌生長受到抑制,最后演替為乳桿菌屬為主導,少量的魏斯氏菌屬和片球菌屬共同發酵的形式。此外,各種致腐致病菌隨著發酵的進行,其生長受到抑制,最后僅剩小部分腸桿菌屬存在。但即使存在少量腸桿菌屬,說明自然發酵辣椒醬在整個發酵過程中均存在著安全隱患。
2.6 功能豐度熱圖分析
KEGG(Kyoto Encyclopedia of Genes and Genomes)是一個對基因組、化學以及系統功能信息加以整理合并的數據庫。對樣品進行KEGG分析,利用R語言繪制熱圖。由圖6可知,在發酵整個過程中細菌較為活躍的功能基因有復制與修復(Replication and Repair)、翻譯(Translation)、膜轉運(Membrane Transport)、能量代謝(Energy Metabolism)、碳水化合物代謝(Carbohydrate 0Metabolism)、氨基酸代謝(Amino Acid Metabolism)、脂肪代謝(Lipid Metabolism)和轉錄(Transcription)等。發酵前期和中期,轉錄、脂肪代謝、氨基酸代謝、能量代謝、DNA復制、修復和翻譯等細菌的生命活動相關功能較為活躍,到發酵的后期則變得較弱。說明發酵前、中期,樣本中細菌的生長狀況較好,代謝活動較旺盛,后期無論是細菌的豐度還是物種多樣性都明顯減小,細菌的一系列生命活動變弱。發酵后期厚壁菌門占據主導地位,且厚壁菌門細菌的糖酵解的能力很強,這可能是發酵后期碳水化合物的代謝依然維持在很高水平造成的,同時碳水化合物代謝過程中需要膜轉運的參與,所以后期細菌膜轉運的豐度仍然很高[25]。發酵后期細菌能量代謝豐度較低,由此推測此階段細菌主要的膜轉運方式為易化擴散,此膜轉運方式為一種不需要消耗能量被動運輸方式[26]。

圖6 自然發酵辣椒醬中細菌功能豐度熱圖
3 結論
通過對自然發酵辣椒醬進行高通量測序,研究辣椒醬在發酵過程中的細菌群落結構演替規律。發現整個發酵過程中辣椒醬的細菌群落多樣性和豐度呈先增加后減少的趨勢,并且最終低于初始值。由細菌群落的演替變化表明,自然發酵辣椒醬在發酵30 d左右成熟。整個發酵過程中,辣椒醬中的細菌群落變化較大。在門水平上,變形菌門(Proteobacteria)、厚壁菌門(Firmicutes)分別為發酵前期和中后期的優勢菌;屬水平上腸桿菌屬(Enterobacterspp.)、魏斯氏菌屬(Weissellaspp.)和乳桿菌屬(Lactobacillusspp.)分別為發酵前、中、后期的優勢菌,其中乳桿菌屬為主要功能菌屬,腸桿菌屬為主要致病菌屬。通過KEGG功能分布熱圖,表明在發酵過程中細菌的生命活動逐漸減弱,但碳水化合物代謝和膜轉運強度變化較小且豐度較高。
在辣椒醬的自然發酵的過程中,細菌群落多樣性的變化較大,隨著發酵的進行,其中主要功能菌在發酵過程的豐度增加非常明顯,主要致病菌生長受到抑制,但還有少量致病菌的存在,其隱藏的風險仍然不可忽視。如何做到既不影響辣椒醬風味,又能優化發酵工藝和提高食用安全性,是未來辣椒醬行業研究的重點方向。

