下調miRNA-221對肝癌生物學行為的影響*
韓雙喜 王 麗 王介營 王玉虎 王海南 李傳光 徐 萌 成良棟
山東省濱州市中心醫院肝膽外科,山東省惠民縣 251700
miRNA是一類短序列、非編碼、具有調控功能的單鏈RNA,長度20~23個核苷酸[1]。與正常組織來源細胞中的miRNA相比,大多數腫瘤組織中miRNA存在明顯的表達差異,包括表達的上調和下調,因此,miRNA在腫瘤發生發展過程中起重要的調節作用[2]。有研究發現, miRNA-221在原發性肝癌中呈高表達[3],但其對肝癌調控作用尚不明確。本研究通過下調miRNA-221的表達,研究其對肝癌HepG2細胞增殖、凋亡、侵襲的影響。
1 材料與方法
1.1 材料 肝癌細胞株HepG2受贈于濱州醫學院;干擾序列、pHelper 1.0、pHelper2.0、引物和pGCSIL-GFP等由上海吉凱基因化學技術公司合成;限制性內切酶(NEB公司);Lipofectamine 2000(Invitrogen公司)。
1.2 方法
1.2.1 構建慢病毒載體:首先依據能有效干擾人miRNA-221基因表達的靶序列制成雙鏈DNA。然后其與pGCsil-GFP載體連接并轉化。再通過PCR法篩選出陽性克隆,提取出質粒,然后再進行酶切并測序。再將pHelper1.0、pHelper2.0和重組慢病毒質粒共轉染293T細胞,獲得僅攜帶綠色熒光蛋白基因的重組慢病毒NC-GFP-LV,以及攜帶下調miRNA-221基因表達的重組慢病毒miRNA-221-RNAi-LV。采用逐孔稀釋法測定病毒的滴度。
1.2.2 測定病毒感染效率及HepG2細胞分組、轉染:采用0~20不同感染梯度的病毒感染HepG2細胞,病毒在無血清培養基中感染HepG2細胞2h后,加入10%牛血清的培養基,培養3d后,流式細胞儀檢測GFP的陽性表達率,確定感染效率。將HepG2細胞分為3組:(1)實驗組(miRNA-221-siRNA,SI組),即轉染攜帶下調miRNA-221基因表達的重組慢病毒。(2)陰性對照組(negative control,NC組),即進行轉染但未攜帶慢病毒。(3)正常組(normal,N組)。
1.2.3 RT-PCR檢測:轉染72h后開始收集HepG2細胞, miRNA-221的目的基因PTEN的表達情況通過RT-PCR檢測,通過PTEN的表達情況來判斷干擾效果;同時檢測促凋亡基因Caspase 3的表達情況。β-actin上游引物:5-CCCAGCACAATGAAGATCAAGATCAT-3,下游引物5-ATCTGCTGGAAGGTGGACAGCGA-3,擴增條帶為101bp;PTEN的上游引物為:5-CGGCAGCATCAAATGTTTCAG-3,PTEN的下游引物為:5-AACTGGCAG GTAGAAGGCAACTC-3,擴增條帶為235bp;Caspase 3的上游引物:5-GTGGTACAGAACTGGACTGTGGC-3,下游引物:5-GTTGCCACCTTTCGGTTAACCCG-3,擴增條帶為244bp。PTEN/β-actin和Caspase 3/β-actin吸光度比值分別表示PTEN mRNA和Caspase 3 mRNA的相對表達水平。
1.2.4 MTT比色法測定吸光度:將細胞每孔3×103個接種于96孔板中,每組接種10孔,置于37℃、5%CO2培養箱中進行細胞培養,細胞貼壁后進行慢病毒的轉染,分別于24h、48h、72h、96h向每孔加入MTT 20μl(0.5mg/ml),37℃孵育4h,然后丟棄MTT液,再加入150μl的DMSO,然后混合均勻,應用酶聯免疫檢測儀測定各孔490nm光吸收值,重復檢測3次。比較各組HepG2細胞的生長情況。
1.2.5 transwell體外遷移實驗:選用孔徑為8μm的24孔Borden小室,上室加入1×105個細胞,總體積200μl,下室加入300μl含血清培養基,每組各設3個復孔。48h后取出小室,甲醇固定并Giemsa染色10min,去除上層小室側的未遷移細胞,觀察到達遷移杯底下面的細胞。顯微鏡下隨機選取5個視野進行拍攝(×100倍),計算每個視野的平均細胞數量。
1.2.6 Hochest33258熒光染色法檢測細胞凋亡:首先將培養的細胞制成單細胞片, 然后應用4%多聚甲醛在室溫下固定10min,再用PBS液洗滌2次,加入Hoechst33258均勻覆蓋單細胞片,染色15min,再用PBS液清洗單細胞片3次,封片后在熒光顯微鏡下觀察。正常細胞核呈彌散均勻熒光,凋亡細胞的細胞核則表現為濃染致密或斷裂的顆粒塊狀熒光。隨機于100倍熒光顯微鏡下照相。
1.2.7 荷瘤裸鼠動物模型的建立:將裸鼠隨機分為實驗組(SI組)、陰性對照組(NC組),每組5只,HepG2細胞懸液200μl于每只裸鼠背部皮下注射。采用瘤體內多點注射的方法,定時分組分別注射miRNA-221-RNAi-LV和空病毒NC-GFP-LV。每隔3d注射1次,每次病毒量為2×107個/只,共注射6次。之后每天觀察腫瘤生長情況,每隔3d測量腫瘤的長、短徑,計算腫瘤的體積。腫瘤體積=1/2×長徑×短徑2。繪制移植瘤生長曲線。于最后1次注射藥物后3d頸椎脫臼法處死裸鼠,切取腫瘤組織標本。

2 結果
2.1 miRNA-221-RNAi-LV的構建及病毒滴度測定 miRNA-221基因干擾的重組細菌PCR擴增產物為270bp,鑒定結果與預期一致,測序結果表明,合成的miRNA-221的siRNA核苷酸序列插入正確,沒有堿基缺失或替換。病毒滴度:miRNA-221-siRNA-LV和NC-GFP-LV均為2×109TU/ml。
2.2 病毒感染效率及干擾情況 采用(MOI=0~20)不同梯度的病毒感染HepG2細胞,并進行流式細胞儀分析。結果顯示,MOI=0~20的不同感染梯度對HepG2細胞感染效率分別為0.38%(MOI=0)、22.37%(MOI=5)、73.06%(MOI=15)及95.10% (MOI=20),MOI=20的感染滴度對HepG2細胞感染效率較高(95.10%),見圖1。轉染72h后,PTEN的mRNA表達水平N組(0.034±0.001)、NC組(0.037±0.003)與SI組(0.123±0.005)相比較,SI組miRNA-221的靶基因PTEN表達增強,差異具有統計學意義(P<0.05),見圖2。

圖1 流式細胞檢測GFP的表達率
2.3 MTT比色法測定miRNA-221-RNAi-LV對HepG2細胞增殖的影響 轉染后24h,檢測SI組的吸光度值開始下降,表明SI組的HepG2細胞增殖減弱,在之后的各個時間點,均表現為吸光度值降低。

圖2 PTEN mRNA表達的灰度值
在96h NC組(1.070±0.020)和N組細胞(1.070±0.015)與SI組(1.030±0.023)相比,差異具有統計學意義(P<0.05)。這個結果表明下調miRNA-221的表達可以抑制HepG2細胞的增殖能力。
2.4 transwell體外遷移實驗 經transwell小室培養模型培養后,對三組的穿膜細胞分別進行計數,NC組的遷移細胞數(43±4)、N組的遷移細胞數(45±4.1)和SI組的遷移細胞數(31±5.5)比較,差異有統計學意義(P<0.05),而NC和N組比較,差異無統計學意義(P>0.05),見表1。
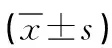
表1 miRNA-221-RNAi-LV對HepG2細胞增殖的影響
2.5 下調miRNA-221的表達對HepG2細胞凋亡的影響 熒光染色后,于熒光顯微鏡下觀察細胞形態變化,凋亡的HepG2細胞發生核固縮,表現為濃染致密的顆粒塊狀熒光。SI組HepG2細胞增殖減弱,凋亡增加,熒光顯微鏡下觀察可見較多的顆粒狀熒光,這表明下調miRNA-221可以促進HepG2細胞的凋亡。
2.6 RT-PCR檢測促凋亡基因Caspase 3變化 實驗結果顯示促凋亡基因Caspase 3的mRNA表達水平分別為N組(0.027±0.004)、NC組(0.029±0.003)和SI組(0.072±0.001),三組相比較,SI組的Caspase 3表達增強,差異具有統計學意義(P<0.05),見圖3。
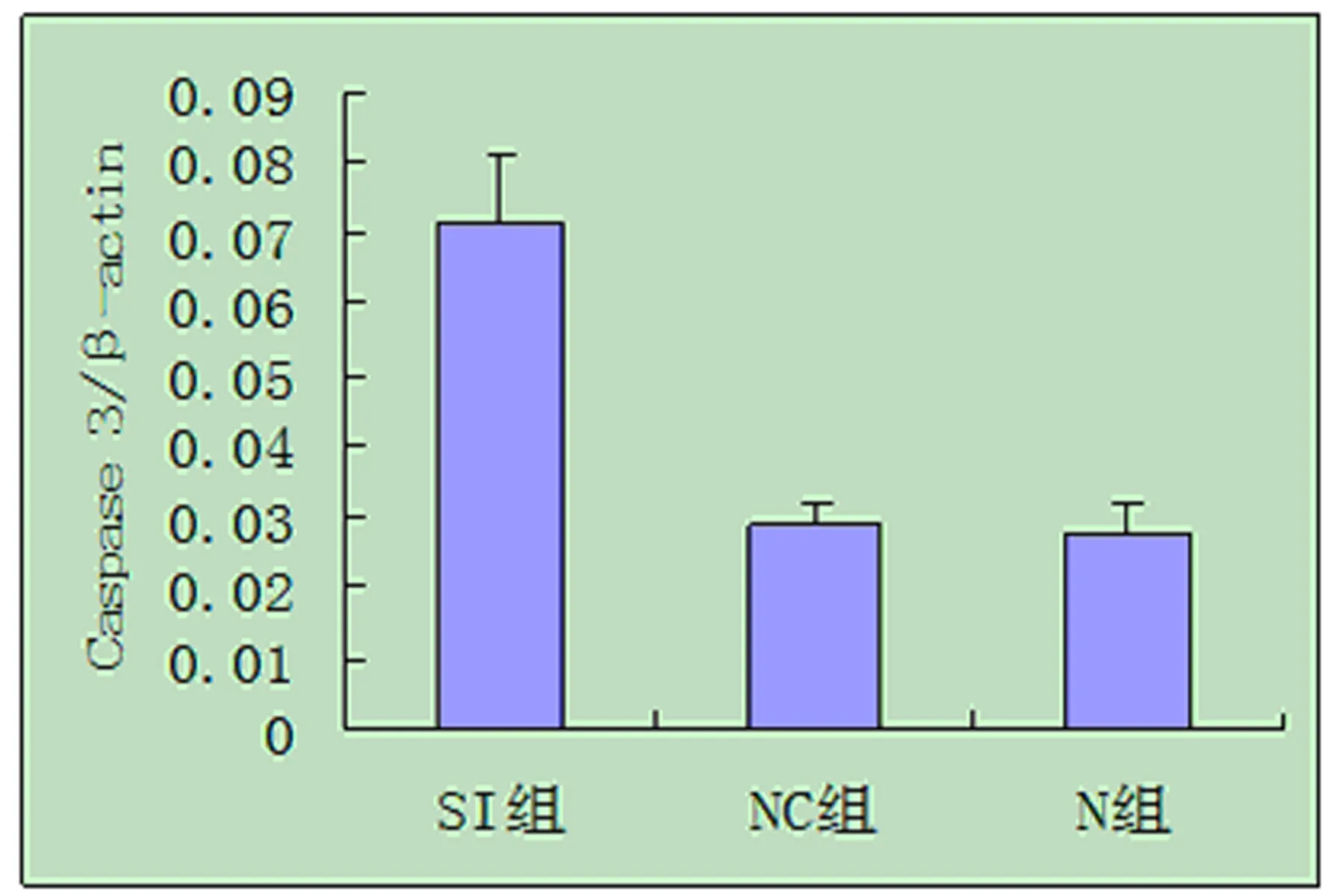
圖3 Caspase 3 mRNA表達的灰度值
2.7 miRNA-221-RNAi-LV對裸鼠移植瘤的抑制作用 通過腫瘤長短徑計算移植瘤體積,移植瘤的生長曲線如圖4所示,在注射HepG2細胞懸液3d后,SI組的移植瘤開始出現生長抑制表現,與NC組相比生長速度變慢,差異具有統計學意義(P=0.032 0,P<0.05)。

圖4 裸鼠移植瘤的生長曲線
3 討論
miRNAs通過與靶基因3’UTR結合,調控靶基因表達[4],這是最近研究的熱點問題。目前在人類已發現700 多種miRNAs,這些miRNAs可以影響正常細胞或腫瘤細胞的生長、增殖、分化、凋亡等一系列病理生理過程[5-6]。但大多數miRNAs 在腫瘤發生發展過程中的作用機制尚未完全闡明。在腫瘤中過表達的miRNAs被認為是癌基因,但是目前的研究也發現部分miRNAs在腫瘤中表達是下調的,如果其功能缺失或減弱就有導致正常的細胞發生惡變之可能,這類miRNAs被認為是抑癌基因。在某些腫瘤中,某些miRNAs的表達出現異常,多項研究發現,miRNA-221在腫瘤組織中異常表達,其中在甲狀腺乳頭狀癌[7]、胃癌[8]、乳腺癌[9-12]、肝細胞癌[13-14]、神經膠質瘤、胰腺癌、結直腸癌[15-16]等多種腫瘤中存在過表達,而在前列腺癌和胃腸道間質瘤[17]等多種腫瘤組織中存在低表達。此外, miRNA-221在乳頭狀甲狀腺癌、結直腸癌、肝癌、腎細胞癌等腫瘤患者的血清或血漿中過表達。本實驗結果顯示,將miRNA-221-RNAi-LV轉染HepG2細胞而導致PTEN基因表達上調,說明miRNA-221-RNAi-LV發揮下調miRNA-221作用顯著。下調HepG2細胞的miRNA-221后,通過調節PTEN等信號通路而使HepG2細胞生長受到抑制、遷移能力減弱。miRNA-221的表達下調后肝癌HepG2細胞的凋亡增加,同時檢測到Caspase 3的表達上調,這表明miRNA-221表達下調后促進Caspase 3的過表達是miRNA-221促進肝癌細胞凋亡的可能機制。這也提示miRNA-221在肝癌的發生發展過程中可能起癌基因的作用。
不同的研究對肝癌細胞的凋亡與miRNA-22l之間潛在關系有不同的研究結果。Dai等[18]的研究發現由內質網應激導致的細胞凋亡過程中,miRNA-22l模擬物促進肝癌細胞的凋亡,而miRNA-221阻遏物的作用恰恰相反。但Gramantieri等[19]則發現敲低miRNA-22l后,可以促進肝癌細胞SNU449的凋亡,同時該研究也發現與凋亡相關的Bmf也是miRNA-22l的分子靶標,這也表明通過影響蛋白的表達而抑制細胞的凋亡,這可能是miRNA-22l作用機制之一。
Pineau等的研究將MSCV-miRNA-221轉染入小鼠肝祖細胞中,建立肝癌小鼠模型。其研究結果顯示,與對照組相比,腫瘤發生發展的速度明顯增快,這個研究結果也表明miRNA-221可促進腫瘤的發生、發展[20]。本文研究結果表明,miRNA-221表達下調后HepG2細胞的凋亡增加。有研究證實,miRNA-221可以活化AKT,其機制是miRNA-221與 PTEN基因的3’UTR區結合,進而調節PTEN的表達,使其表達下調,從而有效激活AKT[21],其有效激活后可以促進腫瘤細胞的生長、增殖、侵襲轉移等。AKT與PTEN作為體內多個信號通路的關鍵因子, miRNA-221促進肝癌細胞增殖、侵襲轉移的可能機制就是激活PTEN/AKT信號通路。
有研究發現miRNA-221的過表達可以影響腫瘤細胞對替莫唑胺、順鉑等化療藥物的敏感性,從而影響化療效果。本研究中裸鼠移植瘤治療組與對照組的生長情況存在統計學差異,但在臨床實踐中,因為體內復雜的腫瘤微環境,單一的基因治療不一定能取得良好療效,所以下調miRNA-221的表達并聯合化療藥物或靶向藥物治療肝細胞肝癌,可能會取得更為有效的臨床效果。
綜上所述,miRNA-221-siRNA通過抑制miRNA-221的表達抑制肝癌HepG2細胞的增殖,促進其凋亡,降低其遷移能力。由于miRNA-22l在肝細胞癌中的過表達及與細胞增殖和凋亡密切關系,miRNA-221可以作為肝細胞癌基因治療的新靶點,下調miRNA-221的表達并聯合化療藥物或靶向藥物治療肝細胞癌,可能會取得更為有效的臨床效果。

