碳酸鈉濃度對廢電池鉛膏脫硫影響機制與動力學
李林波,莫 川,邢相棟*,王 莎
(1.西安建筑科技大學冶金工程學院,西安 710055; 2.陜西省冶金工程技術研究中心,西安 710055)
廢鉛酸電池已經成為再生鉛的主要來源,大約占鉛回收總量的85%左右。近年來,隨著汽車和電動自行車等行業對鉛酸蓄電池需求量的增加,導致廢舊鉛酸蓄電池產生量不斷提高,越來越多的廢舊鉛酸電池需要無害化和高值化處理。廢鉛膏高效利用是廢舊鉛酸電池處理回收的關鍵環節,如何高效、無污染、低成本的實現有效處理對廢舊鉛酸蓄電池綜合利用具有重要意義[1]。鉛膏由鉛硫酸鹽、不同價態鉛的氧化物、少量金屬鉛和微量雜質元素(Fe、Ba、Sb和Zn等)組成。在傳統的火法冶金回收方法中,不僅需要較高的溫度來分解鉛膏中的硫酸鉛,而且大量SO2酸性氣體及揮發性鉛塵的產生將導致嚴重的環境問題[2]。因此,鉛膏濕法預脫硫技術得到了許多鉛回收企業青睞,也引起了大量研究學者的廣泛關注[3]。
目前,對廢鉛膏濕法預脫硫研究較多的單一脫硫劑有碳酸鈉、碳酸鉀、碳酸銨等[4-6],復合脫硫劑有檸檬酸-檸檬酸鈉和碳酸鈉-碳酸氫鈉等[7-8]。其中碳酸鈉因其具有較好的脫硫效果和較高的經濟利用價值被常用作鉛膏脫硫劑。在鉛膏濕法脫硫過程中,碳酸鈉濃度對脫硫效率影響較大。Zhu等[9]以碳酸鈉作為脫硫劑,在碳酸鈉與硫酸鉛物質的量之比為2,液固比為10的條件下,獲得鉛膏脫硫率達到99%的轉化效果;邊文璟等[10]用碳酸鈉進行脫硫,當碳酸鈉與硫酸鉛的物質的量之比為1.1、漿液濃度為30%~60%時,可使物料含硫小于0.3%。杜新玲等[11]采用單因素實驗法分析了碳酸鈉濃度、溫度、反應時間、礦漿濃度對PbSO4轉化率的影響,得出碳酸鈉濃度在1.8 mol/L時,脫硫效率能達到98.12%。脫硫劑濃度的選擇不僅對脫硫效率影響較大,而且對脫硫過程鉛收得率(定義為脫硫后鉛膏中鉛的含量與開始投入時的比值)也會產生較大影響。因此,深入研究碳酸鈉濃度對鉛膏脫硫過程的機理對鉛膏利用具有重要意義。
本研究采用碳酸鈉作為脫硫劑,在前期對鉛膏脫硫影響因子實驗研究的基礎上,考察了碳酸鈉濃度對脫硫過程鉛膏脫硫率以及鉛收得率的影響,并且分析了鉛膏脫硫過程動力學。結合掃描電鏡-能譜儀(SEM-EDS)、X射線衍射分析儀(XRD)對鉛膏脫硫產物的結構形貌及物相組成進行表征,探索了不同濃度下鉛膏脫硫轉化機理,對完善鉛膏脫硫工藝的研究有重要的意義。
1 實驗
1.1 實驗原料
實驗所用鉛膏由某廢舊鉛酸蓄電池處理廠提供,經烘干、破碎、篩選后備用。采用化學分析方法對各成分含量進行測定,得到主要含鉛成分如表1所示。實驗所用脫硫劑為分析純碳酸鈉。

表1 鉛膏化學成分Table 1 Chemical composition of lead paste
脫硫前鉛膏SEM-EDS分析結果如圖1和表2所示。

圖1 脫硫前鉛膏SEM圖Fig.1 SEM image of lead paste before desulfurization
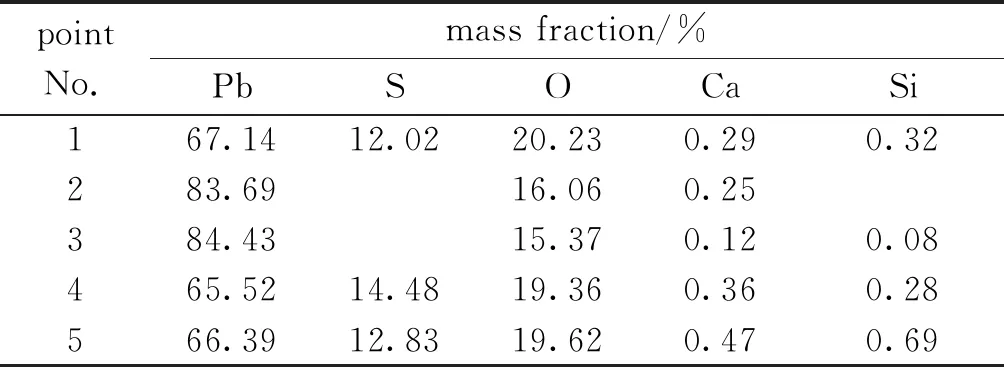
表2 脫硫前鉛膏的能譜化學分析結果Table 2 Results of chemical analysis of lead spectrum before desulfurization
由圖1可以看出,脫硫前的鉛膏形狀大小不一,主要由細長桿狀物質以及白色、灰色團狀的顆粒組成。結合表2可以得出白色團狀大顆粒為硫酸鉛,灰色顆粒為鉛氧化物,而桿狀物質可能為廢舊鉛酸蓄電池中隔板破碎后形成的玻璃纖維。
XRD分析結果如圖2所示。
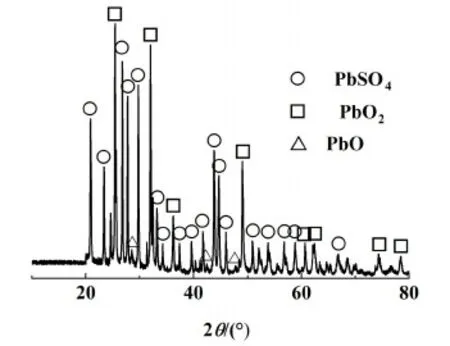
圖2 脫硫前鉛膏XRD圖Fig.2 XRD pattern of lead paste before desulfurization
圖2顯示出硫酸鉛和鉛的氧化物是鉛膏中的主要成分,其中鉛氧化物以PbO和PbO2形式存在。
1.2 實驗過程
稱取20 g鉛膏,并配置一定濃度碳酸鈉溶液。調節恒溫水浴鍋至設定溫度后,打開攪拌器,將鉛膏及碳酸鈉溶液加入燒杯,并放置于恒溫水浴鍋中,同時記錄開始反應時間。待反應時間達到預定值后,迅速取出燒杯,采用真空分液漏斗固液分離,用去離子水反復沖洗濾渣數次(去除殘留鹽),最后將干燥充分后的濾渣進行稱量,送化學分析,計算鉛膏脫硫率,并采用SEM-EDS和XRD對產物的微觀形貌和物相組成等進行分析表征。脫硫率計算如式(1)所示。
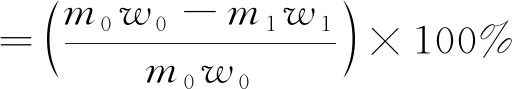
(1)
式(1)中:m1為經碳酸鹽轉化后濾渣質量,g;w1為經碳酸鹽轉化后濾渣中S的質量分數,%;m0為實驗所用鉛膏的質量,g;w0為廢鉛膏中S的質量分數,%。
采用EDTA滴定分析法對濾液中的鉛含量進行分析,計算鉛收得率,鉛收得率計算如式(2)所示。
(2)
式(2)中:V0為濾液的體積,L;c0為濾液中的鉛濃度,mol/L;w2為脫硫前鉛膏中Pb的質量分數,%。
2 實驗結果與討論
2.1 碳酸鈉濃度對鉛膏脫硫的影響
2.1.1 濃度對鉛膏脫硫率的影響
在反應溫度為60 ℃,液固比為10∶1,攪拌器轉速為50 r/min的條件下,考察了初始碳酸鈉濃度為0.125、0.166、0.208、0.228和0.250 mol/L時對鉛膏脫硫率的影響,結果如圖3所示。
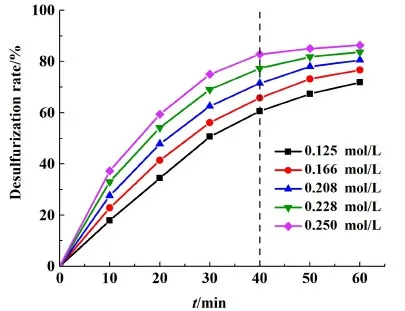
圖3 不同濃度下脫硫率隨時間的變化Fig.3 Changes of desulfurization rate with time at different concentrations
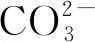
2.1.2 濃度對鉛收得率的影響
保持反應溫度為60 ℃,液固比為10∶1,攪拌器轉速為50 r/min的條件,考察碳酸鈉濃度對鉛收得率的影響,結果如圖4所示。
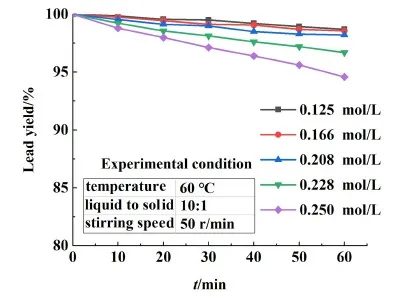
圖4 碳酸鈉濃度對鉛收得率的影響Fig.4 Effect of sodium carbonate concentration on yield of lead
圖4表明,碳酸鈉濃度對鉛收得率影響顯著。當碳酸鈉濃度低于0.208 mol/L時,隨著反應時間的延長,鉛收得率基本不變,均在98.56%以上。隨著碳酸鈉濃度的增加,鉛收得率顯著降低,在濃度0.250 mol/L,時間60 min時,鉛收得率僅有94.60%。這主要是由于脫硫過程生成的碳酸鉛與碳酸鈉能夠繼續發生反應,生成的產物溶解度較高,溶解量變大造成鉛收率下降。
2.2 鉛膏脫硫動力學分析
2.2.1 動力學模型
鉛膏脫硫轉化是一個液固反應,反應過程中有固體物生成,且生成物附著在未反應核之外,因此可采用有固相生成的收縮未反應核模型進行描述[13]。收縮未反應核模型主要有內擴散控制、表面化學反應控制及二者混合控制[14]3種模型。碳酸鈉與硫酸鉛反應時,必須到達硫酸鉛的表面。因此,反應的具體步驟為:1)溶液中參與硫酸鉛反應的碳酸鈉通過液膜層到達固體表面的傳質擴散。2)碳酸鈉經過固相產物碳酸鉛膜層到達硫酸鉛表面的傳質擴散。3)碳酸鈉擴散到硫酸鉛表面與硫酸鉛發生脫硫反應。生成的硫酸鈉經固相膜層由反應表面向外擴散,經固相表面上的液膜層向液相擴散。
將固態反應物硫酸鉛近似按球形處理,假設界面化學反應為一級不可逆反應,液態產物的擴散速率足夠快[15],則以上步驟依次發生的動力學方程式如式(3)~式(5)。
1)反應物Na2CO3通過液體邊界層的擴散速率為:
(3)
2)反應物Na2CO3通過固體產物層PbCO3的擴散速率為:
(4)
3)界面化學反應速率為:
(5)
式(3)~式(5)中:C1為反應物外表面的濃度;C2為固體內部的濃度;C12為反應界面處的濃度;r0為反應后固體的半徑;r為未反應核的半徑;D1為反應物通過液體邊界層的有效擴散系數;D2為反應物通過固體產物層的有效擴散系數;δ為液體邊界層厚度;k為界面化學反應速率常數。
通過對式(3)~式(5)積分可導出該模型包含的3個控制步驟方程,如式(6)~式(8)所示。
t1=[1-(1-α)1/3]/k1
(6)
t2=[1-2α/3-(1-α)2/3]/k2
(7)
t=[1-(1-α)1/3]/k1+
[1-2α/3-(1-α)2/3]/k2
(8)
2.2.2 溫度對鉛膏脫硫率的影響
在鉛膏粒徑為0.25~0.35 mm,液固比為10∶1,攪拌器轉速為50 r/min,轉化劑濃度分別在0.125、0.166、0.208、0.228和0.250 mol/L的條件下,研究不同溫度對鉛膏脫硫率的影響。圖5是濃度為0.208 mol/L時不同溫度對鉛膏脫硫率的曲線圖。
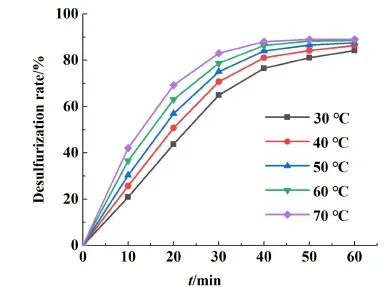
圖5 不同溫度下脫硫率隨時間的變化Fig.5 The change of desulfurization rate with time at different temperatures
由圖5可知,隨著溫度的增加,反應速率明顯加快,這是由于溫度的提高降低了溶液的黏度,增加了溶液中離子的擴散速度。在反應時間40 min的條件下,當反應溫度由30 ℃提升至60 ℃,鉛膏脫硫率由76.46%提高到86.33%;之后,進一步提高反應溫度,脫硫率增加較小。
將圖5數據代入式(6)及式(7),得出了不同溫度下的動力學模型如圖6所示。
圖6 不同溫度下2種動力學模型圖Fig.6 Two kinetic model diagrams at different temperatures
2種模型可以得出,化學反應控制的相關系數均大于擴散控制,可以得出鉛膏脫硫過程更傾向于為化學反應控制。圖6中所得直線斜率即為反應速率常數,以lnk對T-1做圖得到鉛膏脫硫過程活化能,濃度為0.208 mol/L時其擬合結果如圖7所示。
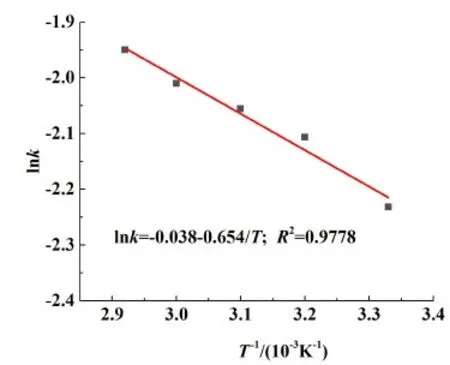
圖7 濃度為0.208 mol/L時 lnk-T-1的關系曲線Fig.7 The relationship between lnk-T-1 at the concentration of 0.208 mol/L
同樣,對其他4種濃度下的動力學模型進行分析,并擬合lnk-T-1關系曲線。經計算,最終得出在化學反應控制模型條件下鉛膏脫硫活化能變化如圖8所示。
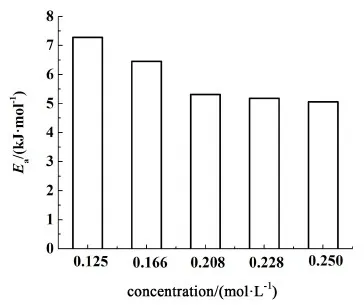
圖8 濃度與活化能關系圖Fig.8 Relationship between concentration and activation energy
由圖8可以看出,濃度對活化能的影響顯著,隨著濃度的增加,活化能不斷減小。濃度從0.125 mol/L增至0.208 mol/L時,活化能降低幅度較大,由7.275 kJ/mol降至5.312 kJ/mol。之后活化能隨濃度的增加基本趨于穩定。
2.3 鉛膏脫硫產物表征
為了明確不同濃度下鉛膏脫硫產物形貌結構和物相組成,分析鉛膏脫硫轉化機理,采用SEM-EDS和XRD對脫硫產物表征。結果如圖9、表3和圖11所示。
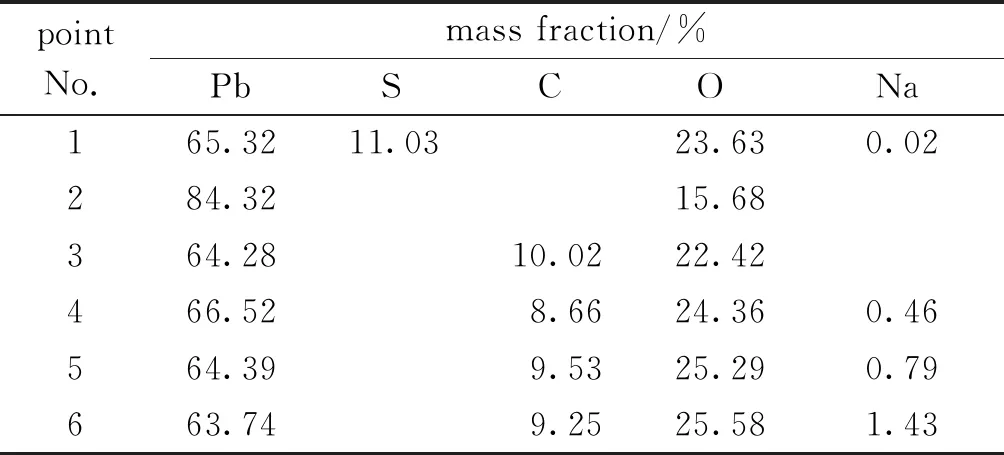
表3 脫硫后鉛膏的能譜分析結果Table 3 Energy spectrum analysis results of lead paste after desulfurization
由圖9及表3可以看出,脫硫產物中出現的灰色團狀物質為硫酸鉛及鉛的氧化物,附著在灰色聚集物表面的白色小顆粒為碳酸鉛及堿式碳酸。另外,白色小顆粒隨濃度的增加而增多,且逐漸成為表面疏松多孔的團狀聚集物。
圖10表明,在碳酸鈉濃度低于0.166 mol/L時,脫硫產物中出現碳酸鉛及堿式碳酸鉛,這主要是因為發生了式(9)和式(10)反應,由于脫硫反應不完全,產物中含有部分硫酸鉛。
PbSO4+Na2CO3=PbCO3+Na2SO4
(9)

圖9 不同濃度下脫硫鉛膏SEM圖Fig.9 SEM image of desulfurized lead paste at different concentrations
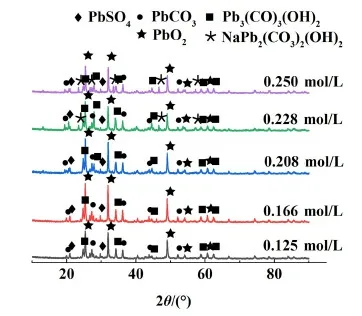
圖10 不同濃度下脫硫產物的XRD圖Fig.10 XRD pattern of desulfurization products at different concentrations
(10)
在脫硫劑濃度為0.208 mol/L時,產物中存在較多堿式碳酸鉛,而PbCO3逐漸減少。這是由于濃度的增加,溶液中OH-增多,PbCO3向Pb3(CO3)2(OH)2發生轉化。產物中硫酸鉛幾乎不存在,說明脫硫反應較為徹底;在濃度為0.228 mol/L時,脫硫產物中開始出現鈉鹽[NaPb2(CO3)2(OH)2]。堿式碳酸鉛和碳酸鈉繼續發生式(11)反應。此結果與相關研究[16-18]結果基本一致。鉛氧化物在整個脫硫反應過程中含量幾乎沒有變化,說明碳酸鈉濃度變化對鉛氧化物沒有影響。
Pb3(CO3)2(OH)2+2Na2CO3=
3NaPb2(CO3)2(OH)2+NaOH
(11)
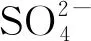
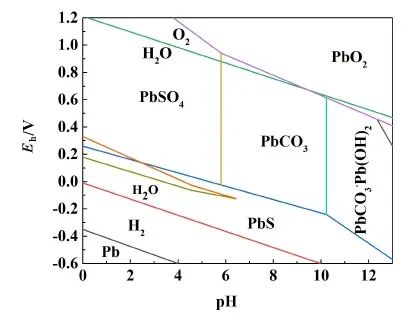
圖11 水溶液中鉛化物熱力學穩定圖[19]Fig.11 Thermodynamic stability diagram of lead in aqueous solution[19]
2.4 碳酸鈉濃度對鉛膏脫硫過程影響機理分析
基于以上分析,碳酸鈉作為鉛膏脫硫的脫硫劑,其濃度對脫硫過程的影響機理圖如圖12所示。
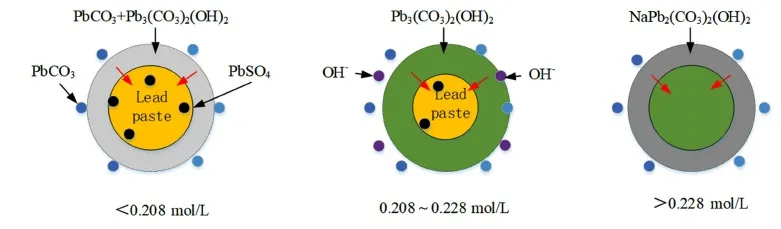
圖12 濃度對鉛膏脫硫過程影響機理圖Fig.12 Effect of concentration on the desulfurization process of lead paste
圖12表明,在碳酸鈉濃度小于0.208 mol/L時,碳酸鈉進入鉛膏內與硫酸鉛發生反應,生成的產物PbCO3和Pb3(CO3)2(OH)2覆蓋在鉛膏表面。在濃度進一步增大時,PbCO3與溶液中的OH-離子發生反應生成Pb3(CO3)2(OH)2,而濃度達到0.228 mol/L后,Pb3(CO3)2(OH)2部分轉化為鈉鹽[NaPb2(CO3)2(OH)2],由于NaPb2(CO3)2(OH)2溶解度較大,導致濾液中鉛含量增加,造成鉛收得率下降。
3 結論
1)碳酸鈉濃度對鉛膏脫硫效率和鉛收得率影響顯著。當碳酸鈉濃度在0.125 mol/L時,鉛膏脫硫率為73.83%,鉛收得率為98.56%,隨著濃度的增加,脫硫率不斷提高,鉛收得率逐漸下降,在濃度為0.250 mol/L時,脫硫率為86.56%,鉛收得率僅為91.81%。
2)鉛膏脫硫過程主要受化學反應控制,且隨著濃度的增加,表觀活化能逐漸減小,濃度從0.125 mol/L增至0.208 mol/L時,其活化能由7.275 kJ/mol降至5.312 kJ/mol,之后隨著濃度的增加,活化能變化較小。
3)碳酸鈉濃度小于0.208 mol/L時,脫硫產物主要是以PbCO3和Pb3(CO3)2(OH)2形式存在;濃度越大,脫硫產物中Pb3(CO3)2(OH)2越多,PbCO3逐漸減少;濃度達到0.228 mol/L時,Pb3(CO3)2(OH)2與Na2CO3進一步發生反應,脫硫產物中含有較多鈉鹽,導致鉛收得率明顯降低。

