含笑內酯衍生物ACT001對肺纖維化的治療作用研究
李咪咪,漢京霞,孫 濤,2,劉慧娟,2
(天津國際生物醫藥聯合研究院 1.分析測試中心,2.早期成藥性評價重點實驗室,天津 300457)
肺纖維化是由多種病因引起的嚴重肺間質慢性疾病。發病機制迄今尚未闡明,缺乏特異性治療[1]手段。二甲基胺含笑內酯富馬酸鹽(DMAMCL,命名為ACT001)是由倍半萜內酯類化合物小白菊內酯經化學合成而來[2],具有在水中易溶、原料易得、制備工藝成熟簡單、成藥性好的特性,目前其作為腦膠質瘤治療藥物的臨床試驗已經在開展。研究表明,ACT001可通過作用于IκB激酶β(inhibitor kappa B kinaseβ,IKKβ)蛋白,中等強度地抑制核轉錄因子κB(nuclear factor kappa-B,NF-κB),同時提高癌細胞中的活性氧簇水平,兩者均可誘導癌細胞的凋亡[3-5]。在肺纖維化過程中,NF-κB可通過促進腫瘤壞死因子α(tumor necrosis factor α,TNF-α)、白細胞介素-1β(interleukin-1β,IL-1β)、IL-8和轉化生長因子-β(transforming growth factor-β,TGF-β)等炎癥因子的基因轉錄而介導肺泡炎和肺纖維化[6]的發生發展;肺纖維化小鼠用抗TGF-β1[7]抗體治療后,發現血清中細胞因子IL-4、IL-6水平明顯下降,組織羥脯氨酸(hydroxyproline,HYP)含量也減少,肺纖維化被明顯抑制,同時,TGF-β是上皮細胞在發生上皮-間充質轉變(epithelial-mesenchymal transition,EMT)過程中的重要調節分子之一。有研究發現[8],ACT001可降低類風濕關節炎小鼠淋巴結中NF-κB相關炎癥因子TNF-α、IL-1β、IL-6及IL-17等炎癥因子的表達水平;也有研究顯示,ACT001可以通過降低炎癥因子TNF-α的表達而對銀屑病具有治療作用。基于以上研究背景,我們推測,ACT001可能通過抑制NF-κB的活化、抑制EMT過程并且調節肺纖維化相關炎癥因子的表達等發揮治療肺纖維化的作用。
1 材料
1.1 試劑DMEM培養基、胎牛血清、胰蛋白酶、青/鏈霉素購自Gibco 公司;NIH-3T3(小鼠成纖維細胞系)購自美國ATCC;MTT購自上海生工生物;二甲基亞砜(DMSO)購自Sigma公司;地塞米松磷酸鈉、硫酸博來霉素(bleomycin, BLM)購自大連美侖生物技術有限公司;百草枯(paraquat, PQ)購自百靈威科技有限公司;羥脯氨酸(hydroxyproline,HYP)測定試劑盒購自南京建成生物工程研究所;TNF-α、IFN-γ、TGF-β1 ELISA檢測試劑盒購自上海酶聯生物科技有限公司;ACT001由南開大學陳悅教授提供。
1.2 實驗動物實驗動物品系為SPF級昆明健康小鼠體質量(18~22) g,購自中國人民解放軍軍事醫學科學院實驗動物中心,實驗動物使用許可證號為:0039483。
2 方法
2.1 小鼠肺纖維化模型的建立及給藥治療本研究共建立兩種小鼠肺纖維化模型,誘導劑分別為百草枯(PQ)和博來霉素(BLM)。每種小鼠肺纖維化模型中,隨機將60只小鼠分為2組,空白組10只,建模組50只。由PQ誘導的小鼠肺纖維化模型,建模組小鼠在建模前,提前禁食16 h,灌胃給予劑量為100 mg·kg-1,空白組用同體積的生理鹽水灌胃;由BLM誘導的小鼠肺纖維化模型,建模組小鼠經氣管灌注給予BLM水溶液(5 mg·kg-1),空白組用同樣方式灌注同體積的生理鹽水,建模當天記為d 1。
d 7將建模組的50只小鼠隨機分為5組,分別為:模型組10只、陽性藥地塞米松組10只、ACT001組(設置高、中、低3個劑量組,每組10只),♀♂各半。d 8小鼠給藥治療(給藥前稱重),ACT001高(ACT001-H)、中(ACT001-M)、低(ACT001-L)劑量組每次分別按50、25、12.5 mg·kg-1劑量灌胃給藥治療;陽性藥地塞米松(dexamethasone,DEX)組,按0.45 mg·kg-1劑量灌胃給藥治療,空白組及模型組小鼠按體重灌胃給予相應體積的生理鹽水,給藥時間為28 d。自給藥之日起,每天測定各組小鼠體重,觀察并記錄小鼠的一般生活狀態。d 39(給藥結束d 2)將各組小鼠稱重,然后進行摘眼球取血置于含肝素鈉的EP管中,4 ℃離心機離心,4 000×g,15 min,取上清用于測定血漿中的TNF-α、IFN-γ、TGF-β1含量。取血后脊椎脫臼處死小鼠,取小鼠肺組織稱重,并計算肺系數:肺系數=肺濕重(g)·體質量(kg)-1。取左肺凍存于-80 ℃冰箱中,用于進行膠原百分含量的測定;將右肺組織經10%福爾馬林固定。
2.2 肺組織HYP及肺組織膠原百分含量測定精確稱取肺組織濕重,放入離心管,準確加入水解液,混勻。加蓋后95 °C水或沸水水解20 min,水解10 min 混勻1次,嚴格按照試劑盒說明書具體操作,檢測肺組織HYP含量[9]。HYP百分含量/%=(樣品吸光度÷標準液吸光度)×標準液濃度×稀釋倍數×樣品體積÷肺組織干粉重量×100%;膠原百分含量/%=HYP百分含量(%)×7.46。
2.3 組織病理學評估肺組織肺纖維化程度將固定后的各組小鼠肺組織用流水沖洗,常規脫水、制作石蠟組織切片,進行蘇木精-伊紅(HE)染色及Masson染色,在顯微鏡下觀察肺組織的形態學變化以及膠原纖維含量的變化。
2.4 免疫組化石蠟切片經二甲苯脫蠟、梯度酒精脫水后,放入檸檬酸緩沖液中進行高溫修復,蒸餾水沖洗,10%山羊血清濕盒內封閉20 min,后滴加一系列的一抗,4 ℃搖床孵育過夜,PBS沖洗,滴加稀釋的二抗(1 ∶1 000),室溫避光孵育1 h,PBS沖洗,滴加DAB顯色。蘇木精染核1~2 min,脫水至二甲苯,最后,將中性樹膠滴在玻片組織區后蓋上蓋玻片,顯微鏡下觀察拍照。免疫組化圖片的評分方法:染色強度評分標準:無染色:0;淺棕黃色:+;棕黃色:++;棕褐色:+++。染色面積所占比率評分標準:1%~25%,1;25%~50%,2;50%~75%,3;>75%,4。總分=顏色深度評分×染色面積所占比率評分。
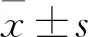
3 結果
3.1 ACT001對PQ誘導的肺纖維化模型的治療作用
3.1.1小鼠生活狀態觀察和體質量變化 實驗過程中,對各組小鼠的一般生活狀態進行臨床觀察:空白組小鼠,反應靈敏,皮毛發亮、有光澤,呼吸平穩;與空白組小鼠相比,模型組小鼠精神萎靡,皮毛雜亂、無光澤,呼吸急促,體形較消瘦;ACT001各劑量組及地塞米松組小鼠精神、食欲、皮毛色澤、體重及活動情況較模型組均有所改善。同時,小鼠體重檢測結果顯示,給藥2周后,陽性藥地塞米松組及ACT001各劑量組的體重增長情況均好于模型組。給藥結束后,與空白組相比,模型組小鼠的體重明顯降低(P<0.01);與模型組相比,ACT001高、中、低劑量組及地塞米松組的小鼠體重明顯升高(P<0.01)。ACT001-高劑量組的體重改善情況好于地塞米松組(Fig 1A)。
3.1.2ACT001對PQ誘導的肺纖維化模型小鼠肺系數與HYP百分含量的影響 在肺纖維化的發生與發展過程中,肺系數與肺組織HYP百分含量有明顯變化:與空白組相比,模型組小鼠肺系數明顯升高(P<0.01),由此可見,模型的建立是成功的;與模型組相比,ACT001-高劑量組、ACT001-中劑量組、ACT001-低劑量組及陽性藥地塞米松組小鼠肺系數均明顯減小(P<0.01);與陽性藥地塞米松組相比,ACT001-高劑量組小鼠肺系數低于陽性藥地塞米松組(Fig 1B)。
小鼠肺組織HYP百分含量與膠原百分含量結果顯示:與空白組相比,模型組小鼠肺組織HYP百分含量與膠原百分含量均明顯升高(P<0.01);與模型組相比,ACT001-高劑量組、ACT001-中劑量組、ACT001-低劑量組及陽性藥地塞米松組小鼠的肺組織HYP百分含量及膠原百分含量均明顯降低(P<0.01);與陽性藥地塞米松組相比,ACT001-高劑量組小鼠肺組織HYP百分含量及膠原百分含量均低于陽性藥地塞米松組(Fig 1C,D)。
3.1.3ACT001對PQ誘導的肺纖維化模型小鼠肺組織病理變化的影響 HE染色(Fig 2A)及組織病理學評分(Fig 2B)結果顯示:空白組肺內部結構清晰,未出現水腫、炎癥及纖維化特征,肺泡腔內未發現有明顯滲出物。與空白組比較,模型組肺組織結構破壞,炎性細胞浸潤明顯,肺泡腔明顯縮小,膠原纖維和成纖維細胞大量增多,替代了肺間質,可見明顯的肺間質纖維化,組織病理學評分明顯升高(P<0.01);地塞米松組肺組織炎性細胞浸潤區域較模型組有所減少,肺泡炎感性程度和肺纖維化程度較模型組有所降低,但仍有較多的纖維組織增生,肺泡腔的縮小程度有所改善。與模型組相比較,ACT001各劑量組小鼠的肺組織炎性細胞浸潤區域明顯減少,肺組織結構較模型組也更為完整,成纖維細胞增殖減輕,肺泡炎性程度和肺纖維化程度較模型組有不同程度的降低,組織病理學評分均明顯降低(P<0.01),其中,ACT001-高劑量組效果最明顯。由此可見,ACT001可以劑量依賴性的改善PQ誘導的肺纖維化程度。

Fig 1 Effect of ACT001 on body weight, lung confficient, content of hydroxyproline and collagen in PQ-induced PF mice n=10)
Masson染色結果顯示(Fig 2 C,D),空白組小鼠肺組織支氣管壁的膠原層較薄,肺泡區分布有少量纖細的膠原;模型組小鼠肺組織支氣管壁、肺間質和肺泡隔中膠原纖維明顯增多,小血管壁及其周圍,膠原分布較空白組多,支氣管周圍膠原增生,并延伸向肺間質、在間質沉積,肺組織局部充血水腫、可見明顯的紅細胞聚集,組織病理學評分明顯升高(P<0.01);與模型組比較,地塞米松組可見肺間質中支氣管壁、血管壁和肺泡隔的膠原染色程度較模型組有所減輕;ACT001各劑量組肺間質中支氣管壁、血管壁和肺泡隔的膠原染色及肺組織局部充血水腫現象均較模型組有不同程度的減輕。其中,ACT001-高劑量組效果最明顯(P<0.01)。
3.1.4ACT001對PQ誘導的肺纖維化模型炎癥因子的影響 利用ELISA試劑盒檢測ACT001對血漿中肺纖維化相關炎癥因子的影響,結果顯示:與空白組相比,模型組的TGF-β1及TNF-α含量均升高(P<0.01);IFN-γ含量明顯降低(P<0.01);與模型組比較,ACT001-高劑量組TGF-β1及TNF-α的含量明顯降低(P<0.01),IFN-γ水平明顯升高(Fig 3)。
3.2 ACT001對BLM誘導的肺纖維化模型的治療作用
3.2.1小鼠生活狀態觀察和體重變化 實驗過程中,對各組小鼠的一般生活狀態進行觀察:空白組小鼠反應靈敏,皮毛光澤、發亮、呼吸平穩,體重逐漸增加;模型組小鼠精神不振、活動減少、皮毛枯槁、無光澤、呼吸急促、體形消瘦;ACT001各劑量組及地塞米松組小鼠精神、食欲、皮毛色澤、體重及活動情況較模型組均明顯改善。同時,小鼠體重檢測結果顯示,給藥后陽性藥組及ACT001組的體重增長情況好于模型組。給藥結束后,與空白組相比,模型組小鼠的體重明顯降低(P<0.01);與模型組相比,ACT001-高、中、低劑量組及地塞米松組對BLM誘導的肺纖維化模型小鼠的體重降低均有明顯改善(P<0.01)(Fig 4A)。

Fig 2 Effect of ACT001 on histopathological changes in PQ-induced PF mice n=10)

Fig 3 Effect of ACT001 on content of inflammatory factors in PQ-induced PF mice n=10)
3.2.2ACT001對BLM誘導的肺纖維化模型小鼠肺系數與HYP百分含量的影響 肺系數評價結果顯示(Fig 4B):與空白組相比,模型組小鼠肺系數明顯升高(P<0.01);與模型組相比,ACT001-高劑量組、ACT001-中劑量組、ACT001-低劑量組及陽性藥地塞米松組小鼠肺系數均明顯減小(P<0.01);與陽性藥地塞米松組相比,ACT001-高劑量組小鼠肺系數低于陽性藥地塞米松組,具有明顯差異(P<0.01)。
小鼠肺組織羥脯氨酸百分含量與膠原百分含量檢測結果顯示:與空白組相比,模型組小鼠肺組織羥脯氨酸百分含量與膠原百分含量均明顯升高(P<0.01);與模型組相比,ACT001-高劑量組、ACT001-中劑量組及陽性藥地塞米松組小鼠的肺組織羥脯氨酸百分含量及膠原百分含量均明顯降低(P<0.01);與陽性藥地塞米松組相比,ACT001-高劑量組小鼠肺組織羥脯氨酸百分含量及膠原百分含量明顯降低(Fig 4 C,D)。

Fig 4 Effect of ACT001 on body weight, lung coefficient, content of hydroxyproline and content of collagen in BLM-induced PF mice n=10)

Fig 5 Effect of ACT001 on histopathological changes in BLM-induced PF mice n=10)
3.2.3ACT001對BLM誘導的肺纖維化模型小鼠肺組織病理變化的影響 HE染色(Fig 5A)及病理學評分(Fig 5B)結果顯示:空白組肺組織內部結構清晰,沒有水腫、炎癥及纖維化特征。與空白組比較,模型組肺組織結構明顯破壞,炎性細胞浸潤明顯,肺泡腔縮小,膠原纖維和成纖維細胞大量增多,可見明顯的肺間質纖維化,組織纖維化程度病理學評分明顯升高(P<0.01);地塞米松組肺組織炎性細胞浸潤區域較模型組有所減少,肺泡炎性程度和肺纖維化程度較模型組有所降低,但仍有較多的纖維組織增生。與模型組比較,ACT001各劑量組小鼠的肺組織炎性細胞浸潤區域明顯減少,肺組織結構較模型組也更為完整,成纖維細胞增殖程度減輕,肺泡炎程度和肺纖維化程度較模型組有不同程度的降低,其中,ACT001-高劑量組及ACT001-中劑量組的組織病理學評分降低明顯(P<0.01)。以上結果表明,ACT001可以明顯改善BLM誘導的肺纖維化程度。
Masson染色結果顯示(Fig 5 C,D),空白組小鼠肺組織支氣管壁的膠原層較薄,肺泡區僅有少量纖細的膠原;模型組小鼠肺組織支氣管壁、肺間質和肺泡隔中膠原纖維明顯增多,小血管壁及其周圍膠原分布較空白組多,支氣管周圍膠原增生,并延伸向肺間質、在間質沉積,肺組織局部充血水腫、可見明顯的紅細胞聚集,組織病理學評分明顯升高(P<0.01);與模型組比較,地塞米松組可見肺間質中支氣管壁、血管壁和肺泡隔的膠原染色較模型組有所減輕;ACT001各劑量組肺間質中支氣管壁、血管壁和肺泡隔的膠原染色及肺組織局部充血水腫現象均較模型組有不同程度的減輕。其中,ACT001-高劑量組效果最明顯(P<0.01)。
3.2.4ACT001對BLM誘導的肺纖維化模型炎癥因子的影響 利用ELISA試劑盒檢測ACT001對血漿中肺纖維化相關炎癥因子的影響,結果顯示(Fig 6):與空白組相比,模型組的TGF-β1及TNF-α含量均升高(P<0.01);IFN-γ含量明顯降低(P<0.01);與模型組比較,ACT001-高劑量組TGF-β1及TNF-α的含量明顯降低(P<0.01),IFN-γ水平明顯升高(P<0.01)。
3.3 ACT001抑制肺纖維化模型小鼠EMT相關蛋白的表達本研究分析了ACT001對肺纖維化小鼠肺組織中EMT相關蛋白的影響(Fig 7)。對IHC結果進行分析,ACT001增加了上皮細胞標志物,E-cad的表達,并降低了間充質細胞標志物Vimentin的表達;同時,ACT001促進了細胞因子MMP2的表達水平。與模型組相比,ACT001可以抑制肺纖維化小鼠肺組織NF-κB的表達,并呈現劑量依賴性。這些結果顯示,ACT001可以抑制NF-κB的表達,并且抑制肺上皮細胞的EMT進程。

Fig 6 Effect of ACT001 on content of inflammatory factors in BLM-induced PF mice n=10)
4 討論
肺纖維化的主要特征為彌漫性肺泡炎和肺泡結構紊亂,最終可導致肺間質的纖維化,是導致呼吸衰竭的主要病理基礎,是一種難治愈、死亡率高的肺間質疾病。在肺纖維化模型中,百草枯和博來霉素是目前應用較多的兩種肺纖維化模型的誘導劑。百草枯為聯吡啶類化合物,是一種除草劑。研究顯示,百草枯中毒后,肺臟是其主要靶器官。中毒5~9 d后,可見繼發性損傷致肺纖維化。因而,由百草枯誘導的肺纖維化,以發病最快、最典型而被大多研究采用。目前,百草枯誘導肺纖維化,其發病機理仍不清楚。有研究稱,百草枯被吸收后,機體受刺激而產生大量氧自由基,引起器官、組織、細胞的脂質氧化;也有研究稱,肺泡細胞可主動攝取和蓄積百草枯,而導致嚴重的肺臟受損,最終導致肺纖維化。博來霉素提取自輪生鏈霉菌,是一種抗腫瘤藥物。有研究發現,博來霉素被肺泡吸收后,可影響炎癥因子的表達,誘發肺纖維化的發生。目前,由博來霉素誘導的肺纖維化的動物模型也已被普遍應用。本研究發現ACT001對上述兩種模型都有一定的治療效果。表明ACT001可能對肺纖維化過程中的脂質過氧化過程和炎癥因子的產生都有一定的阻斷作用。
大量間質細胞,如成纖維細胞和肌成纖維細胞的積聚和增殖,是肺纖維化的主要病理特點,多項研究表明,這些細胞是由上皮細胞發生上皮-間充質樣轉變轉化而來[10-11]。Milara等[12]的研究也發現,無論是在肺腺癌A549細胞中,還是在特發性肺纖維化患者中,都存在EMT過程,伴隨上皮細胞標志物、E-鈣黏蛋白的下調及間質細胞標志物α-肌動蛋白、纖連蛋白的上調。TGF-β是EMT發生的主要調節分子之一,其通過Smad依賴性的HEY1基因來激活細胞的EMT過程[13]。也有研究發現,肺纖維化中肌成纖維細胞活化與TGF-β1/ERK/Smad3通路相關[14]。肺纖維化小鼠用抗TGF-β1抗體治療后,體內血清細胞因子IL-4、IL-6水平均明顯下降,組織羥脯氨酸(HYP)含量也減少,肺纖維化被明顯抑制。本研究結果提示,ACT001可降低肺纖維化模型小鼠的TGF-β1水平,促進E-cad的表達,抑制Vimentin的表達,從而抑制EMT進程,發揮治療肺纖維化的作用。
NF-κB是一種重要的核轉錄因子,在肺纖維化的發生與發展中發揮重要作用。在肺纖維化過程中,NF-κB 可通過促進炎癥因子TNF-α、IL-1β、IL-8和TGF-β1等的基因轉錄而介導肺泡炎和肺纖維化的發生與發展[15]。研究表明,牛磺酸、尼克酸、活化蛋白C等均可以通過抑制NF-κB的活化減少纖維細胞膠原的合成,減輕肺纖維化的程度[6,16]。Tong等[17]在硫酸葡聚糖誘導的炎癥性腸病動物模型實驗中發現,ACT001可通過抑制NF-κB的激活,降低炎性腸病的癥狀,降低炎癥導致的腫瘤發生幾率;王振華等[8]研究中發現,ACT001能降低類風濕關節炎小鼠的淋巴結中與NF-κB相關炎癥因子TNF-α、IL-1β、IL-6及IL-17等的表達水平。本研究顯示,ACT001可明顯抑制細胞核內的p65的表達水平,并且隨著ACT001濃度的升高,這種抑制作用也隨之加強。ACT001也可降低肺纖維化模型小鼠的TNF-α、IL-4、TGF-β1水平,表明ACT001可以通過抑制NF-κB的活化來抑制TNF-α、IL-4、TGF-β1的表達水平,進而發揮治療肺纖維化的作用。
綜上所述,ACT001可以通過抑制NF-κB的活性,抑制TNF-α、IL-4、TGF-β1等肺纖維化過程中關鍵炎癥因子的分泌并上調IFN-γ因子,從而抑制支氣管上皮、肺泡上皮細胞轉化為成纖維細胞和肌成纖維細胞等間充質細胞,抑制成纖維細胞的增殖、遷移及膠原合成,調節細胞外基質的代謝,從而發揮抑制肺纖維化的作用。此外,ACT001具有良好的安全性,已被作為治療膠質母細胞瘤的孤兒藥物[18],正在進行多項臨床試驗(ACTRN12616000228482,澳大利亞和新西蘭;ChiCTR-OIC-17013604,中國),有望開發為治療肺纖維化的新藥。

Fig 7 Influenced of ACT001 on expression of EMT-related proteins in BLM-induced PF mice n=10)

