miR-29a-3p和miR-144a-3p下調人非小細胞肺癌細胞COL11A1表達并抑制其增殖、遷移和侵襲
趙田甜,左 瑋,淦 鑫
(南昌大學第一附屬醫院呼吸與危重癥醫學科,江西 南昌 330006)
肺癌是世界范圍內最常見的惡性腫瘤,也是癌癥相關性死亡人數最多的惡性腫瘤[1]。據最新流行病學數據顯示,肺癌的5年生存率僅為15.7%~17.4%[2]。在所有肺癌患者發病人數中,非小細胞肺癌(non-small cell lung cancer,NSCLC)最為常見,占所有肺癌總發病數的85%[2]。與小細胞肺癌相比,雖然NSCLC的生長速度相對較慢,但NSCLC確診時,大多數患者已處于中晚期[3]。目前,小分子酪氨酸激酶抑制劑和免疫治療劑雖然給NSCLC患者帶來了的生存益處,但NSCLC的5年生存率仍然很低[3-4]。因此,迫切需要繼續尋找NSCLC治療的策略。
Ⅺ型膠原α1(collagen type XI alpha 1,COL11A1)屬于膠原蛋白家族成員之一,是間質細胞外基質的主要成分。有研究表明,COL11A1在胃癌、結腸癌、胰腺癌和復發性肺癌等多種惡性腫瘤中表達上調,且其異常高表達與腫瘤的惡性轉移和預后不良有關[5-8]。但COL11A1在這些腫瘤中具體的生物學功能卻不明確。因此,本研究目的之一是探討COL11A1在NSCLC中的關鍵作用。
眾所周知,microRNAs (miRNAs)在腫瘤的發生發展過程中發揮著重要作用。眾多miRNAs可作為胃癌、肝癌、甲狀腺癌和膀胱癌等多種腫瘤的診斷和治療的標志物[9-12]。因此,對NSCLC中miRNAs的鑒定和篩選有助于識別NSCLC新的診斷或治療性生物標志物。在本研究中,我們發現COL11A1在NSCLC組織和細胞中明顯上調。COL11A1的下調抑制了NSCLC細胞的增殖、遷移和侵襲。目前,COL11A1表達與miRNA調節在NSCLC進展中的內部聯系尚不清楚。因此,我們嘗試通過targetScan 7.2軟件尋找與COL11A1存在潛在靶向關系的miRNAs,鑒定它們在NSCLC中與COL11A1的內在聯系,并試圖分析miRNAs/COL11A1軸在NSCLC發病機制中的關鍵作用,為其在NSCLC治療中的提供潛在的應用策略。
1 材料與方法
1.1 材料
1.1.1試劑 COL11A1 siRNA、陰性對照siRNA(negative control siRNA,NC-siRNA)、COL11A1抗體、Ki67抗體和基質金屬蛋白酶2(matrix metalloproteinase 2,MMP-2)抗體購自Santa Cruz;EdU試劑盒、CCK-8試劑盒、BCA蛋白定量試劑盒、雙熒光素酶報告基因檢測試劑盒、β-actin抗體和二抗購自上海碧云天公司;RPMI 1640培養基、胎牛血清、TRIzol試劑和Lipofectamine 2000試劑購自Invitrogen;TaqMan反轉錄試劑盒和SYBR Green qPCR試劑盒購自Applied Biosystems;miR-29a-3p模擬物(miR-29a-3p mimic)、miR-144a-3p mimic、let-7a-5p mimic、miR-26a-5p mimic和陰性對照miRNA(negative control miRNA,NC-miR)由蘇州吉瑪基因股份有限公司合成。
1.1.2NSCLC組織收集 本研究納入2018年9月~2019年6月南昌大學第一附屬醫院胸外科和腫瘤科行腫瘤切除術的20例NSCLC患者(臨床Ⅱ~Ⅲ期,其中6例發生淋巴結轉移,14例未發生淋巴結轉移),并收集腫瘤組織與配對的癌旁非腫瘤組織(距離腫瘤邊緣約2 cm)。NSCLC患者均為首次確診,且術前未進行放化療。本實驗通過了本院倫理委員會批準,且所有患者均知情同意參與本研究。
1.1.3細胞 人肺癌細胞A549、H460、H520和H1299為本實驗室自有;肺上皮細胞BEAS-2B和16-HBE購自上海一研生物科技有限公司。
1.1.4儀器 小型垂直蛋白電泳轉印系統(Bio-Rad公司,美國);iBright CL750型蛋白凝膠智能成像系統(Invitrogen公司,美國);BX53M型金相顯微鏡(Olympus公司,日本);QuantStudio 7 Flex型實時熒光定量PCR系統(Applied Biosystems公司,美國);FLx800型熒光酶標儀(BioTek公司,美國)。
1.2 方法
1.2.1細胞培養 A549、H460、H520、H1299、BEAS-2B和16-HBE細胞均接種在添加有10%胎牛血清和1%青霉素/鏈霉素的RPMI-1640培養液中,在37 ℃、5% CO2的培養箱中培養。
1.2.2細胞轉染 收集H520對數期細胞,接種于直徑35 mm培養皿中,按照轉染試劑制造商的說明書步驟,利用Lipofectamine 2000試劑將COL11A1 siRNA(10 nmol·L-1)、NC-siRNA(10 nmol·L-1)、miR-29a-3p mimic(20 nmol·L-1)、miR-144a-3p mimic(20 nmol·L-1)、let-7a-5p mimic(20 nmol·L-1)、miR-26a-5p mimic(20 nmol·L-1)和NC-miR(20 nmol·L-1)轉染入細胞。在轉染后48 h,收集細胞用于后續檢測。
1.2.3RNA提取與RT-qPCR檢測 按照制造商說明書步驟,運用TRIzol試劑提取NSCLC組織、癌旁非腫瘤組織、NSCLC細胞系和正常細胞系BEAS-2B和16-HBE中總RNA,利用TaqMan反轉錄試劑盒將各樣本總RNA逆轉為cDNA,以各樣本cDNA和各目的基因引物并利用SYBR Green qPCR試劑盒通過7500熒光定量PCR系統進行RT-qPCR檢測。miR-29-3p、miR-144-3p、let-7-5p和miR-26-5p以U6為內部參照,COL11A1以GAPDH為內部參照,以2-ΔΔCt法計算各目的基因相對表達量。qPCR運用的引物序列(5′-3′): miR-29a-3p (正向):GCGGCGG TAGCACCATCTGAAAT,miR-29a-3p (反向):ATCC AGTGCAGGGTCCGAGG;miR-144a-3p (正向): GCG CGCTACAGTATAGATGATG,miR-144a-3p(反向): GCTGTCAACGATACGCTACG;let-7a-5p(正向): CG ATTCAGTGAGGTAGTAGGTTGT,let-7a-5p(反向): TATGGTTGTTCTGCTCTCTGTCTC;miR-26a-5p(正向): ACACTCCAGCTGGGTTCAAGTAATCCAGGA,miR-26a-5p(反向): TGGTGTCGTGGAGTCG;U6(正向): GGAGCGAGATCCCTCCAAAAT,U6(反向): GGCTGTTGTCATACTTCTCATGG;COL11A1(正向): TGGTGATCAGAATCAGAAGTTCG,COL11A1(反向): AGGAGAGTTGAGAATTGGGAATC;GAPDH(正向): GTGGACATCCGCAAAGAC,GAPDH(反向): AAAGGGTGTAACGCAACTA。
1.2.4細胞活性和增殖檢測 用CCK-8法檢測細胞活性,按照說明書步驟,將已轉染的細胞種植在96孔中(4 000細胞/孔),繼續培養24、48和72 h,在各檢測時間點時,加入10 μL CCK-8溶液并繼續孵育2 h,用酶標儀在490 nm波長處檢測吸光值。用EdU法檢測細胞增殖,按照說明書步驟,將已轉染的細胞種植在96孔中(4 000細胞/孔),繼續培養24、48和72 h,在各檢測時間點時,加入10 μmol·L-1EdU溶液并繼續孵育45 min,4%多聚甲醛固定15 min,0.3%Triton-100透膜5 min,內源性過氧化氫酶封閉液封閉15 min,PBS洗滌細胞2次,加入50 μL Click反應液避光孵育30 min,PBS洗滌細胞2次,加入20 μL Streptavidin-HRP工作液孵育30 min,PBS洗滌細胞2次,加入100 μL TMB顯色液孵育10 min,用酶標儀在650 nm波長處檢測吸光值。
1.2.5Transwell檢測 用Transwell(濾膜8 μm孔徑,24孔板)法檢測細胞遷移與侵襲。100 μL已轉染的細胞懸液(5 000細胞/孔)加入Transwell上室濾膜上表面用于檢測細胞遷移,加入Transwell上室基質膠包被的濾膜上表面用于檢測細胞侵襲;下室加入600 μL含20%胎牛血清的培養基。在37 ℃、5% CO2下孵育24 h。取出腔室并擦除濾膜上表面細胞,95%甲醇固定濾膜下表面細胞,用0.5%結晶紫染色20 min,顯微鏡下對細胞計數。
1.2.6Western blot檢測 用RIPA裂解組織和細胞,并提取蛋白。用BCA試劑盒對蛋白定量,每樣本取等量蛋白,按照常規Western blot步驟進行操作。其中按照1 ∶1 000比例孵育一抗(COL11A1、Ki67和MMP-2),并采用ImageJ軟件,以β-actin為內部參照量化COL11A1、Ki67和MMP-2的相對表達量。
1.2.7熒光素酶報告實驗 將人COL11A1野生型(wild type,WT)和突變型(mutation type,MUT)3′-UTR進行PCR擴增,并克隆到pGL3-熒光素酶報告質粒中。用Lipofectamine 2000試劑將pGL3-COL11A1-3′UTR WT質粒+NC-miR、pGL3-COL11A1-3′UTR WT質粒+miR-29a-3p mimic、pGL3-COL11A1-3′UTR MUT質粒+NC-miR、pGL3-COL11A1-3′UTR MUT質粒+miR-29a-3p mimic或pGL3-COL11A1-3′UTR WT質粒+NC-miR、pGL3-COL11A1-3′UTR WT質粒+miR-144a-3p mimic、pGL3-COL11A1-3′UTR MUT質粒+NC-miR、pGL3-COL11A1-3′UTR MUT質粒+miR-144a-3p mimic共轉染入H520細胞中,48 h后,按照制造商說明書步驟,用雙熒光素酶報告基因檢測試劑盒測定螢火蟲和海腎熒光素酶相對發光度(relative light unit,RLU)。報告基因熒光活性=螢火蟲熒光素酶RLU/海腎熒光素酶RLU。
2 結果
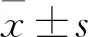
2.1 COL11A1在NSCLC組織和細胞中表達增高相對于癌旁組織,在NSCLC腫瘤組織中COL11A1的mRNA水平(Fig 1A)和蛋白水平(Fig 1B、C)明顯增加(P<0.01);且相對于非轉移的NSCLC的腫瘤組織,存在淋巴結轉移的NSCLC腫瘤組織中COL11A1的mRNA水平(Fig 1D)和蛋白水平(Fig 1E、F)也明顯增加(P<0.01)。在細胞學中,相對于正常肺上皮細胞系BEAS-2B和16-HBE,在NSCLC細胞系H460、H520、A549和H1299中COL11A1的mRNA水平(Fig 1G)和蛋白水平(Fig 1H、I)也明顯增加(P<0.01)。
2.2 敲低COL11A1抑制H520細胞增殖、遷移與侵襲通過轉染COL11A1 siRNA用于敲低H520細胞中COL11A1的表達(Fig 2A、B),發現敲低COL11A1明顯抑制Ki67表達(Fig 2C、D)、細胞活性(Fig 2E)、細胞增殖(Fig 2F)、MMP-2表達(Fig 2G、H)、細胞遷移(Fig 2I、J)和侵襲(Fig 2I、K)(P<0.05或P<0.01)。
2.3 與COL11A1具有靶向關系的miRNAs的尋找與驗證TargetScan 7.2軟件預測有4個miRNAs(miR-29a-3p、miR-144a-3p、let-7a-5p、miR-26a-5p)與COL11A1的3-UTR區域具有潛在的結合序列,因此,本實驗首先檢測此4個miRNAs在NSCLC組織中的表達,結果(Fig 3A)顯示,與癌旁組織比較,在NSCLC腫瘤組織中此4個miRNAs表達水平均明顯降低(P<0.01)。在H520細胞上檢測miR-29a-3p(Fig 3B)和miR-144a-3p(Fig 3C)表達水平,發現與BEAS-2B和16-HBE比較,在H520細胞中miR-29a-3p和miR-144a-3p表達水平也明顯降低(P<0.01)。進一步對H520轉染4個miRNAs的mimic(Fig 3D、E),發現與NC-miR比較,在H520細胞中轉染miR-29a-3p mimic和miR-144a-3p mimic能明顯抑制COL11A1表達(P<0.01),而轉染let-7a-5p mimic或miR-26a-5p mimic對COL11A1表達無影響,提示miR-29a-3p和miR-144a-3p可能與COL11A1具有靶向關系,而let-7a-5p和miR-26a-5p與COL11A1不具有靶向關系。為驗證miR-29a-3p或miR-144a-3p與COL11A1是否具有靶向關系,對預測的miR-29a-3p(Fig 3F)或miR-144a-3p(Fig 3H)的靶向結合位點進行點突變,雙熒光素酶證實COL11A1是miR-29a-3p(Fig 3G)或miR-144a-3p(Fig 3I)的靶基因。

Fig 1 Over-expression of COL11A1 in NSCLC tumor tissues and cells
2.4 過表達miR-29a-3p或miR-144a-3p抑制H520細胞增殖、遷移與侵襲通過轉染miR-29a-3p mimic或miR-144a-3p mimic顯著H520細胞的細胞活性(Fig 4A)、細胞增殖(Fig 4B)、抑制Ki67表達(Fig 4C、D)、MMP-2表達(Fig 4E、F)、細胞遷移(Fig 3G、H)和侵襲(Fig 3G、I)(P<0.05或P<0.01)。
3 討論
肺癌是最常見的惡性腫瘤之一,在我國肺癌的發病率和死亡率均占據所有腫瘤的首位[13]。NSCLC約占所有肺癌的85%,且NSCLC起病隱匿、早期病癥不明顯、容易被忽視,造成約75%的NSCLC患者確診時已處于中晚期[2]。因此,研究NSCLC發生發展的機制,明確NSCLC的基因靶點,對NSCLC的診斷和治療具有重要意義。最近的研究顯示,COL11A1可以調節卵巢癌、結腸癌和胃癌等多種腫瘤細胞的細胞增殖、凋亡、化療敏感性、侵襲和遷移,其在多種腫瘤中發揮致癌和促癌的特性[5-6,14-15]。且已有研究發現,COL11A1可能是NSCLC有價值的診斷標志物,其可參與調節NSCLC細胞增殖、化療敏感性、遷移與侵襲[8,16]。但在NSCLC中調節COL11A1表達改變的上游分子仍不明確,有待進一步研究。本實驗首先確認了COL11A1在NSCLC腫瘤組織和NSCLC細胞中高表達,敲除COL11A1表達能抑制NSCLC細胞增殖、遷移與遷移,這與之前的研究一致[12]。
眾所周知,miRNAs可通過調控其靶基因的表達來發揮其生物學功能[10-11]。TargetScan7.2預測軟件顯示有4種miRNAs(miR-29a-3p、miR-144a-3p、let-7a-5p和miR-26a-5p)與COL11A1的3’-UTR區可能具有潛在結合序列。因此,本研究通過熒光素酶報告基因實驗和miRNAs mimic轉染技術對與COL11A1可能具有靶向關系miRNAs進行了篩選與確認,結果發現,在NSCLC細胞中miR-29a-3p和miR-144a-3p與COL11A1具有靶向關系,且miR-29a-3p和miR-144a-3p可負調控靶基因COL11A1表達。已有研究表明,此2種miRNAs在甲狀腺癌、肝癌和膠質瘤等多種腫瘤中可作為腫瘤抑制因子發揮作用[10-11,17]。本實驗進一步研究結果顯示,miR-29a-3p和miR-144a-3p在NSCLC腫瘤組織和細胞中低表達,且過表達miR-29a-3p和miR-144a-3p能發揮與COL11A1敲低類似的生物學作用。這些結果表明,miR-29a-3p和miR-144a-3p能通過下調靶基因COL11A1表達抑制NSCLC細胞增殖、遷移與侵襲。

Fig 2 Proliferation,migration and invasion of H520 cells inhibited by knockdown of COL11A1
總之,我們的研究表明,miR-29a-3p和miR-144a-3p可能在NSCLC進展中作為一種潛在的腫瘤抑制因子。此外,miR-29a-3p和miR-144a-3p通過直接靶向COL11A1抑制NSCLC細胞增殖、遷移與侵襲。

Fig 3 Search and validation of miRNAs with a targeted relationship with COL11A1

Fig 4 Proliferation,migration and invasion of H520 cells

